
- •Конспект лекций*
- •Ведущий лектор:
- •1.1. Строение атома и периодическая система д.И. Менделеева.
- •2. Основные сведения по теории строения атома.
- •Экспериментально квантование энергии атомов обнаруживаегся в их
- •3. Квантово-механическая модель атома водорода.
- •4. Характеристика состояния электрона в атоме системой квантовых чисел. Атомные орбитали.
- •5. Принципы формирования электронной структуры атомов.
- •Соответственно принципу минимальной энергии и правилам Клечковского заполнение энергетических подуровней происходит в следующем порядке :
- •6. Периодическая система д.И. Менделеева как естественная классификация элементов по электронному строению.
- •6.1. Периодическая система д.И. Менделеева и электронная структура.
- •6.2. Структура периодической системы химических элементов.
- •Лекция 2. Химическая связь
- •1. Основные типы и характеристики химической связи
- •Энергия химической связи (кДж/моль) - это количество энергии, выделяющееся при образовании химической связи или затрачиваемое на ее разрыв.
- •2. Ионная связь
- •Метод валентных связей рассматривает молекулу как систему из суммы отдельных связей. Такое представление не характеризует химическую реакционную способность молекул с большим числом связей.
- •Сигма - связь (-) -это связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
- •Например, вследствие sp- гибридизации орбиталей атома углерода многие соединения (сн4, cCl4) имеют форму тетраэдра:
- •4. Металлическая связь
- •5. Основные виды межмолекулярного взаимодействия.
- •6. Донорно-акцепторное взаимодействие
- •7. Водородная связь.
- •Раздел 2. Основные закономерности протекания химических процессов.
- •1.Основные понятия термодинамики.
- •2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
- •3. Факторы, определяющие глубину и направленность химических реакций. Понятие об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
- •При нормальных температурах и незначительном изменении s:
- •4. Термодинамические представления о равновесном состоянии.
- •Химическая кинетика
- •Химическое и адсорбционное равновесие
- •Лекция 5. Растворы.
- •3. Водные растворы электролитов. Теории кислот и оснований. Сильные и слабые электролиты. Активность. Свойства растворов электролитов.
- •4. Ионные реакции в растворах. Условия одностороннего протекания реакций обмена.
- •5. Произведение растворимости. Механизм накипеобразования.
- •Осадок кристаллизация раствор
- •6. Водородный показатель среды, его роль в технологических операциях на флоте. Гидролиз солей.
- •Лекция 6. Электрохимические процессы
- •1. Понятие об электродном потенциале
- •Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- •2. Гальванические элементы
- •3. Стандартный водородный электрод и водородная шкала потенциалов
- •Пример 2 Уравнение
- •Электролиз. Законы фарадея
- •1) Катионы металлов со стандартным электродным потенциалом, большим, чем у водорода, почти полностью восстанавливаются на катоде и выделяются в виде металла.
- •2. Химическая и электрохимическая коррозия. Виды коррозии, встречающиеся в судовой практике.
- •Коллоидные растворы.
- •Общие свойства металлов
- •Разбавленная азотная кислота восстанавливается малоактивными
- •Алканы.
- •Непредельные углеводороды.
- •Нафтены ( циклопарафины ).
- •Ароматические углеводороды.
- •Список рекомендуемой литературы
6. Донорно-акцепторное взаимодействие
Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподелённых электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3 + BF3 = NH3BF3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно - акцепторному механизму атом азота отдает на связь пару электронов, а атом бора - вакантную орбиталь, в результате чего возникает ковалентная связь:

донор акцептор
Аналогичным образом образуется комплексное соединение при взаимодействии сульфата меди и аммиака:
CuSO4 + 4NH3 = [Cu (NH3)4] SO4
7. Водородная связь.
Водородная связь осуществляется между поляризованным водородом одной молекулы и каким-то электроотрицательным атомом или группой атомов другой или одной и той же молекулы (например, кислородом, гидроксогруппой, фтором, азотом, карбоксильной группой, реже хлором, серой и др.):

С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В). Последняя связь получила название водородной. Ее обычно изображают точками или пунктиром.
Водородная связь - это промежуточный случай между ван-дер-ваальсовым взаимодействием и ковалентной связью. Она по прочности превосходит ван-дер-ваальсово взаимодействие, и ее энергия составляет 8 - 40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи.
Например, в твердом, жидком и даже в газовом состоянии молекулы фторида водорода НF ассоциированы в зигзагообразные цепочки вида

,
что обусловлено водородной связью.
Молекула воды может образовывать четыре водородные связи, так как имеет два атома водорода и две несвязывающие электронные пары:
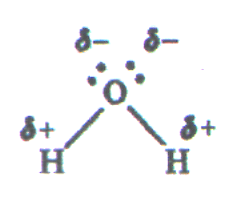
Эта способность молекулы воды обусловливает строение воды и льда.
Раздел 2. Основные закономерности протекания химических процессов.
2.1. Основные понятия химической термодинамики.
Основные понятия термодинамики.
Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
Факторы, определяющие глубину и направленность химических реакций. Понятия об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
Термодинамические представления о равновесном состоянии.
1.Основные понятия термодинамики.
Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, зависимость их от условий протекания, вероятность самопроизвольного течения процесса, их направление и пределы.
Термодинамический подход к изучению систем состоит в том, чтобы мысленно изолировать объект исследования от окружающей среды, называемой термодинамической системой.
Система, лишенная возможности обмена веществом или энергией с окружающей средой и имеющая постоянный объём, называется изолированной или замкнутой.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами.
Различают гомогенные и гетерогенные системы.
Гомогенная система – это однородная система, имеющая одну фазу (воздух, любая газовая смесь и т.д.).
Гетерогенная система – это система, имеющая две или более фазы (насыщенный раствор с осадком, уголь в атмосфере воздуха).
Различают фазовые и химические превращения. При химических превращениях изменяется состав и свойства химических соединений. При фазовых превращениях не затрачивается состав и свойства химического вещества (плавление льда, превращение воды в пар и т.д.)
Совокупность термодинамических свойств системы называется её состоянием.
Величины, позволяющие определить состав системы, называются параметрами (состав, концентрация, давление, объём, температура).
Состав системы может быть равновесным и неравновесным.
Равновесное состояние – это такое состояние системы, которое с течением времени самопроизвольно не изменяется (т.е. без каких-либо внешних воздействий на систему её параметры остаются неизменными). Напротив, состав системы будет неравновесным, если параметры её изменяются во времени при отсутствии внешнего воздействия.
Равновесное состояние может быть устойчивым и ограниченным (метостабильное состояние), причём в ограниченном состоянии система стремится занять устойчивое состояние.
Переход термодинамической системы из одного состояния в другое, сопровождающееся изменением параметров системы, называется процессом.
Процесс, при котором термодинамическая система, пройдя через ряд промежуточных состояний, возвращается в исходное состояние, называется круговым процессом или циклом.
В зависимости от того, какие параметры системы при переходе её из одного состояния в другое, остаются постоянными, процессы делятся на:
изотермические (Т = const),
изохорические (V = const),
изобарические (P=const),
адиабатические (отсутствует теплообмен с окружающей средой).
Параметры системы дают возможность ввести переменные, позволяющие характеризовать состояние системы, следовательно, происходящие в ней изменения. Это термодинамические функции:
внутренняя энергия u,
энтальпия H,
энтропия S,
энергия Гиббса G.
Данные функции являются функциями состояния, т.е. их значения определяются только начальными и конечными параметрами системы и не зависят от пути перехода, по которому протекает процесс.
