
- •Введение
- •1. Обзор литературы
- •2. Технологический раздел
- •2.1. Свойства меди
- •2.3. Технология плавки меди в индукционной печи
- •2.4. Разливка меди
- •2.4.1. Выпуск плавки
- •2.4.3. Метод разливки меди
- •2.4.4. Длительность затвердевания слитков
- •2.4.5. Остановка печи после конца плавки
- •2.5. Эксплуатация и ремонт итп
- •2.5.1. Техническое обслуживание
- •3. Конструкторский раздел
- •3.1. Футеровка индукционной тигельной печи
- •3.1.1. Требования к футеровке
- •3.2.1. Схемы индуктора
- •3.2.2. Охлаждение индуктора
- •3.3. Каркас печи
- •3.4. Магнитопроводы и экраны
- •3.5. Механизм наклона печи
- •3.6. Контактное устройство
- •3.8. Источник питания итп
- •4.1. Основные этапы расчета итп
- •4.1.2. Расчет и выбор частоты тока
- •М. (4.35)
- •Коэффициент приведения параметров и приведенные активное и реактивное сопротивления
- •Общее число конденсаторов
- •4.1.19. Выбор параметров источника питания
- •6. Экономические расчеты
- •Расчёт затрат и определение цены единицы изделия
- •* Информация взята с сайта http://rusmetmail.Ru2013 год. Транспортные расходы составляют 8% от стоимости материалов
- •Основная заработная плата производственных рабочих составляет
- •Дополнительная заработная производственных рабочих составляет
- •Страховые взносы
- •Суммарные затраты на заработную плату с начислениями
- •Затраты на ремонт и содержание оборудования Сремсоставляют 120% от основной заработной платы основных производственных рабочих зп0. Производственная себестоимость Спрявляется суммой затрат
- •Полная себестоимость Сполнпредставляет собой себестоимость с учётом коммерческих расходов 10,5% от производственной себестоимости. Затраты по статьям калькуляции приведены в табл. 6.5.
- •Калькуляция на илт-1,0
- •Таким образом, цена индукционной тигельной печи илт-1,0 составляет 2304966,10 рублей.
- •В табл.6.6 приведены компоненты, составляющие комплекс с индукционной тигельной печью илт-1,0 и их стоимость на рынке электротехнической продукции.
- •7. Безопасность жизнедеятельности
- •7.1. Введение
- •Для приема всего количества расплавленного металла в случае аварийного наклона печи или отключения электропитания предусмотрен огражденный металлоприемник или литейная яма.
- •7.2. Безопасность проекта
- •7.2.1. Характеристика опасных и вредных производственных факторов
- •7.2.1.1. Мероприятия по обеспечению травмобезопасности
- •Б) высокой температуры (жаркими помещениями называют помещения, в которых температура длительно превышает плюс 30°с); в) возможности одновременного прикосновения человека к имеющим соединение
- •7.2.1.3. Общие требования и номенклатура защит
- •7.2.2. Гигиеническая оценка условий труда
- •7.2.2.1. Состояние воздуха рабочей зоны: микроклимат
- •7.2.2.1.1. Системы оздоровления
- •7.2.2.2. Освещенность
- •7.2.2.3. Виброакустические факторы
- •7.2.2.4. Энергетическое воздействие
- •7.2.2.5. Нормы и способы защиты
- •7.2.2.6. Пожарная безопасность
- •Стационарные огнетушители углекислотные типа оу – 2, оу – 5, войлок или брезент. Запрещается заливать пламя водой!
- •7.3. Чрезвычайные ситуации
- •7.4. Пропускной режим
- •9. Исследование режима работы индукционной тигельной печи емкостью 1 тонна при плавке алюминия
2. Технологический раздел
2.1. Свойства меди
Медь (лат. Cuprum) – химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546). В соединения медь обычно проявляет степени окисления плюс 1 и плюс 2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu2O, CuO, Cu2O3; гидроксид Cu(OH)2, нитрат Cu(NO3)2·3H2O, сульфид CuS, сульфат (медный купорос) CuSO4·5H2O, карбонат CuCO3, Cu(OH)2, хлорид CuCl2·2H2O.
Медь – один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4-3 - е тысячелетие до н.э.) назывался медным веком или халколитом (от греческого chalkos – медь и lithos - камень) или энеолитом (от латинского aeneus – медный и греческого lithos - камень). В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь – ковкий и мягкий металл красноватого, в изломе розового цвета, местами с бурой и пестрой побежалостью, тяжелый (плотность 8,93·103 кг/м3), отличный проводник тепла и электричества, уступая в этом отношении серебру (температура плавления 1083º С). Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом воздухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с серой, с селеном. С водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
В атмосфере, содержащей CO2, пары H2O и др., покрывается патиной – зеленоватой пленкой основного карбоната (Cu2(OH)2CO3), ядовитого вещества.
Медь входит более чем в 170 минералов, из которых для промышленности важны лишь 17, в том числе: борнит (пестрая медная руда – Cu5FeS4), халькопирит (медный колчедан – CuFeS2), халькозин (медный блеск – Cu2S), ковеллин (CuS), малахит (Cu2(OH)2CO3). Встречается также самородная медь.
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования, вакуум-аппараты, трубопроводы. Более 30 % меди идет на сплавы. Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость и пластичность металла позволяют применять медь для изготовления разнообразных изделий с очень сложным узором. Проволока из красной меди в отожженном состоянии становиться настолько мягкой и пластичной, что из нее без труда можно вить всевозможные шнуры и выгибать самые сложные элементы орнамента. Кроме того, проволока из меди легко спаивается сканым серебряным припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым материалом при производстве филигранных изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же, как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается, не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата – медного купороса CuSO4·5H2O. В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому [4].
2.2. Подготовка шихты
Технологическая схема производства показана на рис. 2.1.
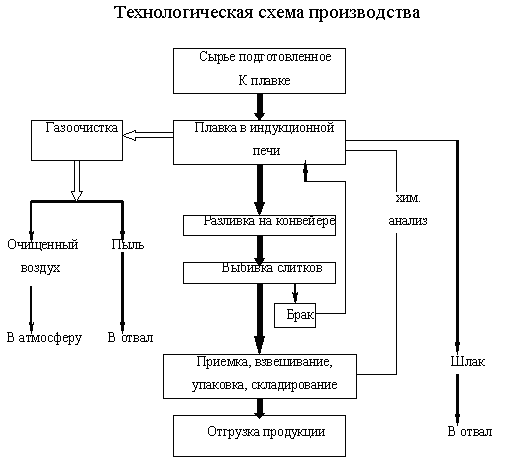
Рис.2.1
Исходным материалом для плавки меди являются отходы производства при обработке меди (стружка, бракованные изделия, предварительно размельченные).
Поступающее на предприятие сырье принимает специальный вспомогательный цех, имеющий разветвленную сеть железнодорожных подъездных путей и шихтовые склады с соответствующим фронтом разгрузки, исключающим непроизводительные простои транспорта. Шихтовые склады рассчитаны на хранение минимум месячного запаса необходимого сырья [5].
Все поступающее на склады сырье взвешивают на железнодорожных весах. Кусковые материалы хранят на открытых площадках или в бункерах, концентраты – обязательно в закрытых помещениях.
Массивные куски шихты проходят трехстадийное дробление до размеров порядка 35 мм в специальном дробильном отделении, оборудованном челюстными, коническими и валковыми дробилками. Дробленые материалы и концентраты поступают на шихтовку или прямо к печи по транспортерам.
