
- •7. Біологія імунної відповіді
- •7.1. Цитокіни та їх роль у регуляції імунної відповіді
- •7.1.1. Інтерлейкіни
- •7.1.2. Інтерферони
- •7.1.3. Колонієстимулюючі фактори
- •7.1.4. Фактори некрозу пухлин
- •7.1.5. Хемокіни
- •7.2. Головний комплекс гістосумісності (мнс) та його роль
- •І, іі, ііі класів на 6-й хромосомі людини
- •7.3. Кооперативна взаємодія клітин у ході імунної відповіді
- •7.3.1. Т-незалежна імунна відповідь
- •7.3.2. Т-залежна імунна відповідь
- •У ході імунної відповіді
- •7.4. Загальна картина імунної відповіді
- •У відповідь на мікробні антигени
- •7.5. Взаємодія імунної, ендокринної та нервової систем
- •7.6. Інфекційний імунітет
- •7.6.1. Противірусний імунітет
- •7.6.2. Антибактеріальний імунітет
- •7.6.3. Імунітет проти грибів
- •7.6.4. Імунітет до найпростіших
- •7.6.5. Імунітет до гельмінтів
- •7.7. Трансплантаційний імунітет
- •7.8. Протипухлинний імунітет
- •Питання для контролю засвоєння матеріалу
- •Відповіді на тести
7.6. Інфекційний імунітет
Як відзначалося раніше, імунна відповідь завжди є комплексною і складається з багатьох механізмів захисту, але залежно від природи та властивостей антигенів ті чи інші механізми імунітету будуть виражені сильніше. Найбільш складний характер мають протимікробний та протипаразитарний види імунітету, тому що антигени мікроорганізмів та гельмінтів дуже різноманітні і не однаковою мірою здатні індукувати синтез цитокінів, антитіл, клітинні реакції тощо. Крім того, від особливостей інвазії та виду паразитизму (зовнішньо- або внутрішньоклітинний) залежить переважний механізм імунної відповіді – гуморальний чи клітинний. Так, у відношенні мікроорганізмів, які вільно знаходяться у крові, міжклітинній рідині та ексудатах організму, найбільш ефективні гуморальні фактори, такі як лізоцим, комплемент, антитіла. Для знищення мікробів, здатних проникати всередину клітин і розмножуватися там, найбільш важливі клітинні реакції імунітету – неімунний та імунний фагоцитоз, цитотоксична дія Т-лімфоцитів (Т-кілерів), кілинг за допомогою NK-, Pit- та інших клітин системи кілерів. Те, який з перелічених механізмів буде найбільш ефективним, залежить від поведінки мікроорганізма, його дози, місця і способа введення, імунного статусу і реактивності макроорганізму та багатьох інших факторів.
Послідовність вмикання тих чи інших механізмів імунітету залежить не тільки від специфіки антигену, а ще й від того, чи потрапив антиген в організм вперше (первинна імунна відповідь), чи контакт з макроорганізмом вже відбувався раніше (вторинна імунна відповідь). Якщо попередній контакт з антигеном був відсутній, то першими, через лічені хвилини, “на сцену виходять” фактори неспецифічної резистентності – фагоцити (нейтрофіли, макрофаги), лізоцим, інтерферон, комплемент, постійно присутні в організмі незалежно від наявності антигену. І тільки пізніше, через декілька днів, розвивається антитільна та клітинна відповіді за рахунок активації “відібраних” антигеном В- і Т-лімфоцитів (реакції специфічної резистентності – власне імунна відповідь). При вторинній імунній відповіді специфічні фактори імунітету вмикаються значно скоріше завдяки клітинам імунологічної пам‘яті, які були відселекціоновані і запрограмовані на даний антиген ще при першому контакті з ним.
Залежно від збудника інфекційного процесу виділяють противірусний, протибактеріальний, протигрибковий, антипротозойний та антигельмінтний види імунітету.
7.6.1. Противірусний імунітет
Противірусний імунітет виникає при проникненні в організм вірусів.
Віруси – дуже малі за розміром живі організми, які не мають клітинної будови. Це нуклеопротеїдні частки, що складаються з нуклеїнової кислоти (ДНК чи РНК), оточеної найпростішою білковою оболонкою – капсидом. Але деякі складні віруси на поверхні капсиду мають ще додаткову оболонку, яка місцями нагадує цитоплазматичну мембрану клітинних організмів. Вважають, що вона виникає шляхом екзоцитозу вірусів з клітини-хазяїна і в подальшому може екранувати вірусні антигени і захищати віруси від імунного розпізнавання. Поза клітинами хазяїна віруси не здатні ні до реплікації, ні до метаболізму. Це облігатні внутрішньоклітинні паразити. Остаточна класифікація вірусів ще не розроблена, на теперішній час відомо більше 20 родин вірусів тварин, здатних викликати захворювання, в тому числі й у людей. В основу їх класифікації покладено форму, розміри, природу генома (ДНК чи РНК), спосіб виходу з клітини хазяїна (відбруньковування, цитоліз) та інші характеристики.
Розвиток вірусної інфекції – дуже складний процес. Спочатку вірусні частки зв’язуються із специфічними рецепторами на поверхні клітин хазяїна, наприклад, вірус Епштейна-Барр – з CR2-рецептором комплемента, вірус імунодефіциту людини – з CD4-молекулами Т-хелперів, вірус сказу – з ацетилхоліновими рецепторами нейронів, вірус грипу типа А – з глікофорином А тощо. Після проникнення віруса у клітину хазяїна відбувається його “роздягання” – гідроліз капсиду з вивільненням нуклеїнової кислоти.
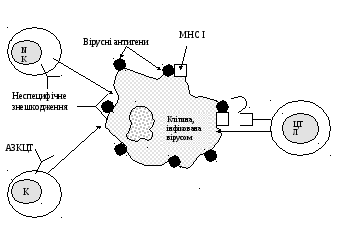
Рис. 7.5. Механізми знешкодження інфікованих вірусом клітин
Нормальні кілери (NK) здійснюють неспецифічне руйнування інфікованих вірусом клітин на ранніх етапах інфекції; К-клітини за допомогою специфічних антитіл забезпечують реакції антитілозалежної цитотоксичності (АЗКЦТ); цитотоксичні лімфоцити (ЦТЛ, Т-кілери) розпізнають вірусні антигени, експресовані у комплексі з МНС-І на поверхні клітин-мішеней, та спричиняють їх кілинг.
Потім починається транскрипція з вірусних генів і синтез “ранніх” вірусних білків. Це робить можливим реплікацію генома вірусу. Розмножені геномні копії “одягаються”у капсиди із синтезованих у клітині хазяїна капсидних білків. Далі вірусні частки виходять у міжклітинний простір, що супроводжується загибеллю клітини-хазяїна та зараженням сусідніх клітин і тканин.
Частіше всього віруси проникають у макроорганізм крізь слизові оболонки, пошкоджену шкіру, через укуси комах або парентеральним шляхом – при переливанні крові, ін’єкціях тощо. Розмноження вірусів звичайно відбувається в епітеліальних тканинах, але іноді віруси проникають у кров (віремія), розповсюджуються та інфікують інші тканини.
Протистояння вірусній інфекції забезпечується факторами неспецифічної і специфічної резистентності. До факторів першої групи – вроджений імунітет– належать захисні бар’єри шкіри та слизових оболонок, інтерферони, макрофаги і NK-клітини. Сукупність факторів специфічної резистентності (антитіла, Т-хелпери, Т-кілери, АЗКЦТ, інші механізми специфічного розпізнавання) формує набутий (адаптивний) імунітет.
Найважливішу роль у противірусному захисті відіграють інтерферони – ІF- (лейкоцитарний), ІF- (фібробластний) і ІF- (лімфоцитарний). Особливою противірусною дією відрізняються ІF- і ІF-, які виробляються вірусінфікованими клітинами. Виявилося, що природним індуктором синтезу ІF- та ІF- є двоспіральні молекули РНК, які характерні для деяких вірусних геномів, а також зустрічаються серед продуктів життєвого циклу вірусів. Існує декілька механізмів прояву антивірусної дії інтерферонів. По-перше, інтерферони індукують транскрипцію генів, продукти яких пригнічують реплікацію вірусної і власної ДНК. Це дозволяє використовувати препарати інтерферонів, отримані методами генної інженерії, для профілактики і лікування не тільки вірусних інфекцій, але й онкологічних захворювань. Інший механізм противірусної дії ІF- і ІF- полягає в індукції ними деяких ферментів, наприклад, олігоаденілатсинтетази, яка через ланцюг проміжних реакцій викликає розщеплення вірусної РНК ендорибонуклеазами. Ще один фермент – серин/треонінкіназа, синтез якого індукується інтерфероном, – інактивує фактор ініціації трансляції eIF-2, через що припиняється синтез вірусних білків і реплікація вірусного генома. Крім того, ІF- і ІF- посилюють експресію молекул МНС-1 на поверхні антигенпрезентуючих клітин, що важливо для вмикання клітинної імунної відповіді. ІF-, як і інші інтерферони, теж інгібує розмноження вірусів, індукує синтез ІF- і ІF-, посилює дію макрофагів і NK-клітин. Він синтезується активованими Т-лімфоцитами, стимулює експресію молекул МНС-І і МНС-ІІ, тим самим посилює специфічну імунну відповідь, тому повинен розглядатися як фактор специфічного противірусного захисту. Фактор некрозу пухлин (TNF) також проявляє ряд противірусних ефектів подібно до ІF-, але іншими шляхами.
Дуже важливу роль у знищенні вірусінфікованих клітин відіграють реакції кілингу (клітинний імунітет), які відбуваються під дією NK-клітин (природних кілерів) і цитотоксичних Т-лімфоцитів (Т-кілерів, CD8). Оскільки NK-клітини викликають антигеннезалежний лізис інфікованих клітин-мішеней, їх відносять до факторів неспецифічної резистентності. Природні кілери проявляють активність у відношенні уражених вірусом клітин вже у перші години інфікування, коли на них ще не експресовані антигени МНС-І і не можливе “подвійне розпізнавання” антигенів Т-лімфоцитами. NK-клітини діють швидше і ефективніше, ніж Т-кілери. Лізис відбувається шляхом утворення пор у оболонці інфікованих клітин-мішеней за допомогою білків-перфоринів, які виділяються NK-клітинами. Крізь утворені пори у вірусінфіковані клітини надходить вода, що призводить до розриву плазматичної мембрани і загибелі клітини. Це супроводжується пошкодженням тканин і часто розвитком запальної реакції. Раніше важливим фактором противірусного імунітету вважалися також К-клітини, для яких описано характерну реакцію антитілозалежної клітинної цитотоксичності (АЗКЦТ) – кілинг клітин-мішеней, на поверхні яких вірусні антигени вже з’вязані з антитілами. Але на сьогодні більшість дослідників вважають, що К-клітини являють собою більш зрілу та диференційовану форму NK-клітин, в яких вже з’явилися рецептори для зв’язування з імуноглобулінами. Таким чином, NK-клітини на різних стадіях диференціації, залежно від експресованих на їх поверхні рецепторів, здатні здійснювати як неспецифічні реакції кілингу, так і специфічні, опосередковані антитілами. NK-клітини є головним ефекторним механізмом протистояння герпесній та цитомегаловірусній інфекціям.
Подібний до NK-клітин механізм кілингу характерний і для цитотоксичних Т-лімфоцитів (Т-кілерів, CD8) але вони розпізнають вірусні антигени тількі у комплексі з МНС-І, які з’являються тільки через декілька днів від вторгнення вірусів, після “подвійного розпізнавання” антигенів (реакція специфічної резистентності). Слід зауважити, що остаточна доля вірусів після лізису клітини-хазяїна не зовсім зрозуміла і залежить, очевидно, від стадії життєвого циклу самого вірусу. Якщо кілингу піддається клітина, в якій вже утворилося нове покоління вірусних часток, це може призвести до більш швидкого інфікування сусідніх клітин. Подібне явище відзначали при введенні хворим на гепатіт С індуктора ендогенного інтерферону – циклоферону. Останній, індукуючи синтез інтерферону в огранізмі хворих, призводив до посилення активності кілерів, що супроводжувалося розповсюдженням вірусів серед гепатоцитів.
В останні роки встановлено нову функцію Т- лімфоцитів CD4, які раніше розцінювалися тільки як Т-хелпери. Виявилося, що при кору в організмі утворюються цитотоксичні Т-лімфоцити з CD4-рецепторами, які викликають лізис уражених вірусом макрофагів, впізнаючи на їх поверхні вірусні антигени, асоційовані з МНС-ІІ. Даний факт свідчить, що поділ Т-лімфоцитів за їх функціями (хелпери, кілери, супресори тощо) є досить штучним і відносним.
Макрофаги також виконують ряд противірусних функцій: продукують інтерферон, представляють вірусні антигени для розпізнавання Т- і В-лімфоцитам, здійснюють фагоцитоз. Але у макрофагів, на відміну від гранулоцитів, інтенсивність “окислювального вибуху” не досить висока, тому незавершений фагоцитоз закінчується тим, що деякі віруси зберігають життєздатність і починають розмножуватися у самих макрофагах. Наприклад, вірус імунодефіциту людини (ВІЛ) здатний розмножуватися не тільки у Т-хелперах, як вважалося раніше, але й у макрофагах.
Хоча клітинний імунітет відіграє головну роль у противірусному захисті, антитіла також мають важливе значення в елімінації вірусів. Першою перепоною на шляху проникнення вірусів є секреторні імуноглобуліни класу А (sIgA), розташовані на слизових оболонках і, очевидно, малоспецифічні у зв’язуванні різних антигенів. У вакцинованому організмі, а також при повторному інфікуванні, специфічні антитіла блокують проникнення вірусів у клітини і розповсюдження їх з кров’ю. Віруснейтралізуюча дія антитіл проявляється найбільш ефективно при позаклітинній локалізації збудника, але показано, що введення моноклональних антитіл може пригнічувати і репродукцію вірусів. Крім того, антитіла здатні активувати систему комплемента, що забезпечую лізис інфікованих клітин за рахунок утворення в їх оболонці мембранатакуючого комплексу. Наявність високих титрів антитіл запобігає вторинному інфікуванню тканин при цитолізі інфікованих клітин. Але слід відзначити, що деякі віруси мають такий мінливий геном, що імунна система не встигає розпізнавати ці зміни, тому гуморальний антитільний імунітет є малоефективним, так само малоефективна і вакцинація. До таких вірусів належать вірус грипу, аденовіруси (інфекції очей та носоглотки), ріновіруси (віруси звичайної застуди), вірус імунодефіциту людини (ВІЛ).
Противірусний імунітет не завжди буває досить ефективним і часто не приводить до повної елімінації даних мікроорганізмів. Одні віруси (віспи, жовтої лихоманки, паротиту) здатні викликати гострий інфекційний процес і врешті знищуються імунною системою хазяїна зі збереженням стійкого тривалого імунітету. Віруси герпесу, цитомегалії навпаки довго персистують в організмі у неінфекційній (латентній) формі після затухання гострої інфекції і періодично викликають загострення з появою нових інфекційних вірусних часток. Ентеровіруси, зокрема вірус поліомієліту, оминають імунологічний нагляд і є причиною “уповільнених” вірусних інфекцій.
У відповідь на різноманітні механізми резистентності макроорганізму віруси виробляють механізми пристосування для оминання імунологічного контролю. Для деяких з них (вірусу грипу, ящура, ВІЛ) характерна дуже висока антигенна мінливість за рахунок дрейфу генів (поступові зміни в геномі) або шифту (різкі зміни). Антитіла будуть ефективними тільки у відношенні до того серотипу, який викликав їх утворення. Іноді самі антитіла, зв’язуючи своїм Fc-фрагментом глікопротеїни капсиду, приводять до зміни антигенної специфічності вірусів. Аденовіруси, вірус Епштейна-Барр здатні протидіяти інтерферонам, цитомегаловірус не розпізнається цитотксичними Т-лімфоцитами. Окремі віруси кодують синтез аналогів цитокінів, що веде до дезінтеграції налагоджених цитокінових зв’язків між клітинами імунної системи.
Перебіг вірусної інфекції може викликати розвиток патологічних процесів і утворення аутоантитіл. При хронічних і персистентних інфекціях, а також при надлишку вірусних антигенів антитіла втрачають здатність нейтралізувати віруси, але викликають формування імунних комплексів, які циркулюють у крові, осідають на стінках кровоносних судин, у нирках, викликають запальні реакції та пошкодження тканин. За такою схемою може розвиватися гломерулонефрит, васкуліт та інші аутоімунні хвороби. При гепатиті В у сироватці виявляються аутоантитіла до “змінених” гепатоцитів та імунні комплекси, крім того, гепатоцити страждають від цитотоксичної дії Т-кілерів. Вірус епідемічного паротиту не тільки вражає статеві придатки у чоловіків, але й може викликати їх аутоімунні пошкоження, цей же вірус викликає склерозуючий паненцефаліт і, можливо, розсіяний склероз. При лімфоцитарному хоріоменінгіті активовані вірусом цитотоксичні Т-лімфоцити пошкоджують тканини мозку. Є підстави вважати більшість аутоімунних захворювань (червона системна вівчанка, склеродермія, системні колагенози, поліневрити, міастенія та ін.) наслідком вірусних інфекцій.
У багатьох вірусів виявлено здатність виснажувати імунну систему навіть до розвитку набутих імунодефіцитів. Найбільш характерно це для ВІЛ, але й інші віруси (віспи, групи герпеса, грипу, лейкозів) мають імунодепресивну дію. Деякі віруси безпосередньо інфікують імунокомпетентні клітини: віруси Епштейна-Барр, інфекційної хвороби Бурси, мишачого герпесу уражують В-лімфоцити; ВІЛ, лімфотропний вірус, віруси кору і герпесу – Т-лімфоцити; ВІЛ, цитомегаловірус, вірус віспи – макрофаги. Вірус імунодефіциту людини має на своїй поверхні специфічний глікопротеїн gp120, який зв’язується з рецептором CD4 і з рецепторами для хемокінів CCR3 і CCR5. Це полегшує його проникнення у Т-лімфоцити, макрофаги та інші антигенпрезентуючі клітини.
