
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Вопросы и упражнения
5.3. Непредельные спирты и эфиры
Среди непредельных спиртов и простых эфиров также заслуживают особого внимания производные винильного типа и аллильного типа, обладающие особенностями строения и свойств.
5.3.1. Виниловый спирт и его эфиры
Виниловый спирт (и замещённые виниловые спирты) имеет в своём составе гидроксильную группу у атома углерода двойной связи. Это существенным образом отражается на кислотных свойствах таких соединений и на возможности других превращений, обусловленных наличием данного структурного фрагмента:
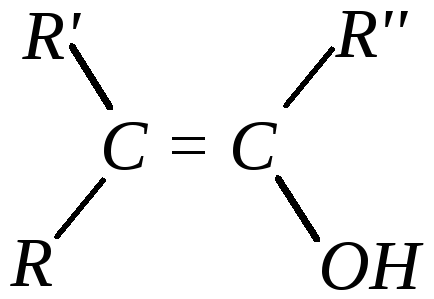
В связи с этим такие непредельные спирты получили название енолов.
Однако сами енолы существуют только в растворах в мизерной концентрации в равновесии с изомерными им карбонильными соединениями:

Енолы не удаётся выделить из реакционной смеси, и по правилу Эльтекова*–Эрленмейера* они изомеризуются в альдегиды и кетоны. Переход енола в карбонильное соединение происходит за счёт миграции водородного атома, обычно в виде протона. Но в то же время принципиально возможен переход карбонильного соединения в соответствующий енол. Таким образом, для рассматриваемого класса соединений характерна таутомерия. В зависимости от структуры соединения и природы растворителя содержание енола в равновесной смеси от 10-2 до 10-6 %.
Положение равновесия определяется сравнительной термодинамической стабильностью енола и карбонильного соединения. Обычно карбонильные соединения более стабильны по сравнению с енолами.
Енолы, подобно предельным спиртам, являются слабыми кислотами, при этом кислотность енолов больше вследствие эффекта р--сопряжения (их рКа 11 12 против 15 19 для насыщенных спиртов). При отрыве протона образуется алкоголят-ион, который в отличие от аниона предельного спирта обладает сопряжённой системой, поэтому енолят-ион является сопряжённым ионом, и заряд в нём делокализован между кислородным и углеродным атомами:

Енолят-ион имеет два реакционных центра, и протон может присоединиться в двух положениях — к атому кислорода или к атому углерода. При присоединении протона к атому углерода образуется связь C–Н — кислота значительно менее сильная, менее способная к диссоциации, чем ОН-кислота, образующаяся при протонировании атома кислорода в еноле. Константы кислотности этих двух реакционных центров различаются на 5—8 порядков, и поэтому эти соединения существуют преимущественно в карбонильной форме.
Простые эфиры енолов не содержат подвижного водородного атома, и в обычных условиях они не перегруппировываются в производные карбонильных соединений, например винилэтиловый эфир:

Общие закономерности химического поведения виниловых эфиров те же, что и для всех субстратов винильного типа, и рассмотрены в главе 5.1.2. Однако особенности их свойств могут быть связаны с протеканием реакций по связи О–Сsp3 — в частности, ацидолиз простых эфиров здесь должен проходить легче из-за влияния сопряжённого фрагмента, поляризующего -связь между атомом кислорода и насыщенным атомом углерода:
![]()
