
2. ОРГАНИЧЕСКАЯ_ХИМИЯ_В_СХЕМАХ_И_РИСУНКАХ
.pdf
3) со старшей функциональной группой (для гетерофункциональных соединений).
2.Пронумеровать родоначальную структуру так, чтобы наименьшие значения получили:
1) функциональная группа (для монофункциональных соединений);
2) максимальное число функциональных групп (для полифункциональных соединений);
3) старшая функциональная группа (для гетерофункциональных соединений).
3.Назвать все заместители (см. табл. 4,5)
4.Составить название согласно следующей схеме:
Приставка |
|
Корень |
|
|
Суффикс |
Окончание |
|||||||
Углеводородные |
|
Главная |
|
|
степень |
Старшая |
|||||||
заместители, |
|
углеводородная |
насыщенности |
характеристическая |
|||||||||
характеристические |
|
цепь |
|
|
-ан, -ен, -ин (с |
группа и цифра, |
|||||||
группы I типа, |
|
(родоначальная |
указанием |
указывающая ее |
|||||||||
характеристические |
|
структура) |
|
положения |
положение (в случае |
||||||||
группы II типа |
|
|
|
|
|
|
|
|
|
кратной связи) |
необходимости) |
||
(по алфавиту) |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Например: |
|
|
|
|
|
|
|
|
|
|
|
||
5 4 |
3 |
|
2 1 |
O |
2-этилпентаналь |
|
|||||||
H3C |
|
CH2 |
CH |
|
|
CH |
|
C |
|
|
|||
|
2 |
|
|
H |
|
|
|
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
C2H5 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||||
За родоначальную структуру выбрана наиболее длинная углеродная цепь, содержащая Ф.Г.
1 2 3
HO CH2 CH CH2 OH 2-этилпропандиол-1,3
CH2
CH3
За родоначальную структуру выбрана углеродная цепь, содержащая большее число Ф.Г.
O 5 |
4 |
3 |
2 |
1 |
O |
5-оксо-2-этилпентен-2-овая кислота |
||||
C |
|
CH2 |
CH |
|
C |
|
C |
|
||
|
|
|
|
|||||||
|
|
|
|
|
||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||
H |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
C2H5 |
|
|||||
|
|
|
|
|
|
|
||||
Старшая Ф.Г. получила при нумерации наименьший номер
11

Таблица 4 Xарактеристические группы I типа (обозначаемые только в приставках).
Класс соединений |
Характеристические группы |
|
|
Формула |
Название в приставке |
1.Галогенопроизводные |
-F, -Cl, -Br, -I |
фторо-, хлоро-,бромо-, йодо- |
2.Простые эфиры |
-OR (-OCH3,-OC2H5,...) |
алкокси-,(метокси-, этокси- |
|
|
и т.д.) |
|
-OAr (-OC6H5,...) |
арилокси-(фенокси-) |
3.Сульфиды |
-SR (-S-CH3) |
алкилтио-(метилтио-) |
|
-SAr (-S-C6H5) |
арилтио- (фенилтио-) |
|
|
|
4.Нитросоединения |
-NO2 |
нитро- |
5.Нитрозосоединения |
-NO |
нитрозо- |
6.Азосоединения |
-N=N- |
азо- |
|
|
|
Таблица 5
Характеристические группы II типа (обозначаемые в приставках и окончаниях).
Класс соединений |
Характеристические группы |
|
|||||
|
Формулы |
Названия |
|
||||
|
|
|
|
|
|
Приставка |
Окончание |
Карбоновые к-ты |
-(С)ООН |
- |
-овая кислота |
||||
|
-СООН |
карбокси- |
-карбоновая кис- |
||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
лота |
Сульфокислоты |
-SO3H |
сульфо- |
-сульфоновая кислота |
||||
|
|
|
|
|
|
|
(сульфокислота) |
Соли карбоновых |
-С(ООMe) |
- |
металл…оат |
||||
кислот |
-СООMe |
- |
металл…карбокси- |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
лат |
Сложные эфиры |
-(С)ООR |
- |
R…оат |
||||
|
-COOR |
R-оксикарбонил |
R…карбоксилат |
||||
|
|
|
|
|
|
||
Галогенангидриды |
-(С)ОНаl |
- |
-оилгалогенид |
||||
кислот |
-COHal |
галогенформил- |
-карбонилгалоге- |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
нид |
Амиды |
-(C)ONH2 |
- |
-амид |
||||
|
-CONH2 |
карбомоил |
-карбоксамид |
||||
|
|
|
|
|
|
|
|
Нитрилы |
-(C) |
|
|
N |
- |
-нитрил |
|
|
|
||||||
|
|
||||||
|
|
||||||
|
-C |
|
|
N |
циано- |
-карбонитрил |
|
|
|
|
|||||
|
|
|
|||||
|
|
|
|||||
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
Продолжение таблицы 5 |
Альдегиды |
-(C)H |
|
|
|
O |
оксо- |
-аль |
||||
|
|
|
|||||||||
|
|
|
|||||||||
|
-CH |
|
|
|
O |
формил- |
-карбальдегид |
||||
|
|
|
|
||||||||
|
|
|
|
||||||||
Кетоны |
>(C) |
|
|
|
O |
оксо- |
-он |
||||
|
|
|
|||||||||
|
|
|
|||||||||
Спирты, фенолы |
-ОН |
|
|
|
|
гидрокси- |
-ол |
||||
Тиолы |
-SН |
|
|
|
|
меркапто- |
-тиол |
||||
Амины |
-NH2 |
|
|
|
|
амино- |
-амин |
||||
Имины |
|
|
NH |
имино- |
-имин |
||||||
|
|
||||||||||
|
|
||||||||||
1.4 Радикало-функциональная номенклатура
При построении названия по радикало-функциональной номенклатуре вещество рассматривают как совокупность радикалов, связанных с функциональной группой (или ее фрагментом), обуславливающей принадлежность к определенному классу соединений. Например:
CH3-CH2-OH
- этиловый спирт (вещество относится к классу одноатомных спиртов ROH и содержит радикал этил)
H3C |
|
|
C |
|
|
|
|
|
CH |
|
|
CH |
|
CH3 - метилпропилкетон (вещество относится к классу - |
|||||||||||||||
|
|
|
|
|
2 |
|
2 |
||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
O |
|
|
|
кетонов R |
|
C |
|
R' |
|
и содержит радикалы метил и |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пропил). |
|
|
|
|
|
|
|
|
|
|
|
CH3-O-C2H5 |
|
- метилэтиловый эфир (вещество относится к классу простых |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфиров R-О-R' и содержит радикалы метил и |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этил). |
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
N |
|
CH3 |
|
|
|
- диметилпропиламин (вещество относится к классу |
|||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
CH |
|
|
CH |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
третичных аминов |
|
|
R N |
|
R'' и содержит два |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R'
радикала метила и один радикал пропил).
2. СТРОЕНИЕ УГЛЕВОДОРОДОВ И ПРОГНОЗИРОВАНИЕ ИХ РЕАКЦИОННОЙ СПОСОБНОСТИ
2.1 Понятие о гибридизации
В периодической системе элементов атом углерода располагается во втором периоде, в главной подгруппе четвертой группы. Его электронная конфигурация в невозбужденном состоянии 1s22s22p2 (I), размещение электронов по орбиталям –(II). Образованию химической связи предшествует переход атома углерода в возбужденное состояние (IV), сопровождающееся
13

переходом (возбуждением) одного электрона с 2s-орбитали на свободную 2р-орбиталь (III).
"C" 1s22s22p2 |
... 2 |
"C*" 1s22s12p3 |
... 2 |
I |
II |
III |
IV |
Ввозбужденном состоянии у атома углерода на внешнем электронном уровне имеется четыре неспаренных электрона, поэтому он четырехвалентен и, следовательно, может образовывать четыре ковалентные связи. Затраты энергии, необходимые для возбуждения электрона с 2s-орбитали на 2р-орбиталь, компенсируются за счет энергии, выделяющейся при образовании четырех ковалентных связей вместо двух в невозбужденном состоянии.
Ковалентная связь образуется в результате перекрывания атомных орбиталей (атомная орбиталь - это область пространства вокруг ядра, где нахождение электрона наиболее вероятно, т.е. область наибольшей электронной плотности). Чем больше перекрывание орбиталей, тем прочнее связь. Максимальное перекрывание достигается в том случае, когда орбиталь имеет более вытянутую форму.
Вывод: При формировании химических связей орбитали перестраиваются так, чтобы их форма была более вытянутой в направлении образования связей, т.е. происходит гибридизация.
Гибридизация - это комбинация разных атомных орбиталей валентных электронов, принадлежащих одному атому (например s- и р-орбиталей), приводящая к образованию такого же числа одинаковых орбиталей.
Врезультате гибридизации орбитали валентных электронов выравниваются как по форме, так и по энергии.
Если радиус s-орбитали условно принять за 1, то радиусы p- и sp3-гибридных орбиталей будут соответственно 1,72 и 2,0, т.е. гибридная орбиталь действительно более вытянута, значит, перекрывание с другими орбиталями будет больше, а образующаяся связь - прочнее.
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
r |
|
|
|||||
|
r |
|
|
|
|
|
||||||
|
|
|
|
|
|
г) sp3-гибридная |
||||||
|
|
|
|
|
|
|
||||||
а) s-орбиталь, |
б) p-орбитали, r=1,72 |
|||||||||||
r=1 (усл.) |
|
|
|
|
|
орбиталь, r=2 |
||||||
В зависимости от числа и типа гибридизующихся орбиталей различают три вида гибридизации: sp3, sp2, sp.
14
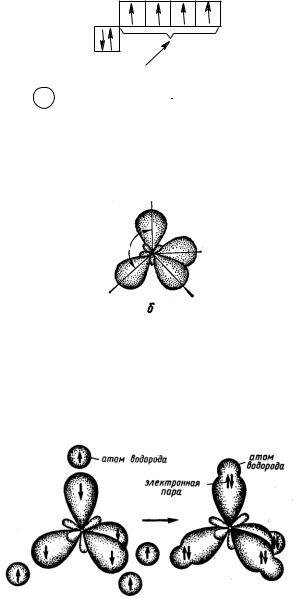
2.2sp3-Гибридизация. Строение алканов. Прогнозирование реакционной способности алканов
В алканах атомы углерода находятся в sp3-гибридном состоянии. В гибридизацию вовлекаются одна s- и три р-орбитали, в результате чего образуются четыре sp3-гибридные орбитали, имеющие форму объемных неправильных восьмерок:
"C*" |
гибридизуются
+ 3 
 4
4 
Гибридные орбитали в пространстве направлены к вершинам тетраэдра под углом 109,5°, что обеспечивает максимальное взаимное отталкивание между ними. sp3-Гибридизацию называют также тетраэдрической.
109,5
Вид орбиталей валентных электронов sp3-гибридного атома углерода
Запомните: Гибридизованные атомы существуют только в составе молекулы, но не самостоятельно.
В молекуле метана четыре sp3-гибридные орбитали атома углерода перекрываются с s-орбиталями четырех атомов водорода и образуются четыре ковалентные связи С-Н:
Схема образования молекулы метана
В молекуле этана каждый из атомов углерода предоставляет по одной sp3-гибридной орбитали для формирования углерод-углеродной связи, длина которой 0,154 нм. Остальные шесть гибридных орбиталей (по три от каждого атома), перекрываясь с s-орбиталями шести атомов водорода, дают шесть связей С-Н:
15

Таким образом, в метане и этане при образовании связей орбитали перекрываются вдоль линии, соединяющей центры атомов (осевое перекрывание). Формирующаяся при этом связь называется -связью. Подобный механизм образования С-С связи имеет место у всех алканов.
Строение молекулы этана
-Связь – это ковалентная связь, образованная при осевом (аксиальном) перекрывании орбиталей.
Примеры -связей.
s ,s |
s p 3 ,s |
s p 3 ,s p 3 |
-Связь - самая прочная ковалентная связь. Вокруг оси -связи возможно свободное вращение атомов и атомных групп. В молекуле метана - четыре-связи, в молекуле этана - семь -связей.
Вывод: 1) В алканах атомы углерода находятся в sp3-гибридном состоянии и образуют только -связи с атомами водорода (С-H) и другими атомами углерода (C-C).
2) Так как sр3-гибридный атом углерода имеет тетраэдрическое строение, молекулы алканов существуют в зигзагообразной форме:
H H H H H H
H H H H H H
109,50
3) Поскольку вокруг -связи возможно свободное вращение, углеродная цепь в алканах может изгибаться в пространстве:
Исходя из электронного строения алканов, можно предсказать их реакционную способность. Так как алканы - насыщенные соединения, для них
16

не могут протекать реакции присоединения, но возможны реакции замещения атома водорода на какой-либо другой одновалентный атом или группу атомов. Все углерод-водородные связи в молекулах алканов малополярны, т.к. электроотрицательности sp3-гибридного атома углерода (2,5) и водорода (2,1) различаются мало. Для таких связей более выгоден гомолитический тип разрыва, т.е. такой разрыв, при котором у каждой образующейся частицы остается по одному неспаренному электрону:
C . .H |
C. + .H |
Частицы с неспаренным электроном называются радикалами. Следовательно, можно сделать вывод, что алканы склонны к образованию радикалов и поэтому вступают в реакции замещения, протекающие, чаще всего, по радикальному механизму (см. стр. 42).
Помимо реакций замещения алканы могут вступать в реакции окисления, дегидрирования, изомеризации. Все они протекают в жестких условиях, в присутствии катализаторов при высокой температуре, что так же объясняется наличием в алканах только малополярных -связей (см. стр. 48).
2.3Cтроение циклоалканов. Прогнозирование реакционной способности циклоалканов
Циклоалканы - это предельные углеводороды, в молекулах которых атомы углерода образуют замкнутые цепи (циклы).
Следует отметить, что образование углерод-углеродных связей в малых циклах (циклопропан, циклобутан) имеет свои особенности, что приводит и к особым химическим свойствам этих циклов. Рассмотрим эти особенности на примере циклопропана, имеющего следующую структурную формулу:
 CH2 или
CH2 или
H2C CH2
Атомы углерода в циклопропане находятся в sp3-гибридном состоянии и, соединяясь, образуют плоский правильный треугольник. Внутренний угол правильного треугольника должен быть 60°, а это значительно отличается от валентного угла для sp3-гибридного атома углерода (109,5°). Реальный угол составляет 106°. Это происходит потому, что орбитали валентных электронов перекрываются не вдоль линии, соединяющей центры атомов (оси), а несколько отклонены от нее.
-(тау)-Cвязь («банановая связь») – это искаженная -связь, в которой максимальное перекрывание орбиталей происходит не по линии, соединяющей центры атомов:
17

106 60
106
Образование -связей в молекуле циклопропана (на рисунке не показано образование связей С-Н)
Так как в данном случае область перекрывания гибридных орбиталей меньше, чем при осевом перекрывании, -связь менее прочна, чем -связь, и может разрываться гораздо легче. Такая особенность электронного строения циклопропана определяет его реакционную способность: он легко вступает в реакции присоединения (см. стр. 50).
В циклоалканах с нормальными циклами (циклопентан, циклогексан) атомы углерода связаны обычными -связями, и химические свойства этих соединений мало отличаются от свойств алканов: наиболее характерными для них являются реакции замещения.
2.4sp2-Гибридизация. Строение этилена. Прогнозирование реакционной способности алкенов
При sp2-гибридизации гибридизуются одна s- и две p-орбитали, в результате чего образуются три новые sp2-гибридные орбитали, имеющие вид неправильных восьмерок:

 остается негибридной
остается негибридной
C*
гибридизуются
+ 2 
 3
3 
sp2-Гибридные орбитали в пространстве направлены к вершинам правильного треугольника под углом 120°, поэтому такой вид гибридизации называют также тригональным. Негибридная р-орбиталь сохраняет форму правильной восьмерки и располагается перпендикулярно гибридным орбиталям. При таком расположении достигается наибольшее отталкивание между всеми орбиталями.
18

Вид орбиталей валентных электронов sp2-гибридного атома углерода
В молекулу этилена входят два sp2-гибридных атома углерода и четыре атома водорода. Перекрываясь аксиально, гибридные орбитали углерода (по одной от каждого атома) формируют углерод-углеродную связь, которая является -связью. Остальные гибридные орбитали и s-орбитали атомов водорода образуют четыре углерод-водородные -связи.
Боковое перекрывание негибридных p-орбиталей над и под плоскостью-связи приводит к формированию -связи:
-Связь - это ковалентная связь, образованная путем бокового (латерального) перекрывания негибридных орбиталей.
Она менее прочна, чем -связь; вращение атомов и атомных групп вокруг-связи сильно затруднено.
Вывод: 1) В молекуле этилена sp2-гибридные атомы углерода связаны двойной связью, состоящей из - и -связей, ее длина 0,134 нм. Так как sp2 - гибридные атомы имеют плоское строение, то вся молекула этилена плоская, в одной плоскости находятся 5 -связей: одна углерод-углеродная ( sp2, sp2) и четыре углерод-водородные ( sp2,s). -Связь, располагаясь перпендикулярно плоскости молекулы, создает вокруг нее область повышенной электронной плотности.
2) Вокруг -связи вращение атомов и атомных групп затруднено, поэтому заместители при атомах углерода двойной связи жестко фиксированы в пространстве (располагаются либо по одну сторону от нее, либо по разные), что является причиной существования цис-транс-изомерии.
Особенности электронного строения этилена сказываются на его реакционной способности.
1) Ненасыщенность молекулы и наличие в ней непрочной -связи определяют важнейшее свойство этилена и всех алкенов - легкость реакций присоединения и окисления. Эти реакции часто протекают при комнатной температуре, без катализаторов (см. стр. 52).
2) Наличие в молекулах алкенов области повышенной электронной плот19

ности является причиной того, что реакции присоединения для них протекают, преимущественно, по ионному механизму, причем в первую очередь присоединяется положительно заряженная частица (реакции электрофильного присоединения - AdE) (см. стр. 45).
2.5Строение бутадиена-1,3. Понятие о сопряжении. Влияние сопряжения на реакционную способность бутадиена-1,3
Бутадиен-1,3 (СН2=СН-СН=СН2) относится к диеновым углеводородам, т.к. содержит две двойные связи. В его молекулу входят четыре sp2-гибридных атома углерода и шесть атомов водорода. Все атомы лежат в одной плоскости, т.к. Сsp2 имеет плоское строение.
Электронное строение бутадиена-1,3
Осевое перекрывание орбиталей дает 9 -связей (3 «C-C»; 6 «C-H»). Четыре р-орбитали (по одной от каждого атома углерода) оказываются расположенными параллельно друг другу и, перекрываясь, образуют общую незамкнутую -электронную систему из четырех электронов, что приводит к уменьшению связи С2-С3 (0,148 нм, тогда как длина одинарной С-С связи 0,154 нм). Таким образом, в бутадиене-1,3 из двух разных -электронных систем (С1=С2 и С3=С4) образовалась общая -электронная система, поэтому бутадиен- 1,3 относят к сопряженным системам
Сопряжение - это процесс взаимодействия разных электронных систем, принадлежащих одной молекуле, с образованием общей электронной системы.
В результате сопряжения молекула становится более устойчивой. Чтобы это доказать, часто определяют энергию гидрирования реального вещества и сравнивают ее с расчетной энергией гипотетического (предполагаемого) соединения, в котором отсутствует сопряжение. Известно, что энергия гидрирования одной С=С связи в среднем составляет 30 ккал/моль. Если предположить, что в молекуле бутадиена две отдельные двойные связи, то энергия гидрирования должна быть 30 2=60 ккал/моль. Экспериментальные данные дают величину ~ 57 ккал/моль; значит на 3 ккал/моль (60-57=3) бутадиен-1,3 устойчивее за счет сопряжения.
Разность между расчетной энергией молекулы без учета сопряжения и реальной энергией называется энергией сопряжения (или энергией делокализации, или энергией резонанса).
Образование сопряженной системы приводит к особенностям в химических свойствах, а именно: реакции присоединения к сопряженным диенам
20
