
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Рекомендовано
- •Оглавление
- •Введение
- •Общие вопросы выполнения лабораторных работ
- •1.1. Правила работы в химической лаборатории
- •Правила оказания первой помощи пострадавшим в химической лаборатории
- •1.3. Правила ведения лабораторного журнала
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •2.Растворы (определение, классификация).
- •3.Титриметрический метод анализа (понятие и виды).
- •4. Метод кислотно-основного титрования (определение, основное уравнение).
- •1. Практическая часть
- •1.3. Контрольные вопросы и задачи
- •2. Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •I. Информационный раздел
- •Концентрация кодеина и морфина в моче у 3-х испытуемых
- •II. Аналитический раздел
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •1. Практическая часть
- •Суточный баланс воды в организме взрослого человека
- •Состав растворов Рингера –Локка и Тироде для теплокровных животных
- •II. Давление пара разбавленных растворов. Закон Рауля
- •2.1.Давление насыщенного пара растворителя
- •1.3. Контрольные задачи
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Реакция среды при гидролизе солей
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Буферные системы, классификация и механизм действия
- •1. Практическая часть
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •5. Практические навыки, которыми должен овладеть студент по теме занятия.
- •Десятичные приставки к названиям единиц
- •Содержание газов в артериальной и венозной крови, л/1 л крови
- •Парциальное давление и напряжение газов, кПа (мм рт. Ст.)
- •Проверка ёмкости мерной посуды
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Константы некоторых жидкостей, применяемых в качестве растворителей
- •Ионное произведение воды при температуре от до:
- •Константы диссоциации некоторых слабых электролитов в водных растворах при
- •Характеристика важнейших индикаторов
- •Средние значения водородного показателя (рН) биологических жидкостей
- •Расчет в растворах кислот и оснований
- •Состав смешанной слюны человека
- •Список литературы Основная литература
- •Дополнительная литература
1. Электролиты сильные и слабые.
1.1.Степень и константа диссоциации (ионизации) слабых электролитов. Закон разведения Оствальда.
1.2.Свойства растворов сильных электролитов. Суть теории Дебая и Хюккеля. Ионная сила растворов (I или μ), активность (α), коэффициент активности ионов (γ).
Автопротолиз воды. Ионное произведение воды. Водородный показатель.
2.1.Понятие кислой, нейтральной и щелочной среды. Водородный и гидроксильный показатели. Шкала рН.
Вывод формул и расчет
 ,
, ,
рН,pOHрастворов слабых
и сильных кислот и оснований.
,
рН,pOHрастворов слабых
и сильных кислот и оснований.Кислотно-основные индикаторы. Суть теорий индикаторов Оствальда и цветности (ионно-хромоформной)Понятие об универсальном индикаторе.
Принцип колориметрического метода определения рН растворов.
3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
3.1.Гидролиз солей одно- и многоосновных кислот и одно- и многокислотных оснований (уравнение в молекулярном и ионном виде, рН среды, вывод константы гидролиза (Кг) и связь ее с константой диссоциации слабого электролита, образующегося при гидролизе).
4. Водно-электролитный баланс организма. Слюна как раствор электролитов. Значение рН биологических жидкостей.
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
1. Практическая часть
1.1.Ситуационные задачи (№№ с 1-по 8) с алгоритмами их решений, эталонами ответов и с комментариями
Вычисление степени и константы электролитической диссоциации
Задача
1. Чему равна степень
электролитической диссоциации уксусной
кислоты в водном растворе с
![]() =
0,01 моль/л? Константа диссоциации уксусной
кислоты
=
0,01 моль/л? Константа диссоциации уксусной
кислоты
![]() .
.
Решение.
Запишем уравнение диссоциации уксусной кислоты в водном растворе и константу электролитической диссоциации:

![]()
Как видно, из задачи,
концентрации всех частиц, образующихся
при диссоциации, могут быть определены
через исходную концентрацию вещества
/с/ и
степень электролитической диссоциации
/![]() /:
/:


![]()
![]()
Выражение константы диссоциации примет вид:
 .
Так как электролит слабый (<<1), то
выражение упрощается:
.
Так как электролит слабый (<<1), то
выражение упрощается: или
или .
.Подставляя данные, получим:
 или 4,5%.
или 4,5%.
Ответ.
![]() или 4,5%.
или 4,5%.
Вычисление ионной силы и коэффициента активности ионов
Задача
2. Вычислите
ионную силу раствора,
содержащего в 1 л
0,005 моль нитрата меди
![]() и 0,001 моль сульфатаалюминия
и 0,001 моль сульфатаалюминия
![]() .
.
Эталон решение.
Зная, что

 и
и

 ,
ионнуюсилу
раствора вычисляем по формуле,
предложенной Г.Н. Льюисом и М. Ренделом
(1921 г):
,
ионнуюсилу
раствора вычисляем по формуле,
предложенной Г.Н. Льюисом и М. Ренделом
(1921 г):
 .
Таким образом,
.
Таким образом, .
.
Ответ.
![]()
Вычисление концентрации ионов H+ и OH-
Задача
3.При добавлении к воде раствора
гидроксида калия /КОН/ концентрация
гидроксид- ионов стала равной![]() моль/л.
Вычислите молярную концентрацию ионов
водорода
моль/л.
Вычислите молярную концентрацию ионов
водорода
![]() ,
если температура раствора 40оС.
,
если температура раствора 40оС.
Решение.
По таблице 5.1. находим величину
 при 40оС, отсюда
при 40оС, отсюда =
=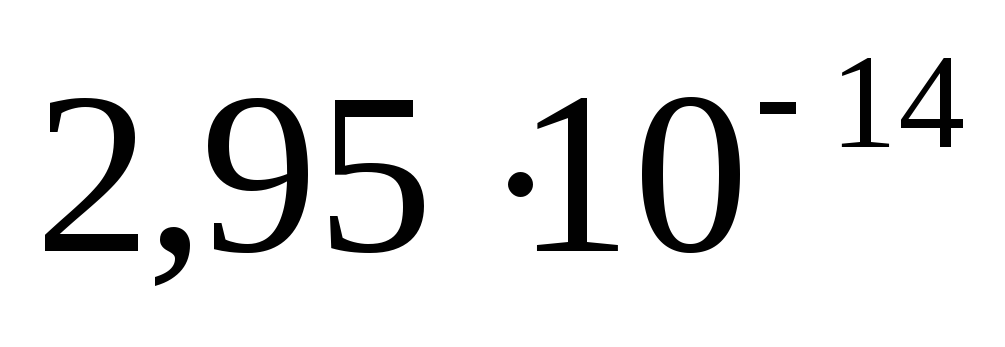 .Обратить внимание!!! Если в задаче
не указана температура, то ее принимают
равной 25оС, а при этом
.Обратить внимание!!! Если в задаче
не указана температура, то ее принимают
равной 25оС, а при этом =
= .
.Вычислим концентрацию ионов
 :
:
![]() =
=![]() =
=![]() ,
или
,
или![]() моль/л.
моль/л.
Ответ.![]() =
=![]() моль/л.
моль/л.
Задача 4. Во сколько раз увеличится активность и концентрация ионов H+при нагревании воды от 18 до 80оС?
Решение.
По таблице №5.1. находим величины константы ионного произведения при 18 и 80оС:
 (при 18оС)=
(при 18оС)= ,
, (при
18оС)=
(при
18оС)= .
.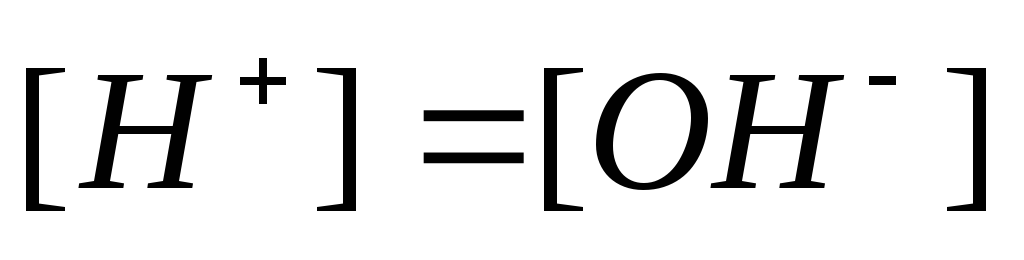 при 18оС =
при 18оС =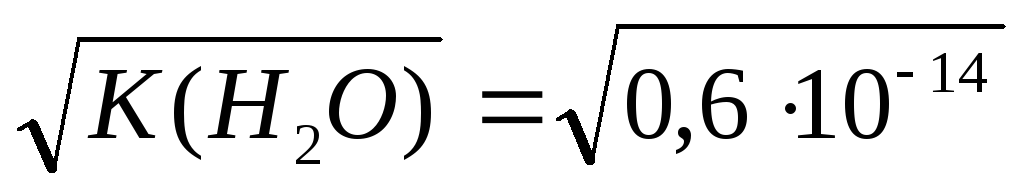
 моль/л.
моль/л. при 80оС =
при 80оС = моль/л.
моль/л.Сопоставляя концентрации ионов Н+и ОН-при 18оС с концентрациями при 80оС, находим на сколько раз увеличится активность и концентрация ионов Н+:
 раз.
раз.
Ответ. При повышении температуры активность и концентрация ионов Н+ увеличивается 6.5 раз.
Вычисление рН растворов по известной концентрации H+- ионов
Задача 5.В биохимическом анализе используется 0,001 моль/л раствор HCl Определите рН этого раствора.
Решение.
Сильные электролиты в водных растворах дислоцируют полностью:
 ,
поэтому .
,
поэтому . .
.По концентрации ионов

 находим рН раствора:
находим рН раствора: .
.
Ответ.![]() .
Значение рН
.
Значение рН![]() 1
указывает на то, что в клиническом
анализе используется слабая кислота.
1
указывает на то, что в клиническом
анализе используется слабая кислота.
Вычисление молярной концентрации ионов водорода [H+] по известной их рН
Задача 6. Вычислить [H+] в ротовой жидкости, если рН=8,3.
Решение.
Рассчитаем
 для ротовой жидкости:
для ротовой жидкости: .
.По таблице антилогарифмов находим значение:
 =
= [9-0,700]=
[9-0,700]= моль/л.
моль/л.
Ответ.![]() =
=![]() моль/л.
моль/л.
Вычисление рН растворов сильных и слабых электролитов по известной их молярной концентрации
Задача
№7.Определите рН раствора![]() ,
в котором
,
в котором![]() =0,1
моль/л (
=0,1
моль/л (![]() ).
).
Эталон решение.
Гидроксида аммония считается слабым электролитом, поэтому для неё применим закон Оствальда:
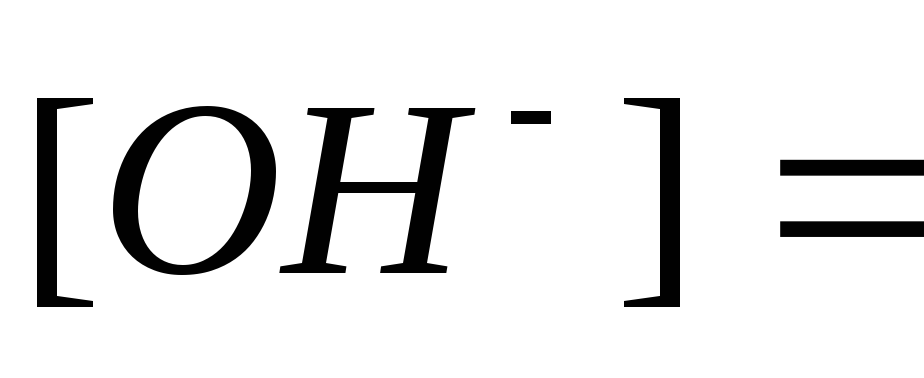
 =
= =
= моль/л.
моль/л.Далее возможны два пути решения: а) через ионное произведение воды, или через показатель ионного произведения воды /
 /.
/.
а)
![]() .
.
б)
![]()
Ответ.
![]() .
.
Вычисление константы и степени гидролиза солей
Задача 8. Вычислите константу и степень гидролиза 0,1 М раствора no первой ступени.
Эталон решение.
Первая ступень гидролиза
 выражается уравнением:
выражается уравнением:

И
 з
уравнения закона действия масс выведем
уравнение константы химического
равновесия:
з
уравнения закона действия масс выведем
уравнение константы химического
равновесия:
 ,
а из него выведем константу гидролиза:
,
а из него выведем константу гидролиза:

Из ионного произведения воды находим, что:
 .
.Подставив выражение для
 в уравнение константы гидролиза и зная,
что:
в уравнение константы гидролиза и зная,
что:
 находим:
находим: .
.Для вычисления степени гидролиза воспользуемся формулой:
 Поскольку
величина
Поскольку
величина большая, то вычисления будем вести по
полной формуле:
большая, то вычисления будем вести по
полной формуле:
Следовательно,
 Таким
образом,
Таким
образом, или 32,26%.
или 32,26%.
Ответ.![]()
![]()
1.2. Ситуационные задачи (№№ с 9 по 19) для закрепления материала (выполнить в протокольной тетради).
Задача №9. Вычислите степень и
константу ионизации муравьиной кислоты,
если концентрация ионов водорода в 0,2
М растворе муравьиной кислоты равна![]() моль/л.
моль/л.
Задача
№10. Для устранения
условного рефлекса на алкоголь назначают
1% (ρ= 1 г/мл) раствор сульфата меди.
Вычислите активность ионов меди в таком
растворе (Т=298 К) и определите, сколько
мг
![]() содержится
в шприце объемом 1 мл.
содержится
в шприце объемом 1 мл.
Задача
№11. Каковы
ионная сила и активность ацетилсалициловой
кислоты (аспирина) в растворе концентрации
0,01 моль/л, если константа диссоциации
равна
![]() ?
?
Задача №12..Вычислите концентрацию ионов водорода и гидроксида для следующих растворов: а) мочи (рН=6,0) б) ротовой жидкости (рН=6,39); в) крови (рН=7,34) г) желудочного сока (рН=0,9).
Задача
№13. Вычислите
концентрацию ионов
![]() и величину
и величину
![]() ,
если в центре долек клетка печени
,
если в центре долек клетка печени
![]() =
6,8.
=
6,8.
Задача
№14. Определить
концентрации
![]() и
и![]() в 0,01 М растворе угольной кислоты, если
рН этого раствора равен 4,18.
в 0,01 М растворе угольной кислоты, если
рН этого раствора равен 4,18.
Задача
№15. При
отравлении
![]() ,
который является сильным окислителем,
используют восстановитель -
,
который является сильным окислителем,
используют восстановитель -![]() .Однако
в препарате
.Однако
в препарате![]() возможна
избыточная кислотность, вызванная либо
способом получения ее, либо добавлением
в качестве консерванта кислот, поэтому
ГФ устанавливает предел кислотности.
Рассчитайте значение рН 3,0%-го водного
раствора Н2О2.
Плотность раствора принять равной 1
г/см3.
Константа кислотной диссоциации
пероксида водорода
возможна
избыточная кислотность, вызванная либо
способом получения ее, либо добавлением
в качестве консерванта кислот, поэтому
ГФ устанавливает предел кислотности.
Рассчитайте значение рН 3,0%-го водного
раствора Н2О2.
Плотность раствора принять равной 1
г/см3.
Константа кислотной диссоциации
пероксида водорода
![]() ,
,![]() .
.
Задача
№16. Для
корреляции кислотно-щелочного равновесия
при алкалозе используют 5% раствор
аскорбиновой кислоты (![]() ;
;![]() г/моль;
г/моль;![]() г/см3).
Определите рН данного раствора.
г/см3).
Определите рН данного раствора.
Задача
№17.Определите рН раствора![]() ,
в котором
,
в котором![]() =0,1
моль/л (
=0,1
моль/л (![]() )
и раствора
)
и раствора![]() ,
в котором
,
в котором![]() =0,2
моль/л (
=0,2
моль/л (![]() ).
).
Задача №18. Определите,
как изменится рН водного раствора
формиата натрия с концентрацией С(HCOONa)
= 0,10 моль/л, если раствор разбавить водой
в 10 раз.
![]() ,
,
![]() .
.
Задача №19. Рассчитайте константу
гидролиза![]() ,
степень гидролиза
,
степень гидролиза![]() и рН 0,05 М раствора
и рН 0,05 М раствора![]() .
.![]() ,
,![]() .
.
