
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Рекомендовано
- •Оглавление
- •Введение
- •Общие вопросы выполнения лабораторных работ
- •1.1. Правила работы в химической лаборатории
- •Правила оказания первой помощи пострадавшим в химической лаборатории
- •1.3. Правила ведения лабораторного журнала
- •Тема: Растворы. Способы выражения концентрации растворов. Основы титриметрического анализа. Метод нейтрализации
- •1.Основные правила техники безопасности при работе в химической лаборатории и правила ведения лабораторного журнала.
- •2.Растворы (определение, классификация).
- •3.Титриметрический метод анализа (понятие и виды).
- •4. Метод кислотно-основного титрования (определение, основное уравнение).
- •1. Практическая часть
- •1.3. Контрольные вопросы и задачи
- •2. Экспериментальная часть
- •Экспериментальные данные и результаты измерений
- •Экспериментальные данные и результаты измерений
- •I. Информационный раздел
- •Концентрация кодеина и морфина в моче у 3-х испытуемых
- •II. Аналитический раздел
- •Тема: Коллигативные свойства растворов неэлектролитов и электролитов
- •1. Вода как универсальный биологический растворитель.
- •2. Коллигативные свойства растворов (определение, виды).
- •1. Практическая часть
- •Суточный баланс воды в организме взрослого человека
- •Состав растворов Рингера –Локка и Тироде для теплокровных животных
- •II. Давление пара разбавленных растворов. Закон Рауля
- •2.1.Давление насыщенного пара растворителя
- •1.3. Контрольные задачи
- •2. Экспериментальная часть
- •Криоскопическим методом
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Протолитические равновесия и процессы. Водородный показатель. Гидролиз
- •1. Электролиты сильные и слабые.
- •3.Гидролиз (определение, причина и следствие, смещение равновесия гидролиза).
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Реакция среды при гидролизе солей
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Буферные системы, классификация и механизм действия
- •1. Практическая часть
- •2. Экспериментальная часть
- •Ацетатного буферного раствора по кислоте и щелочи
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •5. Практические навыки, которыми должен овладеть студент по теме занятия.
- •Десятичные приставки к названиям единиц
- •Содержание газов в артериальной и венозной крови, л/1 л крови
- •Парциальное давление и напряжение газов, кПа (мм рт. Ст.)
- •Проверка ёмкости мерной посуды
- •Формулы перехода от одних выражений концентраций растворов к другим
- •Константы некоторых жидкостей, применяемых в качестве растворителей
- •Ионное произведение воды при температуре от до:
- •Константы диссоциации некоторых слабых электролитов в водных растворах при
- •Характеристика важнейших индикаторов
- •Средние значения водородного показателя (рН) биологических жидкостей
- •Расчет в растворах кислот и оснований
- •Состав смешанной слюны человека
- •Список литературы Основная литература
- •Дополнительная литература
1.3. Контрольные вопросы
В чем заключается основная причина диссоциации? Как зависит способность электролитов к диссоциации от вида химической связи?
Какие вещества называют электролитами? По какому принципу их разделяют на сильные и слабые электролиты?
Что такое константа диссоциации? Чем она отличается от степени диссоциации и от чего зависит?
Что называют активной концентрацией или активностью? В каком соотношении она находится с аналитической концентрацией?
Что называют ионной силой раствора, и чем она определяется? Как изменяется ее значение с увеличением числа различных ионов, присутствующих в растворе, с увеличением заряда и концентрации каждого иона?
Почему в результате гидролиза изменяются кислотно-основные свойства среды? Как ее можно определить?
Дистиллированная вода в открытых сосудах со временем показывает слабокислую среду (рН=6). Как объяснить это явление?
2. Экспериментальная часть
Лабораторная работа. Факторы, влияющие на гидролиз веществ
Цель работы. Экспериментально определить влияние различных нижеуказанных факторов на степень гидролиза солей и доказать его ступенчатый характер, а также определить природу конечного продукта гидролиза.
Оборудование: набор пробирок в штативе, спиртовки, спички, держатели для пробирок.
Реактивы: растворы – хлорида, ацетата, сульфита и карбоната натрия; сульфата алюминия; карбоната аммония; хлорида висмута; фенолфталеина; концентрированная соляная кислота; дистиллированная вода; универсальная индикаторная бумага.
Опыт №1. Определение характера среды при гидролизе солей с помощью универсальной индикаторной бумаги
Ход работы:
В 5 чисто вымытые пробирки налейте по 2-3 мл растворы, указанных в нижеследующей таблице. Опустите в эти растворы полоски универсальной индикаторной бумаги, полученные окраски сравните с цветной шкалой и с рН дистиллированной воды.
Результаты внесите в таблицу № 4.1.
Таблица 4.1
Реакция среды при гидролизе солей
-
№№
Испытуемая соль
Реакция среды
рН раствора
1.
 дист.
дист.2.

3.

4.

5.

Выводы. Какие соли подвергаются гидролизу? Напишите уравнения гидролиза в молекулярной и ионной форме. Почему при гидролизе карбоната натрия не выделяется
 ?
Объясните, чем обусловлена реакция
среды в каждом случае.
?
Объясните, чем обусловлена реакция
среды в каждом случае.
Опыт №2. Влияние температуры на степень гидролиза
Ход работы:
Налейте в пробирку 2-3 мл 1 М раствора ацетата натрия, добавьте 1-2 капли фенолфталеина. Нагрейте раствор почти до кипения и наблюдайте появление розовой окраски. Охладите пробирку в холодной воде под краном и наблюдайте уменьшение интенсивности окрашивания.
Выводы. Составьте уравнения гидролиза соли и объясните с позиций принципа Ле Шателье наблюдаемое явление, зная, что фенолфталеин служат индикатором на гидроксид- ион.
Опыт
№3. Влияние разбавления и увеличения
концентрации ионов
![]() на равновесие гидролиза висмута (III)
хлорида
на равновесие гидролиза висмута (III)
хлорида
Ход работы:
В пробирку внесите 2-3 капли раствора хлорида висмута (III)
 и постепенно по каплям прибавляйте
воду до выпадения белого осадка хлорида
оксовисмута
и постепенно по каплям прибавляйте
воду до выпадения белого осадка хлорида
оксовисмута .
Этот осадок образуется на второй ступени
гидролиза из основной соли
.
Этот осадок образуется на второй ступени
гидролиза из основной соли вследствие
отщепления воды. При подкислении
концентрированной соляной кислотой
осадок растворяется. Для этого по
каплям к осадку прилейте
вследствие
отщепления воды. При подкислении
концентрированной соляной кислотой
осадок растворяется. Для этого по
каплям к осадку прилейте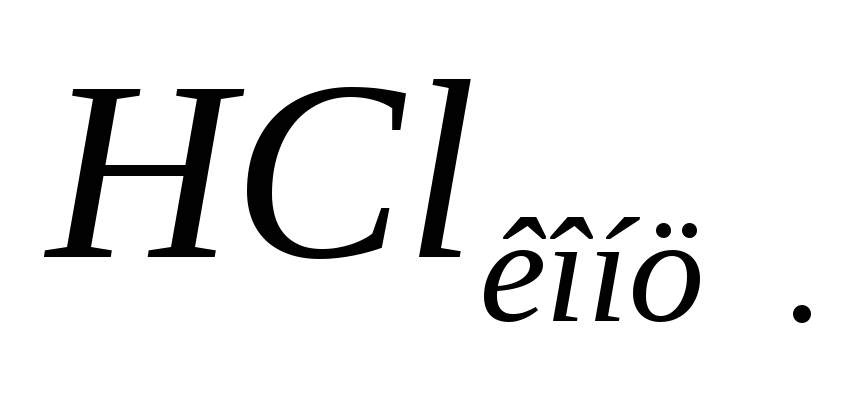 .
.Выводы. Объясните влияние разбавления раствора и добавления соляной кислоты с точки зрения принципа Ле Шателье. Напишите уравнения в молекулярной и ионной формах.
Опыт №4. Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза
Ход работы:
Налейте в пробирки по 1-2 мл 1 М раствора сульфита и карбоната натрия. В каждую пробирку добавьте по одной капле фенолфталеина.
Выводы. Почему окраска фенолфталеина в этих растворах различна? Объясните наблюдаемое явление, сравнив константы диссоциации угольной
 и сернистой
и сернистой кислот. Напишите уравнение гидролиза
сульфита натрия.
кислот. Напишите уравнение гидролиза
сульфита натрия.
Опыт №5. Полный (необратимый) гидролиз
Ход работы:
Внесите в пробирку 6-8 капель сульфата алюминия
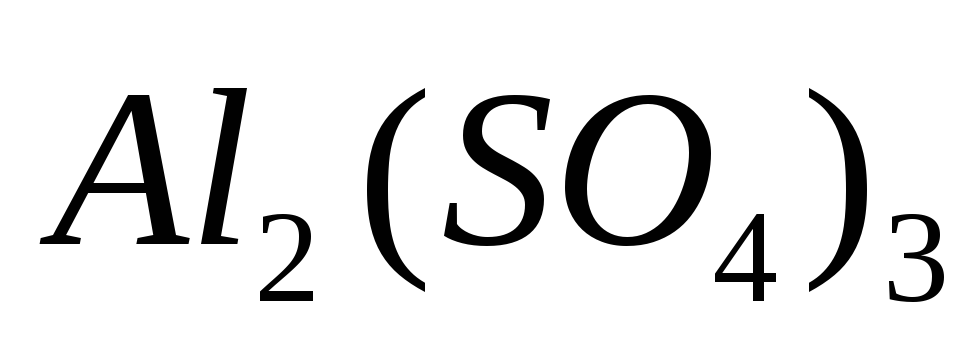 и
столько же карбоната натрия
и
столько же карбоната натрия
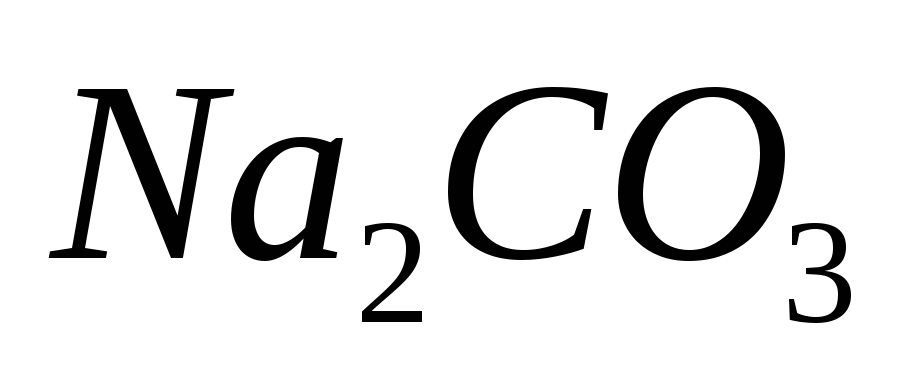 .
Отметьте выделение пузырьков
.
Отметьте выделение пузырьков и выпадение осадка гидроксида алюминия
и выпадение осадка гидроксида алюминия
 .
.Выводы. Почему не получилось карбоната алюминия? Какие соли подверглись полному гидролизу? Объясните, почему смешиваемые вещества усиливают гидролиз друг друга?
Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).
Образец теста
При экспериментальном определении электролитного состава ротовой жидкости установлено содержание белков
 моль/л,
поэтому тип данного электролита в
медицине расценивают, как _____.
моль/л,
поэтому тип данного электролита в
медицине расценивают, как _____.
1) сильный
2) слабый
3) слабый
4) полиэлектролит
Степень диссоциации
 и концентрации ионов
и концентрации ионов в 0,01 М растворе молочной кислоты /
в 0,01 М растворе молочной кислоты / /,
которая была предназначена для проведения
биохимических исследований составили
_____ % и _____ в моль/л соответственно.
/,
которая была предназначена для проведения
биохимических исследований составили
_____ % и _____ в моль/л соответственно.
1)
![]() и
и![]()
2)
![]() и
и![]()
3)
![]() и
и![]()
4)
![]() и
и![]()
3.
Активность иона цинка в растворах с
массовой долей сульфата цинка 0,1%; 0.25%
(![]() г/мл), предназначенный в качестве глазных
капель как антисептическое средство
составляют _____ и _____ моль/л.
г/мл), предназначенный в качестве глазных
капель как антисептическое средство
составляют _____ и _____ моль/л.
1) 0,006 и 0,0048
2) 0,003 и 0,0045
3) 0,05 0,045
4) 0,06 и 0,048
4. С
целью моделирования физиологических
процессов, которые происходят в слюне,
необходимо приготовить раствор натрия
хлорида
![]() с величиной ионной силы 0,15 моль/л,
учитывая при этом, что молярная
концентрация данного раствора составила
_____ моль/л.
с величиной ионной силы 0,15 моль/л,
учитывая при этом, что молярная
концентрация данного раствора составила
_____ моль/л.
1) 0,015
2) 0,03
3) 0,15
4) 1,5
5. Если
концентрация
![]()
![]() моль/л (
моль/л (![]() =
=![]() ),
то концентрация гидроксид- ионов при
температуре 20оС
составляет _____в моль/л.
),
то концентрация гидроксид- ионов при
температуре 20оС
составляет _____в моль/л.
1)
![]()
2)
![]()
3)
![]()
4)
![]()
6. Величина
рН
раствора
![]() с концентрацией 0,1 моль/л равна _____.
с концентрацией 0,1 моль/л равна _____.
1) 4
2) 3
3) 2,5
4) 0,7
7. Нижеуказанное
выражение _____ по
результатам эксперимента позволяет
рассчитать концентрацию
![]() -
ионов, при условии, если в
лаборатории методом рН-
потенциометрии установлена концентрация
ионов
-
ионов, при условии, если в
лаборатории методом рН-
потенциометрии установлена концентрация
ионов
![]() в водном растворе альбуминов.
в водном растворе альбуминов.
1)
![]()
2)
![]()
3)
![]()
4)
![]()
8. C
целью определения функционирования
околоушной слюнной железы, методом
ацидиметрии, в образце жидкости данной
секреции выявлена концентрация
![]() =
=![]() моль/л,
но, учитывая при этом тот факт, что рН
определяет физико-химические свойства
коллоидных структур в слюне, то рекомендуют
найти эту величину, которая составила
_____.
моль/л,
но, учитывая при этом тот факт, что рН
определяет физико-химические свойства
коллоидных структур в слюне, то рекомендуют
найти эту величину, которая составила
_____.
1) 5
2) 7
3) 9
4) 12
9. При клиническом анализе у больного в образце крови рН составил 7,2. и такое кислотно-основное состояние крови в медицине для выбора курса лечения оценивают, как _____.
1) ацидоз
2) алкалоз
3) гипоксия
4) физиологическое
10. Фенолфталеин в щелочной среде изменяет свой цвет на _____.
1) желтый
2) оранжевый
3) синий
4) малиновый (розовый)
11. Метиловый оранжевый в кислой среде _____.
1) бесцветный
2) розовый
3) желтый
4) оранжевый
12. Метиловый оранжевый в щелочной среде _____.
1) розовый
2) бесцветный
3) оранжевый
4) желтый
13. Следствием гидролиза является _____.
1) разбавление раствора
2) изменение активной концентрации ионов соли
3) образование слабого электролита (электролитов)
4)
накопление ионов
![]() или
или![]() в
растворе
в
растворе
14. Основную соль (гидроксосоль) при гидролизе образует _____.
1) Na2CO3
2) AgNO3
3) AICI3
4) K3PO4
15. Кислую соль при гидролизе образует _____.
1) Cr2(SO4)3
2) ZnCl2
3) Na2SO4
4) K2S
16. Восстановите левую часть ионного уравнения гидролиза _____ + _____ ⇄ Al(OH)2+ + Н+.
1) Al3+ +2НОН ⇄ Al(OH)2+ + Н+
2) AlOH2+ + НОH ⇄ Al(OH)2+ + Н+
3) Al3+ + OH− +НОН ⇄ Al(OH)2+ + Н+
4) Al2+ +2НОН ⇄ Al(OH)2+ + Н+ :
17. При сливании растворов CrCl3 и K2S идет ______.
1) первая ступень гидролиза с образованием CrOHS и KHS
2) обменная реакция с образованием Cr2S3 и KCl
3) взаимное усиление гидролиза с образованием Cr(OH)3 и H2S
4) окислительно-восстановительная реакция
18. При сливании растворов Al2(SO4)3 и Na2CO3 идет _____.
1) обменная реакция с образованием Al2(CO3) 3 и Na2SO4
2) взаимное усиление гидролиза с образование Al(OH)3, CO2 и Na2SO4
3) окислительно-восстановительная реакция
4) первая ступень гидролиза солей с образованием AlOHSO4 и NaHCO3
18. Степень гидролиза Na3PO4 уменьшается при добавлении ______.
1) HCl
2) CO2
3) NaCl
4) NaOH
19. Степень гидролиза ацетата натрия возрастает при _____.
1) уменьшение температуры
2) увеличение температуры
3) добавление NaOH
4) увеличение концентрации раствора
20. Степень
гидролиза![]() возрастает при _____
возрастает при _____
1) добавлении Na2CO3
2) уменьшении температуры
3) добавлении HCl
3) увеличение концентрации раствора
21. Уравнение
для расчета
![]() соли, образованной сильной одноосновной
кислотой и слабым однокислотным
основанием – это _____.
соли, образованной сильной одноосновной
кислотой и слабым однокислотным
основанием – это _____.
1) ![]()
2)
![]()
3)
![]()
4) ![]()
22. Уравнение: справедливо
для гидролиза соли _____.
справедливо
для гидролиза соли _____.
1) ![]()
2)
![]()
3)
![]()
4) ![]() .
.
