
- •Обработка результатов измерений в физическом практикуме
- •Погрешности прямых измерений
- •Погрешности косвенных измерений
- •Правила представления результатов измерения
- •Правила построения графиков
- •Динамика поступательного движения Работа1. Оценка точности прямых и косвенных измерений
- •Общие сведения
- •Порядок выполнения работы
- •Результаты измерений диаметра проволоки штангенциркулем и микрометром
- •Результаты измерений тока и напряжения
- •Контрольные вопросы
- •Работа2. Эквивалентность гравитационной и инертной масс
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа3. Изучение законов механики с помощью прибора атвуда
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Динамика вращательного движения
- •Работа4. Определение моментов инерции параллелепипеда методом крутильных колебаний
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа5. Определение момента инерции с помощью маятника Обербека
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа6. Определение момента инерции твердых тел с помощью маятника максвелла
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа7. Измерение скорости полета пули с помощью баллистического маятника
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа9. Изучение прецессии гироскопа
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа11. Определение отношения
- •Методом стоячей волны
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа12. Определение коэффициента вязкости, длины свободного пробега и эффективного диаметра молекулы газа
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа13. Определение коэффициента вязкости жидкости
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Работа14. Определение коэффициента поверхностного натяжения жидкости
- •Общие сведения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Рекомендательный библиографический список
- •Содержание
Контрольные вопросы
1. Что такое гироскоп?
2. Какими свойствами обладает гироскоп? Какими физическими законами обусловлены эти свойства?
3. Почему возникает регулярная прецессия гироскопа?
4. От каких параметров системы зависит угловая скорость прецессии?
молекулярная физика
Работа10. определение отношения
теплоемкости воздуха при постоянном давлениик теплоемкости при постоянном объеме
методом адиабатического расширения
Цель работы – изучить законы идеального газа и основные положения классической теории теплоемкости; определить коэффициент Пуассона методом адиабатического расширения (методом Клемана – Дезорма).
Общие сведения
Количество тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на 1 К, называют молярной теплоемкостью.
![]() ,
,
где Q– количество тепла, подводимого к системе;Т– абсолютная температура системы;M– масса газа;– масса одного моля газа.
Как показывают теория и опыт, теплоемкость зависит от условий, при которых нагревается газ, т.е. от характера термодинамического процесса.
Теплоемкость газа при постоянном давлении Сpбольше теплоемкости при постоянном объемеCV. Это легко показать качественно на основании первого начала термодинамики: количество теплаQ, подводимого к системе, идет на увеличение внутренней энергии системыUи на совершение этой системой работыAнад внешними телами:
Q = U + A.
Если газ нагревается при постоянном объеме, то работа не совершается и все подводимое тепло идет на увеличение запаса его внутренней энергии U, т.е. только на повышение температуры газа. Если же газ нагревается при постоянном давлении, он расширяется и производит работу, требующую дополнительного расхода тепла. Таким образом, для повышения температуры газа на определенную величину в изобарном процессе требуется большее количество теплоты, чем при изохорном.
Как следует из теории,
Cp = CV + R, (1)
где R– универсальная газовая постоянная.
Выражение (1) носит название соотношения Майера.
Отношение =Ср/CVвходит в уравнение Пуассона, описывающее адиабатический процесс, т.е. процесс, идущий без теплообмена с окружающей средой (Q= 0):
![]() .
(2)
.
(2)
Здесь p1иV1– давление и объем газа в первом состоянии;p2иV2– давление и объем газа во втором состоянии.
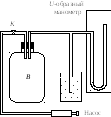
Рассмотрим метод Клемана – Дезорма. Накачаем насосом воздух в большой стеклянный баллон В(см.рисунок) и закроем кранK. При быстром сжатии температура воздуха повышается. Поэтому после прекращения нагнетания разность уровней жидкости в манометре будет постепенно уменьшаться, пока температура воздуха внутри баллона не сравняется с температурой окружающего воздуха. Назовем состояние воздуха в баллоне после выравнивания температур состоянием 1. Параметры состояния 1 следующие:V1– объем единицы массы воздуха;t1– температура воздуха;H+h1– давление в баллоне, выраженное в единицах разности уровней жидкости вманометре;Н– атмосферное давление;h1– избыточное давление, созданное накачиванием.
Откроем
кранK и, как только
давление в баллонеВсравняется с
атмосферным (это можно определить по
прекращению характерного шипения),
закроем его. Так как расширение происходит
очень быстро, то процесс близок к
адиабатическому и,следовательно,
температура понизится до t2.
Объем единицы массы воздуха станет
равным V2.
Воздух, оставшийся в баллоне, перейдет
в состояние 2с параметрамиV2,t2,Н. Так как температураt2меньше наружной, то воздух
в баллоне будет постепенно нагреваться
(вследствие теплообмена с окружающей
средой) до температуры окружающего
воздухаt1. Это нагревание
происходит изохорически, так как кран
закрыт. Давление воздуха в баллоне
увеличивается по сравнению с атмосферным,
и в манометре возникает разность уровнейh2, т.е. воздух переходит в
состояние 3 с параметрамиV2,t1,Н+h2.
Таким образом, мы имеем три состояния газа со следующими параметрами:
|
Состояние |
1 |
2 |
3 |
|
Объем |
V1 |
V2 |
V2 |
|
Температура |
t1 |
t2 |
t1 |
|
Давление |
Н+h1 |
Н |
Н+h2 |
В состояниях 1 и 3 воздух имеет одинаковую температуру, следовательно, параметры этих состояний можно связать уравнением изотермического процесса (уравнением Бойля – Мариотта):
![]() .
(3)
.
(3)
Переход от состояния 1 к состоянию 2 происходит адиабатически, поэтому параметры их связаны уравнением Пуассона (2), которое примет вид
![]() (4)
(4)
Преобразуем уравнение (3). Возведем обе его части в степень :
![]() .
.
Разделим почленно полученное равенство на выражение (4),
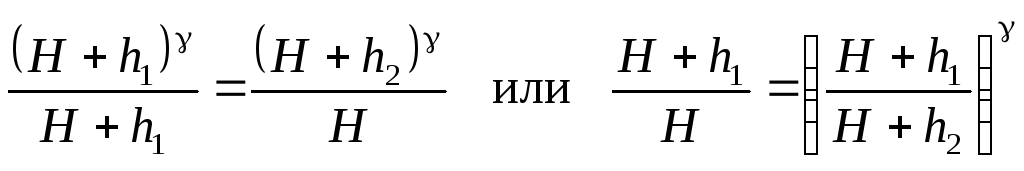 .
.
Прологарифмируем последнее равенство:
![]() ,
,
откуда
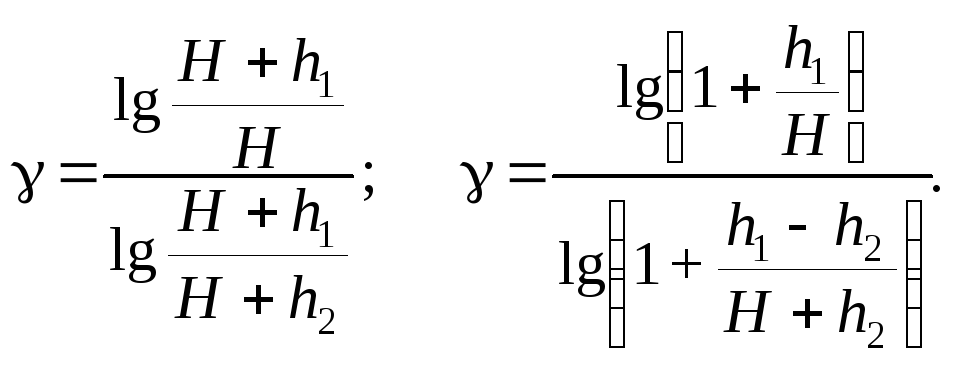
Так как величины h1иh2, выраженные в миллиметрах ртутного столба, очень малы по сравнению сНи, следовательно, дробиh1/Hи (h1–h2)/(H + h2) также незначительны, для нахождения логарифма можно воспользоваться выражением
![]() ,
,
где х– малая величина. Посколькух2и, тем более,х3– величины высших порядков малости, ими можно пренебречь, то lg(1 +x)xи, следовательно,
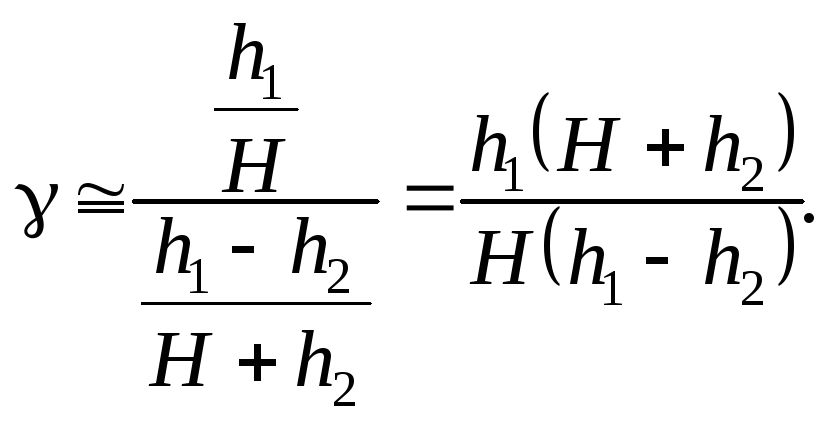
Пренебрегая величиной h2в суммеH + h2, получим расчетную формулу
![]() .
(5)
.
(5)
