
- •Химия гетероциклических соединений
- •49 01 01, 49 01 02, 91 01 01, 48 01 02
- •Содержание
- •Введение
- •Номенклатура гетероциклических соединений
- •Пятичленные гетероциклические соединения с одним гетероатомом
- •Источники и методы получения фурана, тиофена и пиррола
- •Получение из 1,4-дикарбонильных соединений
- •Получение фурана и пиррола из слизевой кислоты
- •Галогенирование
- •Сульфирование
- •Нитрование
- •Ацилирование
- •Восстановление и окисление пятичленных гетероциклических соединений.
- •Реакции гидрирования
- •Реакция окисления
- •Другие реакции пятичленных гетероциклических соединений
- •Фурфурол, особенности его химического поведения
- •Важнейшие производные пиррола
- •Индол и его важнейшие производные
- •Способы получения индола
- •Химические свойства
- •Пятичленные гетероциклы с двумя гетероатомами
- •Пиразол (1,2-диазол)
- •Имидазол (1,3-диазол)
- •Тиазол (1-тиа-3-азол)
- •Шестичленные гетероциклические соединения
- •Пиридин (азин)
- •Биологически активные соединения пиридинового ряда
- •Понятие о хинолине, изохинолине, акридине
- •Хинолин
- •Изохинолин
- •Акридин
- •Шестичленные гетероциклические соединения с двумя атомами азота
- •Пиримидин, пиримидиновые основания
- •5.2 Пурин, пуриновые основания
- •Понятие о нуклеозидах и нуклеотидах
- •Шестичленные кислородсодержащие гетероциклические соединения неароматического характера и их природные производные
- •Кумарин (-бензопирон)
- •Хромон (-бензопирон)
- •Литература
Тиазол (1-тиа-3-азол)
Т иазол
в свободном состоянии в природе не
найден, однако ядро тиазола входит в
состав многих природных соединений.
Расщепление витамина В1
дает производное тиазола, пенициллин
является производным тиазолидина,
фермент карбоксилаза также содержит
тиазольный цикл. Ряд производных тиазола
образует группу лекарственных препаратов
– сульфатиазолов.
иазол
в свободном состоянии в природе не
найден, однако ядро тиазола входит в
состав многих природных соединений.
Расщепление витамина В1
дает производное тиазола, пенициллин
является производным тиазолидина,
фермент карбоксилаза также содержит
тиазольный цикл. Ряд производных тиазола
образует группу лекарственных препаратов
– сульфатиазолов.
Тиазол подобно тиофену обладает хорошо выраженными ароматическими свойствами. Сходство тиазола с пиридином подобно сходству тиофена с бензолом. Тиазол – слабое основание, но образует соли с сильными кислотами. Реакции электрофильного замещения протекают в положения 4 и 5 только при наличии электронодонорных заместителей в кольце. Нуклеофильное замещение легче всего происходит по атому углерода С2. Из производных тиазола наиболее всего изучены 2- и 5-аминотиазолы:

Сульфамидный препарат сульфатиазол (норсульфазол) обладает сильным бактерицидным действием.

Бензотиазолы оказались важными соединениями в производстве цианиновых красителей. Цианиновые красители бензотиазольного ряда являются красителями – фотосенсибилизаторами, часто употребляемыми в цветной и инфракрасной фотографии. Действие таких фотосенсибилизаторов состоит в том, что они активируют светочувствительный слой на пленке или пластинке, делая его более чувствительным к облучению, придают пленке желтый и красный цвет.
Шестичленные гетероциклические соединения
Пиридин (азин)
П иридин
можно рассматривать как бензол, в котором
вместо одной из групп –НС= находится
атом азота.
иридин
можно рассматривать как бензол, в котором
вместо одной из групп –НС= находится
атом азота.
Положения в пиридиновом ядре обозначаются цифрами или буквами греческого алфавита.
Монометилпиридины называют пиколинами, диметилпиридины – лутидинами. Пиридин и его гомологи (пиколины, лутидины и т.д.), называемые «пиридиновыми основаниями», выделяют из каменноугольной смолы путем перегонки и обработки водной кислотой. Пиридин представляет собой бесцветную жидкость с tкип 115С, обладающую характерным неприятным запахом.
Пиридин в больших количествах используется в качестве растворителя при проведении многих химических реакций, в технологии красителей и лекарственных веществ как мягкое органическое основание.
В настоящее время разработаны синтетические методы получения пиридина и его гомологов с использованием сравнительного дешевого сырья.
К таким методам относится каталитическая конденсация ацетилена с аммиаком или с синильной кислотой:

Из других методов наиболее важные основаны на конденсации карбонильных соединений с аммиаком, например акролеин образует -пиколин:

а уксусный альдегид и аммиак в присутствии ацетата аммония при 250С дают 2-метил-5-этилпиридин:

Пиридин по структуре и устойчивости из всех ароматических гетероциклов наиболее близок к бензолу, о чем свидетельствует высокое значение энергии делокализации пиридинового цикла–134,4 кДж/моль (для бензола–150,7 кДж/моль). Молекула пиридина имеет плоское строение, но не является правильным шестиугольником, так как длины связей С–N меньше, чем длины С–С-связей. Ароматический секстет -электронов образован пятью электронами углеродных атомов и одним – атома азота. Все атомы находятся в состоянии sp2-гибридизации. Свободная пара р-электронов атома азота не взаимодействует с -электронами кольца и расположена перпендикулярно молекулярной орбитали. Благодаря наличию этой электронной пары пиридин имеет основной характер, образуя соли пиридиния. Но основность пиридина значительно ниже основности алифатических аминов вследствие того, что атом азота пиридина включен в цикл, имеет место дополнительное взаимодействие этой электронной пары с циклической -электронной системой. Кроме того, sp2-орбиталь в пиридине удерживается прочнее и менее доступна для образования иона пиридиния, чем пара р-электронов в алифатическом амине, занимающая sp3-орбиталь.
Пиридин и его гомологи образуют соли пиридиния с кислотами (HCl, HBr, H2SO4), а также с галогеналкилами.
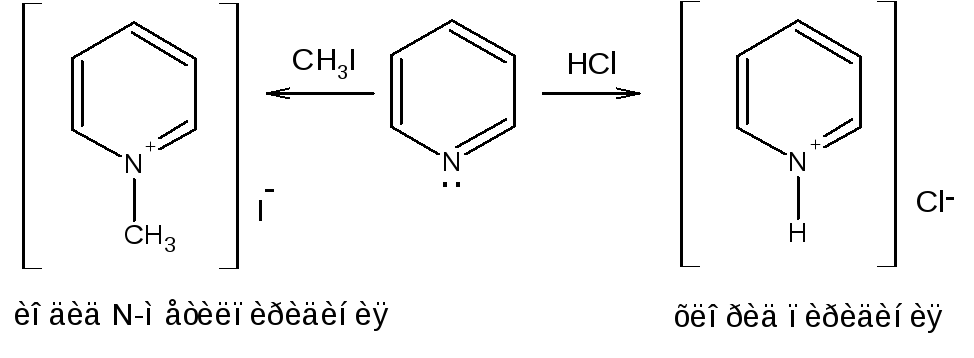
Вследствие значительного отрицательного индукционного эффекта атома азота (–I-эффект) электронная плотность смещена в сторону гетероатома, дипольный момент пиридина равен 2,26 Д.

Распределение зарядов (расчетные величины) указывает на обеднение электронами атомов углерода в цикле, особенно в - и -положениях, что подтверждается преимущественным электрофильным замещением в положения 3 и 5 и нуклеофильным замещением в положения 2,4,6. Таким образом, в результате значительного положительного заряда в ядре пиридина он становится инертным ко многим реакциям электрофильного замещения (алкилирование, ацилирование) и в очень жестких условиях вступает в реакции сульфирования, нитрования, бромирования:

В этих реакциях проявляется большое сходство пиридина с нитробензолом, т.е. атом азота в пиридине оказывает такое же электроноакцепторное влияние, что и нитрогруппа в бензоле.
Способность пиридина к взаимодействию с нуклеофильными реагентами принципиально отличает его от бензола и еще раз указывает на сходство с нитробензолом. Это реакции: аминирование, гидроксилирование, взаимодействие с литий- и магнийорганическими соединениями.

Для 2-, 4-гидроксипиридинов имеет место окси-оксо-таутомерия, причем оксо-форма является преобладающей:

При каталитическом или электрохимическом восстановлении пиридина образуется пиперидин – гетероциклическое соединение неароматического характера, который обладает свойствами вторичных алифатических аминов:

Одна из распространенных реакций пиперидина – алкилирование по атому азота.
Пиридин существенно отличается от бензола по легкости раскрытия кольца. Бензол с иодистоводородной кислотой при 280С образует метилциклопентан, а при каталитическом гидрировании дает циклогексан. Пиридин в сходных условиях образует, соответственно, н-пентан и 1-аминопентан:

При конденсации 2-метилпиридина с формальдегидом и последующей дегидратации образующегося -(2-пиридил)этанола получают 2-винилпиридин, применяемый (подобно стиролу) для сополимеризации с бутадиеном-1,3 в производстве специальных видов каучука:

