
- •1. Поверхностная обработка полупроводниковых материалов
- •1.2. Механическая обработка кремниевых пластин
- •Очистка поверхности пластин после механической обработки
- •Методы контроля чистоты поверхности пластин
- •1.3. Химическое травление кремния
- •Кинетика травления кремния
- •Две теории саморастворения кремния
- •Влияние примесей
- •Дефекты структуры полупроводника
- •Ориентация поверхности полупроводника
- •Концентрация компонентов травителя
- •Температура раствора
- •Химико-динамическая полировка
- •Анизотропное травление
- •Травление окисла и нитрида кремния
- •Промывка пластин в воде
- •Очистка пластин в растворах на основе перекиси водорода
- •1.4. Плазмохимическое травление кремния
- •Классификация процессов плазмохимического травления
- •Кинетика изотропного травления кремния
- •Образование радикалов в газоразрядной плазме
- •Взаимодействие радикалов с атомами материалов
- •Травление двуокиси и нитрида кремния
- •Факторы, влияющие на скорость ПХТ материалов
- •Анизотропия и селективность травления
- •2. Диэлектрические пленки на кремнии
- •2.1. Термическое окисление кремния
- •Окисление кремния при комнатной температуре
- •Физический механизм роста окисла при высокой температуре
- •Структура окисла кремния
- •Модель Дила - Гроува
- •Кинетика роста окисла кремния
- •Влияние температуры окисления
- •Влияние парциального давления окислителя
- •Влияние ориентации подложки
- •Влияние типа и концентрации примеси в подложке
- •Оборудование для окисления кремния
- •2.2. Методы контроля параметров диэлектрических слоев
- •Контроль толщины слоя диэлектрика
- •Контроль дефектности пленок
- •Метод электролиза воды
- •Электрографический метод
- •Метод электронной микроскопии
- •Метод короткого замыкания
- •2.4. Осаждение диэлектрических пленок
- •Осаждение пленок диоксида кремния
- •Осаждение нитрида кремния
- •3.1. Диффузия примесей в полупроводник
- •Механизмы диффузии примесей
- •Диффузия по вакансиям. Коэффициент диффузии
- •Распределение примесей при диффузии
- •Диффузия из бесконечного источника
- •Диффузия из ограниченного источника
- •Первый этап диффузии
- •Источники примесей
- •Источники донорной примеси
- •Источники акцепторной примеси
- •Поверхностный источник примеси
- •Второй этап диффузии
- •Перераспределение примеси при диффузии в окисляющей среде
- •Контроль параметров диффузионных слоев
- •3.2. Эпитаксия
- •Рост эпитаксиальных пленок
- •Методы получения эпитаксиальных слоев кремния
- •Хлоридный метод
- •Пиролиз моносилана
- •Гетероэпитаксия кремния на диэлектрических подложках
- •Перераспределение примесей при эпитаксии
- •3.3. Ионное легирование полупроводников
- •Характеристики процесса имплантации
- •Пробег ионов
- •Дефекты структуры в полупроводниках при ионном легировании
- •Распределение внедренных ионов
- •Распределение примеси в интегральных структурах
- •Распределение примеси в двухслойной мишени
- •Влияние распыления полупроводника
- •Распределение примеси при термическом отжиге
- •Низкотемпературный отжиг
- •Оборудование для ионного легирования
- •Ионные источники
- •4. Технология литографических процессов
- •4.1. Классификация процессов литографии
- •4.2. Схема фотолитографического процесса
- •4.3. Фоторезисты
- •Позитивные фоторезисты
- •Негативные фоторезисты
- •Основные свойства фоторезистов
- •4.4. Фотошаблоны
- •4.5. Технологические операции фотолитографии
- •Контактная фотолитография
- •Искажение рисунка при контактной фотолитографии
- •Литография в глубокой ультрафиолетовой области
- •Проекционная фотолитография
- •4.6. Электронолитография
- •4.7. Рентгенолитография
- •Электронорезисты
- •5. Металлизация
- •5.1. Свойства пленок алюминия
- •Электродиффузия в пленках алюминия
- •Методы получения металлических пленок
- •5.2. Создание омических контактов к ИС
- •5.3. Использование силицидов металлов
- •5.4. Многоуровневая металлизация
- •Содержание

Модель Дила - Гроува
|
|
x |
x0 |
C |
|
|
|
|
|
Ci |
|
F1 |
|
|
|
|
|
F2 |
|
|
|
|
F3 |
O2 |
SiO2 |
|
Si |
H2O |
|
||
|
|
|
Рис.2.2. Диаграмма высокотемпературного окисления кремния
Первые попытки описания термического окисления кремния основывались на известных моделях роста окисла на металлах, в которых предполагалось, что при высоких температурах процесс окисления является следствием диффузии заряженных частиц - ионов и электронов -через растушую пленку. При этом скорость химической реакции считалась много большей скорости диффузионного процесса.
Основной моделью роста окисла является модель Дила-Гроува (Д-Г), рассматривающая процесс окисления состоящим из двух этапов - массопереноса окислителя в растущем окисле и протекания химической реакции кремния с окислителем. Модель предполагает три потока (рис.2.2):
1) массоперенос окислителя через внешнюю границу растущего окисла SiO2 из газовой фазы (поток F1 ):
F1 = h(C* −C0 ) ,
где h - коэффициент переноса окисляющих частиц через внешнюю границу окисла; C* и C0 - концентрации окисляющих частиц вне окисла и вблизи
поверхности внутри окисла в любой момент времени окисления t (C0 принимается обычно равной предельной растворимости окислителя в SiO2 );
2)диффузию окисляющих частиц через окисел к границе раздела SiO2
-Si (поток F2 ):
F2 = D C0 −Ci x
где D - коэффициент диффузии окисляющих частиц; Ci - концентрация окислителя на границе SiO2 - Si ;
3) химическую реакцию взаимодействия окислителя с кремнием (поток F3 ):
F3 = kCi ,
где k - скорость реакции.
В условиях установившегося равновесия (поток F F = F1 = F2 = F3 ) решается дифференциальное уравнение для скорости окисления:
|
dx |
= |
|
F |
|
= |
|
|
kC* / N |
, |
(2.1) |
||||||||
|
|
|
N |
|
|
|
k |
|
|
kx |
|||||||||
|
dt |
|
|
1 |
+ |
+ |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
h |
|
D |
|
|
|||||
где N - число частиц окислителя, необходимое для создания единицы объема |
|||||||||||||||||||
окисла. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Если ввести обозначения |
|
|
|
|
|
|
|
|
|
|
|
2DC* |
|
||||||
|
1 |
|
|
1 |
|
, |
B = |
|
|
||||||||||
A = 2D |
|
|
+ |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
N |
|
|
||||||||||||
|
k |
|
|
h |
|
|
|
|
|
|
|
|
|
||||||
то уравнение (2.1) примет вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
dx dt = B /(A + 2x) . |
|
(2.2) |
|||||||||||||||||
Кремний легко окисляется при комнатной температуре, так что его поверхность всегда покрыта слоем окисла толщиной от 2 до 8 нм. Кроме того, термическое окисление может проводиться многократно. Для исследуемого процесса следует иметь в виду, что при t = 0 на поверхности кремния уже мог быть слой окисла толщиной х0. Поэтому интегрирование уравнения (2.2) ведется в пределах х0 - х, и решение его имеет вид:
x2 + Ax = B(t +t0 ) , |
(2.3) |
где t0 - время, соответствующее начальной толщине окисла х0.
x
x = BA (t + t0 )
x2 |
= Bt |
xхар |
|
x2 + Ax + B(t + t0 ) |
|
tхар |
t |
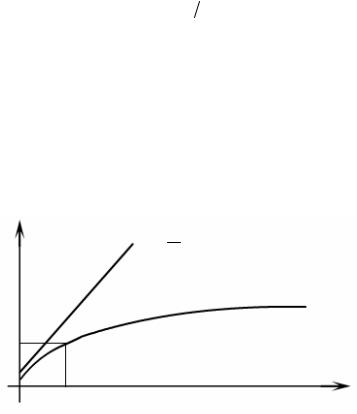
Рис.2.3. Зависимость толщины окисла кремния от времени окисления при высокой температуре
Зависимость толщины окисла от времени окисления при высокой (от 700 до 1200 °С) температуре изображена на рис.2.3. При малых временах окисления t << A2 / 4B рост окисла описывается линейным законом
x = |
B |
(t +t0 ) = kl t , |
(2.4) |
|
|||
|
A |
|
|
при больших временах окисления t >> A2 / 4B - параболическим |
|
||
x2 = Bt ≡ k p t , |
(2.5) |
||
где kl и k p - константы линейного и параболического роста соответственно. Имеется некоторое характерное время tхар , при превышении которого
линейный закон роста окисла переходит в параболический (см. рис.2.3). Уравнение (2.3) можно записать также в виде
