
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Карбоновые кислоты
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот
- •Функциональные производные карбоновых кислот

Карбоновые кислоты
Химические свойства
Большинство реакций карбоновых кислот можно отнести к одному из четырех основных типов:
1.Реакции сопровождающиеся разрывом -О – Н связей (кислотная диссоциация, сольволиз)
2.Реакции по карбонильному углероду – атака нуклеофила :Y по углероду карбонильной группы с последующим разрывом С – О связи (образование сложных эфиров, образование ацилхлоридов, восстановление гидридами)
3.Декарбоксилирование (электролиз по Кольбе, реакция Хунсдиккера)
4.Реакции по -углеродному атому (галогенирование, реакции-замещенных карбоновых кислот).

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
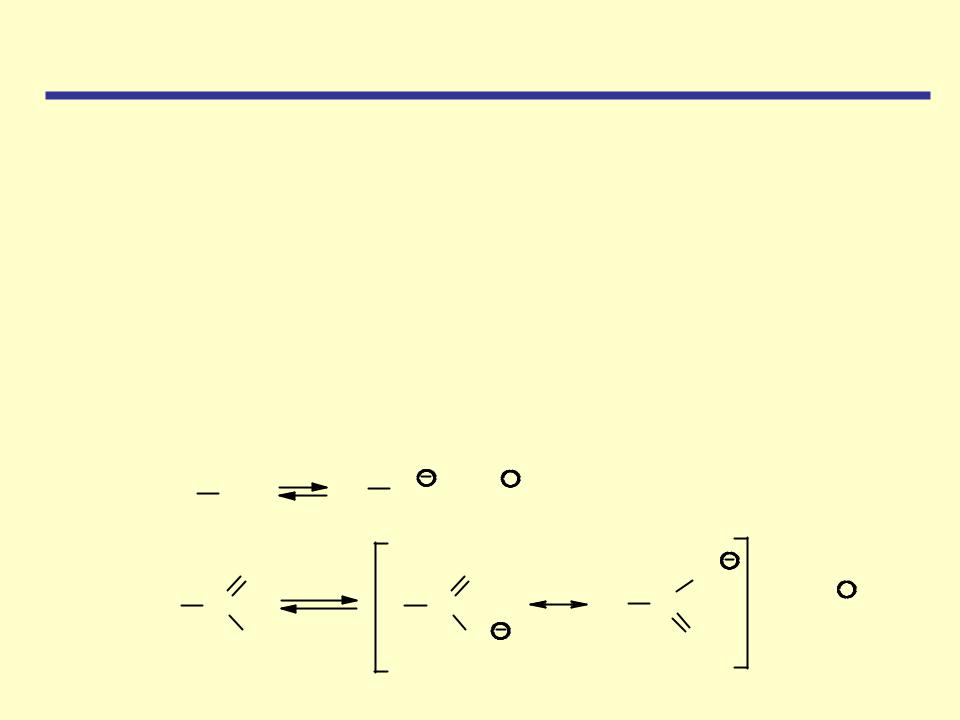
В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилат-аниона и иона водорода
+
RCOOH + H2O 
 R COO + H3O
R COO + H3O
Кa= |
[RCOO ] [H3O + ] |
pKa= - lg Ka |
[RCOOH] |
|
|
|
|
Константы их кислотности Ка приблизительно равны 10-5 (pKa 5)
Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Карбоксилат-ион представляет собой резонансный гибрид двух структур(I) и (II), атом углерода связан с каждым атомом кислорода одной полуторной связью, два электрона распределены на трех орбиталях – одного атома углерода и двух атомов кислорода, такая делокализация электронного облака делает анион-сопряженное основание более устойчивым, более слабым, а кислоту – более сильной
R |
OH |
R O |
+ H + |
|
|
|
|
O |
|
O |
R C |
O |
+ |
R |
C |
R |
C |
+ H |
||
|
OH |
I |
O |
II |
O |
|

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Поскольку карбоновые кислоты более сильные кислоты, чем вода, они легко переводятся в соли водными растворами щелочей, реакция обратима
|
|
O |
OH |
O |
|
R |
C |
|
R C |
||
OH H + |
|||||
|
|
O |
|||
Соли натрия, калия, аммониевые соли карбоновых кислот растворимы в воде, но не растворяются в органических растворителях

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Электроноакцепторные заместители, способствующие распределению отрицательного заряда в анионе, делают его более устойчивым и тем самым увеличивают кислотность. Электронодонорные заместители увеличивают отрицательный заряд и дестабилизируют анион – кислотность уменьшается
|
O |
|
|
O |
|
H |
C |
H |
C |
+ |
H |
|
OH |
|
|
O |
|
|
O |
|
|
O |
|
CH 3 |
C |
CH 3+I |
C |
+ |
H |
|
OH |
|
|
O |
|
+ |
pK |
a |
= 3,75 . |
|
|
|
+ |
pK |
a |
= 4,74 . |
|
|||
|
|
|
Электронодонорная группа СН3 подает электроны, дестабилизирует анион, уменьшает кислотность

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Электроноакцепторная группа ССl3 способствует распределению заряда, стабилизирует анион, увеличивает кислотность
|
O |
|
|
O |
|
|
|
CCl |
CCl |
C |
+ H |
|
pK |
a= 0,77 |
|
C |
+ |
||||||
|
|
|
|
|
|
|
|
|
3 |
|
3 |
|
|
|
|
|
OH |
|
|
O |
|
|
|

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
Для ароматических кислот влияние аналогичное. Следует учесть, что группы, проявляющие эффект сопряжения, самое сильное влияние на кислотность оказывают в том случае,
когда они находятся в орто- и пара-положении по отношению |
|||||
COOH |
|
COOH |
|
|
|
к карбоксильной |
группе |
|
|
COOH |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
COOH
Бензойная
кислота pKa= 4,20.
|
|
|
+ |
|
N+ O |
Бензойная |
O |
N O |
|
O |
|
кислота |
|
|
|
COOH |
|
pKa = 4,20 |
п-Нитробензойная кислота |
|
|||
NO2 - проявляет |
|
|
|||
|
|
|
|
||
|
|
|
|
O |
|
N |
|
|
|
N |
|
O |
O |
|
|
O |
|
n-Нитробензойная |
кислота |
|
м-Нитробензойная кислота |
||
NO 2 - проя вля ет электроноак- |
NO 2 - проя вля ет электроноакцеп- |
||||
цепторные эффекты: индук- |
|
торный индукционный эффект |
|||
ционный и сопря жения |
|
. |
-5 |
||
|
|
|
|
pKa =3210 |
|

Карбоновые кислоты
Реакции карбоновых кислот, сопровождающиеся разрывом О–Н-связи. Кислотность
COOH
COOH
OCH3
п-Метоксибензойная кислота электронодонорный эффект сопряжения преобладает
Ka=3,3.10-5

 OCH3
OCH3
м-Метоксибензойная кислота СН3О-проявляет электроноакцеп-
торный индукционный эффект Ka=8,2.10-5
Почти все орто-замещенные ароматические кислоты более сильные, чем бензойная кислота, независимо от характера орто- заместителя

Карбоновые кислоты
Реакции по карбонильному атому углерода, сопровождающиеся разрывом связи С-ОН. Превращение кислот в их функциональные производные RCOX
Гидроксил кислоты может быть замещен рядом других групп – Cl, OR’, NH2 и др., что приводит к образованию соединений,
известных под названием хлорангидриды, сложные эфиры, амиды. Это функциональные производные кислот, все они содержат ацильную группу RCO. Функциональные производные легко перевести вновь в кислоты простым гидролизом, они часто могут превращаться также и друг в друга

Карбоновые кислоты
Превращение в эфиры R-COOR1
Сложные эфиры образуются при взаимодействии карбоновых кислот со спиртами в присутствии сильных минеральных кислот (реакция этерификации)
|
|
|
|
|
|
C |
O |
+ HOC2H5 |
|
H2SO4 |
|
|
|
|
|
C |
O |
+ H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
OC2H5 |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
SN(AdN,E) |
|||||||||||||||
|
|
|
|
|
|
|
Ýòàí î ë |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Áåí çî é í àÿ |
|
Ýòè ëáåí çî àò |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
êè ñëî òà
Эта реакция обратима. Катализатор Н ускоряет прямую
реакцию – этерификацию и обратную реакцию - гидролиз. Равновесие можно сдвинуть в сторону образования сложного эфира, используя более дешевое исходное соединение: спирт или кислоту - в избытке, или удаляя один из продуктов из реакционной смеси
