
биология 10-11
.pdf
18 |
Глава 1. Химические основы жизни |
(или фибрилл). Так, белок гемоглобин состоит из четырех глобу лярных субъединиц (каждая несет группу гема с ионом железа).
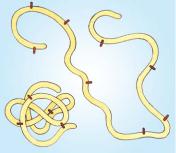
Формирование правильной пространственной структуры происходит по мере синтеза белковой цепи (последовательного присоединения аминокислот), на каждом этапе сборки белка соблюдается правило минимума потенциальной энергии: гидро фобные участки прячутся внутрь, а гидрофильные — вытесня ются наружу; заряды разного знака максимально сближаются (например, NH3 + и COO–). Если по какой либо причине эти правила укладки нарушаются, то белок оказывается неактивным или даже опасным для организма. Инфекционные белки прионы (<англ. protein infections particles) отличаются от нормальных белков прионов только вторичной и третичной структурой, но вызывают у человека и млекопитающих неизлечимые заболева ния центральной нервной системы («коровье бешенство»).
1.Какие молекулы называют биополимерами?
2.Все ли необходимые аминокислоты синтезирует наш ор ганизм?
3.Каким образом аминокислоты связываются в полипептид?
4.Что называют первичной, вторичной, третичной и четвер тичной структурами белка? Какова функция этих структур?
§ 4. Свойства и функции белков
Свойства белков. Различные комбинации аминокислот при дают белкам широкий спектр физико химических свойств.
Большинство белков содержат много гидрофильных амино кислот и поэтому хорошо растворимы в воде, они биологически активны только в растворах. Некоторые белки содержат много гидрофобных аминокислот и нерастворимы в воде.
Одни белки весьма устойчивы к температурным и хими ческим воздействиям, другие — крайне неустойчивы и при ничтожных изменениях в окружающей среде изменяют свою пространственную структуру. Эта их способность лежит в основе раздражимости — умения живых организмов адекватно реагиро вать на изменение внешних условий. На поверхности молекул белков может сосредоточиваться электростатический заряд. Его величина зависит от аминокислотного состава белка, это по зволяет разделять белки на группы в электрическом поле (при электрофорезе, рис. на с. 197).
Белки способны функционировать только в узком диапазо не температур и кислотности среды (рН), благоприятном для жизни организмов. При сильном повышении температуры,
§ 4. Свойства и функции белков |
19 |
|
Денатурация белка: цветом выделены связи, |
|
|
|
|
|
формирующие третичную структуру |
|
|
|
|
|
химическом воздействии или об |
|
|
лучении слабые связи, отвечающие |
|
→ |
за структуру белка, разрушаются, и |
|
|
|
→ |
|
белок теряет биологическую актив |
|
|
|
|
|
ность. Утрата белковыми молекула |
|
→ |
ми своей пространственной структу |
|
|
|
|
|
ры называется денатурацией. При |
|
|
денатурации первичная структура |
|
|
|
|
|
сохраняется, и в благоприятных условиях белок восстанавли вает пространственную организацию — ренатурируется. Необ ратимая денатурация ряда белков нашего организма проис ходит уже при 43 °С, поэтому заболевания, сопровождающиеся повышением температуры, представляют серьезную опасность.
Полная денатурация белка с нарушением вторичной и третичной структуры наблюдается, например, при варке яиц. Денатурацию белков вызывает также и кислотная среда же лудка. Денатурированные в вытянутые цепи белки становятся доступными для расщепления пищеварительными ферментами. Под действием молочнокислых бактерий повышается кислот ность молока, молочный белок денатурирует и теряет раство римость — молоко скисает.
Сворачивание в спираль и приобретение третичной струк туры происходит по мере удлинения белковой цепи в процес се ее синтеза, поэтому зачастую невозможно восстановление денатурированных сложных белков, даже если их первичная структура сохранена.
Функции белков. В клетках организмов белки выполняют множество важных функций.
С т р у к т у р н а я (с т р о и т е л ь н а я) ф у н к ц и я. Белки входят в состав клеточных мембран, образуют коллаге новые волокна соединительных тканей — сухожилий, хрящей, а также костей и кожи. У высших животных на долю коллагенов приходится до трети белковой массы. По мере старения в кол лагене образуется все больше ковалентных связей, хрящи теря ют пластичность, а кости становятся ломкими. Переплетенные многожильные структуры белков кератинов придают прочность волосам и ногтям человека, перьям птиц, копытам и рогам жи вотных; белки фиброины составляют основу шелка и паутины.
К а т а л и т и ч е с к а я ф у н к ц и я — одна из главных функций белков. Тонкая организация живой клетки не позволяет ей содержать бурно реагирующие вещества в за метных концентрациях или существенно повышать температуру, как это делают в лабораториях с целью ускорения химических

20 Глава 1. Химические основы жизни
Сахароза |
Геометрия активного центра ферментов |
|
|
|
точно соответствует форме молекул |
реакций. Тем не менее клетка ведет активную жизнедеятельность. Она расщепляет и окисляет поступающие извне вещества, синтезирует орга нические соединения.
Для ускорения химических реакций организ мы используют белки катализаторы. Их называ ют ферментами, или энзимами. В большинстве клеток их многие сотни. С участием ферментов реакции идут быстрее в 106—1018 раз. Например, молекула уреазы за 1 мин расщепляет до 30 тыс. молекул мочевины, в отсутствие фермента на это понадобилось бы около 3 млн лет. Ускоряя химические реакции, ферменты остаются неиз менными и не расходуются. Процессы расщепле ния и синтеза требуют участия групп ферментов, составляющих биохимические «конвейеры».
Каждый фермент выполняет только свои специфические функции. Ферменты, расщепляющие жиры, не действуют на белки или крахмал. В свою очередь другие фер менты расщепляют только крахмал или только белки.
Активный центр фермента соответствует форме реагирующих молекул, как перчатка — руке, обеспечивая максимальное сбли жение молекул, их строго определенную взаимную ориентацию и как следствие — интенсивное взаимодействие. Точное соответ ствие структуры активного центра ферментов строению катали зируемых соединений поражает не одно поколение ученых. Без ферментов реакции идут существенно медленней: молекулам редко удается столкнуться нужными частями и сохранять свое положение до завершения химической реакции.
При денатурации белка с нарушением пространственной структуры исчезают и его каталитические способности.
Р е г у л я т о р н у ю ф у н к ц и ю в организмах осу ществляют гормоны (<греч. hormon движущий), многие из них являются белками. Под их контролем протекают практически все процессы жизнедеятельности. Белковый гормон инсулин, синтези руемый поджелудочной железой, активирует белки переносчики, осуществляющие транспорт глюкозы в клетки. Если не хвата ет инсулина, глюкоза остается в крови с избытком, а клетки голодают. В этом причина заболевания сахарным диабетом.
Существуют и небелковые гормоны. Так, адреналин усилива ет сокращения сердца, поднимает артериальное давление, повы шает потребление кислорода и концентрацию в крови глюкозы (активирует ферменты, расщепляющие гликоген до глюкозы).
§ 4. Свойства и функции белков |
21 |
|
1 |
СТРУКТУРНАЯ |
|
9 |
2 |
ЗАПАСАЮЩАЯ |
КАТАЛИТИЧЕСКАЯ |
8 |
3 |
ЭНЕРГЕТИЧЕСКАЯ |
РЕГУЛЯТОРНАЯ |
7 |
4 |
ЗАЩИТНАЯ |
ДВИГАТЕЛЬНАЯ |
6 |
5 |
СИГНАЛЬНАЯ |
ТРАНСПОРТНАЯ |
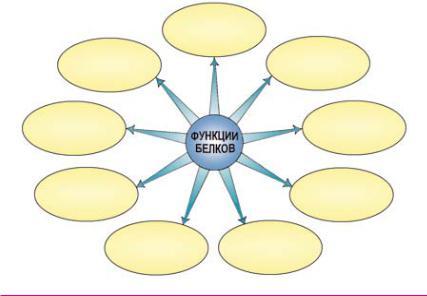
Вживых организмах белки выполняют девять основных функций
Дв и г а т е л ь н а я ф у н к ц и я. Особые сокра тительные белки обеспечивают все виды движения клеток и организма в целом. Они участвуют в перемещении мембранных пузырьков в цитоплазме клеток (динеин, кинезин), мерцании ресничек и вращении жгутиков у простейших, сокращении мышц у человека и животных. Сократительные белки рас крывают и закрывают цветки некоторых растений (росянки, мимозы). На совершение движений расходуется энергия молекул АТФ (аденозинтрифосфорной кислоты, см. § 6).
Т р а н с п о р т н а я ф у н к ц и я. Белки участвуют
вактивном переносе веществ через клеточные мембраны. Транс портные белки перемещают в цитоплазму клетки молекулы РНК, синтезированные в ядре. В состав эритроцитов крови вхо дит белок гемоглобин. В капиллярах сосудов легких он присое диняет кислород и доставляет его ко всем клеткам организма. Цитохромы митохондрий и хлоропластов переносят электроны.
С и г н а л ь н у ю ф у н к ц и ю белки выполняют благодаря способности изменять свою структуру в ответ на из менение внешних условий. Белки рецепторы обычно встроены в наружную мембрану. Они передают в клетку сигналы о темпера турных, световых, химических и механических воздействиях.
З а щ и т н а я ф у н к ц и я. При попадании в ор ганизм бактерий, вирусов, чужеродных белков лимфоциты синтезируют особые белки — антитела, которые распознают эти вредные компоненты и образуют в соединении с ними нетоксичный комплекс, который затем выводится из организма

22 Глава 1. Химические основы жизни
или переваривается специальными клетками. Этот механизм ле жит в основе иммунитета. С целью предупреждения заболеваний людям и животным вводятся вакцины ослабленных или убитых бактерий и вирусов. Болезнь не возникает, но клетки выраба тывают антитела, надежно защищающие организм многие годы.
Свертывание крови — сложная ферментативная защитная ре акция, в которой участвуют клетки стенок сосуда, тромбоциты и белки плазмы крови. В процессе свертывания растворенный в плазме крови белок фибриноген переходит в нерастворимый белок фибрин, составляющий основу сгустка крови, закрываю щего дефект сосуда.
Э н е р г е т и ч е с к у ю ф у н к ц и ю белки вы полняют лишь в крайних случаях, когда другого «топлива» нет.
З а п а с а ю щ у ю ф у н к ц и ю осуществляют, на пример, белки эндосперма растений: глиадин пшеницы, гордеин ячменя, зеатин кукурузы, легумины бобовых. При прорастании семян аминокислоты этих белков используются в качестве строительного материала.
По мнению ряда ученых, многообразные и специфические свойства белков свидетельствует о том, что появление жизни было сознательным актом Творца, а вовсе не результатом слу чайного перебора возможных комбинаций молекул в материа листической модели самозарождения жизни.
1.Что происходит с белками при варке яиц и скисании молока?
2.Опишите девять основных функций белков.
3.Какие особенности строения белков ферментов позволяют им выполнять каталитическую функцию?
4.Опишите механизм иммунитета.
§ 5. Биополимеры.
Нуклеиновые кислоты ДНК и РНК
Нуклеиновые (<лат. nucleus ядро) кислоты были открыты в 1868 г. швейцарским биохимиком Ф. Мишером при исследо вании ядер лейкоцитов человека. Их биологическое значение огромно. В нуклеиновых кислотах хранится наследственная информация всего организма. Они необходимы как для поддер жания жизни, так и для ее воспроизведения.
Существуют два типа нуклеиновых кислот: дезоксирибону клеиновые (ДНК) и рибонуклеиновые (РНК).
Дезоксирибонуклеиновая кислота (ДНК). Основное количе ство ДНК хранится в клеточных ядрах в составе хромосом
(<греч. chroma цвет + soma тело). Митохондрии и хлоропласты
§ 5. Биополимеры. Нуклеиновые кислоты ДНК и РНК |
23 |
Двойная
спираль
ДНК
3,4íì
Направление
считывания
0,34íì
2íì
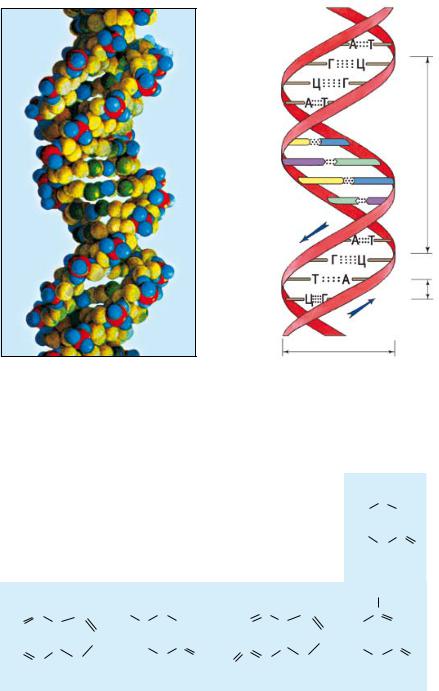
содержат небольшие кольцевые молекулы ДНК, несущие инфор мацию о строении и функционировании этих органелл. Простран ственная структура ДНК была выявлена в 1953 г. английским физиком Ф. Криком и американским биологом Дж. Уотсоном.
ДНК состоит из двух параллельных полимерных цепей, скру ченных в двойную правозакрученную спираль (одна вокруг дру гой и обе вокруг общей оси). Каждая цепь ДНК — полимер, моно
мерами которого являются нуклеотиды. Полимер |
|
|
|
О |
|
|
|
||||||||||||||||
ная цепочка (полинуклеотид) может содержать до |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
С |
|
|
|
|||||||||||||||||
100 млн нуклеотидов (у человека — 6×109 пар). В |
|
|
|
|
|
|
|||||||||||||||||
НС |
|
NН |
|||||||||||||||||||||
составе нуклеотида — одно из четырех азотистых |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
оснований: аденин (А), тимин (Т), гуанин (Г) или |
НС |
|
С |
||||||||||||||||||||
цитозин (Ц), а также моносахарид дезоксирибоза |
|
|
|
N |
|
|
О |
||||||||||||||||
|
|
|
Н |
|
|
|
|||||||||||||||||
и остаток фосфорной кислоты. |
|
|
|
|
|
|
|
Урацил (У) |
|||||||||||||||
|
NН |
2 |
|
|
|
О |
|
|
|
О |
|
|
|
|
|
|
NН2 |
||||||
|
|
|
Н3С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
N |
|
С |
|
|
|
С |
|
|
N |
|
|
С |
|
|
|
|
||||
N |
С |
|
С |
NН |
HN |
С |
НС |
N |
|||||||||||||||
|
|
|
|
СН |
|
|
|
|
|
|
|
|
|
|
СН |
|
|
|
|
|
|
|
|
НС |
С |
|
НС |
С |
С |
С |
НС |
С |
|||||||||||||||
|
N |
|
N |
|
|
N |
|
О |
|
N |
|
|
N |
|
|
N |
|
|
О |
||||
|
|
|
Н |
|
|
Н |
|
Н2N |
|
|
|
|
|
Н |
|
|
Н |
|
|
|
|||
|
Аденин (А) |
|
Тимин (Т) |
Гуанин (Г) |
Цитозин (Ц) |
||||||||||||||||||
24 |
Глава 1. Химические основы жизни |
5′-Р-конец |
О |
|
H |
|
|
|
–О Р О |
N |
H |
О |
|||
|
О |
|
А N |
|
|
|
5′ |
СН2 |
О |
|
H |
N Т |
|
|
|
|
|
|
|
|
|
3′ |
|
|
|
|
|
|
О |
H |
|
|
|
|
|
|
|
|
|
|
|
–О Р О |
N H |
|
О |
|
||
считывания |
|
О |
|
|
||
|
О |
|
|
|
|
|
|
СН2 |
Ц N |
H |
N Г |
||
|
|
О |
|
|
|
|
|
|
|
О |
H |
N |
|
Направление |
–О Р О |
|
|
|
H |
|
|
|
|
H |
|||
|
О |
|
|
|
||
|
|
|
|
|
|
|
|
|
СН2О |
Т N |
|
|
N А |
|
|
О |
О |
|
H |
N |
|
|
|
|
|
|
|
|
–О Р О |
|
H |
|
|
|
|
|
О |
|
N |
H |
О |
|
5′ СН2 |
|
Г N |
|
N Ц |
|
|
|
О |
|
|
||
|
|
|
|
|
|
|
|
|
3′ |
|
|
|
|
|
|
ОН |
|
О |
|
H N |
3′-ОН-конец |
|
|
|
H |
||
|
|
|
|
|
|
|
Участок двойной спирали молекулы ДНК
ОН |
3′-ОН-конец |
||
|
3′ |
|
|
О |
СН |
|
|
5′ |
2 |
|
|
|
О |
|
|
О Р О– |
|
||
|
О |
|
считывания |
О Р |
О– |
||
О СН |
|
||
|
|
2 |
|
|
О |
|
Направление |
|
О |
Р О– |
|
|
О |
|
|
О
СН2
О
О
3′
О
5′СН2
О
О Р О–
О
5′-Р-конец
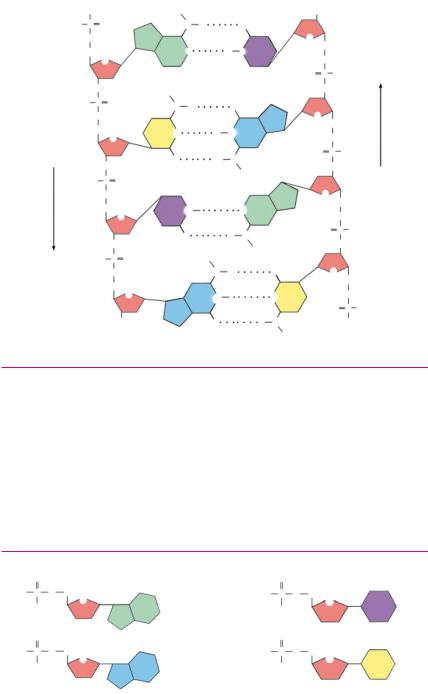
Четыре вида нуклеотидов различаются только азотистыми основаниями. В полинуклеотидной цепи ДНК молекулы дезок сирибозы связаны прочными ковалентными связями с остатками фосфорной кислоты соседних нуклеотидов. Две цепи ДНК свя зываются друг с другом посредством водородных связей между азотистыми основаниями.
Особенности строения молекул азотистых оснований дают следующую закономерность: основание А связывается только с Т, а Г — только с Ц. Такой порядок соединения энергетически выгоден, поскольку обеспечивает наибольшее количество водо родных связей и параллельность цепей ДНК. Нуклеотиды как
Четыре нуклеотида, входящие в состав молекулы ДНК
О
ОН Р О СН2О ОН
О
ОН Р О СН2О ОН
А
Г
О
ОН Р О СН2О ОН
О
ОН Р О СН2О ОН
Т
Ц

§ 5. Биополимеры. Нуклеиновые кислоты ДНК и РНК |
25 |
Точка начала репликации Репликон
→ |
→ |
→ |
→ |
→ |
→ |
|
|
|
|||
Вилка репликации |
|
|
→ |
|
|
|
|
|
|
|
|
Две дочерние молекулы ДНК
→ |
→ |
|
«Глазок»
Репликация ДНК у эукариот начинается сразу во многих точках
бы дополняют друг друга, образуя так называемые комплемен тарные пары А—Т и Г—Ц (<лат. complementum пополнение).
Поскольку цепи ДНК с одной стороны заканчиваются фосфа том, с другой — ОН группой, то говорят, что цепи полярны. По лярность цепей противоположна, поэтому их называют антипа раллельными. Считывание информации (транскрипция, см. § 17) происходит в противоположных направлениях — с каждой цепи в направлении от 5′ Р конца к 3′ ОН концу (цифры указывают номер атома углерода в дезоксирибозе, к которому присоеди нена ОН группа или фосфат на концах цепей, рис. на с. 18).
Если известен порядок следования нуклеотидов в одной цепи ДНК, то по принципу комплементарности можно установить порядок нуклеотидов в другой цепи. Комплементарность цепей позволяет ДНК реплицироваться (<лат. replicatio повторение) в две идентичные дочерние молекулы. Процесс удвоения состав ляет молекулярную основу размножения всех организмов.
Репликация ДНК в клетках эукариот начинается сразу во многих точках (у прокариот — в одной), образуя тысячи «глаз ков». ДНК полимераза в комплексе с другими ферментами (бо лее 15) разрушает слабые водородные связи между цепями ДНК и, раскручивая молекулу, удваивает ее по принципу комплемен тарности. Такие ферментные комплексы (реплисомы) расходятся от точек начала репликации в противоположных направлениях.
3′ |
5′ |
|
|
5′ |
3′ |
Вилка репликации. |
Фрагменты |
Нижняя нить (лидирующая) |
Оказаки |
удлиняется непрерывно, а верхняя |
|
(запаздывающая) — участками, образуя |
5′ |
так называемые фрагменты Оказаки, которые |
|
затем сшиваются в единую цепь. Скорость движения |
|
вилки у прокариот достигает 1 000 нуклеотидов/с |
3′ |
26 |
Глава 1. Химические основы жизни |
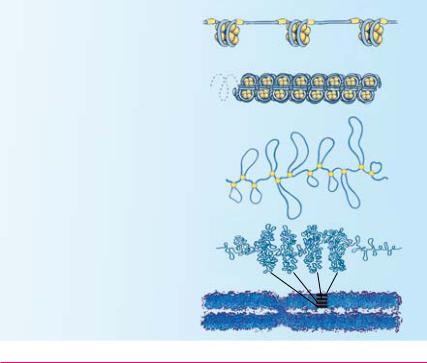
ДНК, навиваясь на комплекс из 8 молекул белков-гистонов (по 1,75 оборота), спираль образует нуклеосомы («бусинки на нити»), в каж- дой — около 150 пар нуклеотидов
При помощи других гистонов нуклеосомы формируют спиральную нить — фибриллу (6 нуклеосом на
один оборот спирали)
2 íì
10 íì
30 íì
Специальные белки сшивают нити фибрилл с образованием петель,
по 150 — 500 нуклеосом в каждой
Петли укладываются в стопки
Хромосома на одной из стадий деления клетки (в метафазе) состоит из двух идентичных хроматид, содержащих по одной молекуле ДНК, в каждой у млеко- питающих — около 3000 петель
300 íì
700 íì
1400 íì
Упаковка ДНК в хромосоме (указан размер по вертикали)
Полимераза способна присоединять нуклеотиды только в направлении считывания, поэтому одна из цепей (лидирующая) удлиняется непрерывно, а другая — прерывисто: по мере сме щения вилки репликации полимераза начинает синтезировать новый фрагмент, всегда в направлении 5′ → 3′.
Установив структуру ДНК, Ф. Крик и Дж. Уотсон предполо жили, что наследственная информация закодирована последова тельностью нуклеотидов, в которой каждому гену соответствует свой участок нуклеотидной цепи. Позже это предположение под твердилось, выяснился также механизм очень плотной упаковки спирали ДНК в ядре с образованием хромосомы. ДНК человека общей длиной 1,8 м содержится в ядре диаметром 6×10–6 м.
В структуре ДНК можно, таким образом, выделить два основополагающих свойства, благодаря которым ДНК является материальной основой наследственности:
—в чередовании четырех нуклеотидов ДНК закодирована вся наследственная информация организма;
—принцип комплементарности оснований лежит в основе важнейших генетических процессов: воспроизведения (репли кации) ДНК в ряду поколений, транскрипции (считывания
наследственной информации) и трансляции (синтеза белков
§ 5. Биополимеры. Нуклеиновые кислоты ДНК и РНК |
27 |
в соответствии с этой информацией), репарации (устранения нарушений в структуре ДНК), кроссинговера (дает новые ком бинации генов в потомстве, обеспечивая необходимое разноо бразие генетического материала). В следующих параграфах мы остановимся на этих свойствах ДНК более подробно.
Особенности строения ДНК озадачивали многих ученых: могла ли она возникнуть сама по себе? Нобелевский лауреат Ф. Крик заявил, что «нет никакой вероятности самопроизволь ного возникновения жизни из химических элементов Земли».
Рибонуклеиновая кислота (РНК). Молекулы РНК большин ства организмов представляют собой одиночную цепь нуклео тидов, сходную по строению с отдельной цепью ДНК. Только вместо дезоксирибозы РНК включает другой моносахарид — ри бозу, а вместо тимина — урацил. В некоторых патогенных для человека вирусах носителем генетической информации является двухцепочечная РНК, устроенная подобно ДНК (реовирусы).
Наследственную информацию, хранящуюся в ДНК, реали зуют именно РНК. Их молекулы синтезируются на соответ ствующих участках одной из цепей ДНК по принципу компле ментарности. РНК переносят информацию о строении белков от хромосом к месту синтеза и непосредственно участвуют в сборке белков.
Общая масса РНК в клетках превышает количество ДНК и варьирует в зависимости от стадии жизненного цикла клетки. Заметно большее количество РНК содержат клетки, интенсивно синтезирующие белки.
Различают три основных типа РНК.
Матричные РНК (мРНК) служат матрицей для синтеза белков. Они содержат информацию (другое их название — «ин формационные РНК», иРНК) о первичной структуре синтези руемых клеткой белков и переносят ее из ядра в цитоплазму к рибосомам, синтезирующим белки из аминокислот. Матричные РНК включают 100—10 000 нуклеотидов и составляют до 5% всей РНК клетки.
Рибосомные РНК (рРНК) входят в состав рибосом, определя ют их устройство и функционирование, они содержат 3—5 тыс. нуклеотидов. На долю рРНК приходится 85 % РНК клетки.
Транспортные РНК (тРНК) имеют малые размеры, в их со ставе 70—100 нуклеотидов. Основная часть тРНК находится в цито плазме, где они выполняют свою функцию — связывать и доставлять аминокислоты к рибосомам в процессе синтеза белков.
1.Каковы функции ДНК?
2.Опишите строение молекулы ДНК.
3.Как удваиваются ДНК и в чем главное значение этого процесса?
4.Откуда появляются РНК, какова функция мРНК, рРНК, тРНК?
