
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdfДобавить пропущенные фракции либо в дни отдыха, либо давая несколько фракций в день. В этом варианте и доза за фракцию и общее время курса сохраняются неизменными. Возможно это решение является наилучшим, однако если перерыв случился в конце курса, то его трудно реализовать.
Вопросы корректировки перерывов в курсе облучения специально обсуждались комитетом Королевского колледжа радиологов Великобритании. Материалы обсуждения приводятся в работе [59].
5.9. Низкая мощность дозы в брахитерапии
Низкую мощность дозы можно рассматривать как предельный случай гиперфракционирования: много небольших фракций, отпускаемых с высокой частотой. Использование низкой мощности дозы в брахитерапии имеет радиологические преимущества и недостатки. Вот как они сформулированы в работе [5].
Преимущества:
при достаточно низкой мощности дозы максимально щадятся нормальные ткани с поздней реакцией;
облучение занимает относительно короткое общее время, предоставляя тем самым минимальное время для репопуляции клеток опухоли;
геометрическая форма поля облучения использует объемный эффект по отношению к повреждению нормальных тканей. По сравнению с облучением внешними пучками объем нормальной ткани, находящейся в области высокой дозы, обычно уменьшается;
гибель клеток опухоли вблизи имплантированного источ-
ника является очень интенсивной и приводит к уменьшению объема опухоли.
Недостатки:
111
очень неоднородное дозовое распределение создает риск геометрического пропуска некоторых клеток опухоли;
короткое общее время облучения может оказаться недостаточным для полной реоксигенации гипоксических клеток опухоли;
появляется желание слишком убыстрить облучение, особенно в импульсной брахитерапии с высокой дозой, но при
этом потеряется часть важных преимуществ, перечисленных выше.
Эффект от однократного облучения с низкой мощностью дозы отличается от эффекта, созданной той же дозой, но передаваемой с высокой мощностью, так как продление времени облучения позволяет иметь место нескольким биологическим процессам, в частности 4 Rs, отмеченным ранее. На каком интервале мощностей доз действуют данные процессы? Это зависит от их скорости. Процесс быстрого восстановления может конкурировать с быстрым нанесением повреждений, что создает комбинацию эффектов при высокой мощности дозы. Как приблизительное руководство время процесса следует сравнивать со временем экспозиции при низкой мощности дозы. Репарация является быстрым процессом с временем полувосстановления для клеток млекопитающих в районе 1 ч. При мощности дозы ~ 100 сГр/мин и больше доза 2 Гр создается за 2 мин, что явно недостаточно для восстановления клеток. Понижение мощности дозы до 10 сГр/мин увеличивает время облучения до 20 мин, и тогда имеет место частичное восстановление. Наконец, понижение мощности дозы до 1 сГр/мин увеличивает время экспозиции до 3 ч. В этом случае восстановление успеет почти закончиться.
Учет эффекта неполной репарации для непрерывного облучения с низкой мощностью дозы возможно выполнить в рам-
ках EQD2 формализма. Соответствующая формула для определения EQD2 при условии, что происходит полное восста-
112
новление между экспозициями с низкой мощностью дозы, имеет вид:
|
EQD2 D |
dg ( / ) |
, |
(1.33) |
|
2 ( / ) |
|||
|
|
|
|
|
где |
g 2[ t 1 exp( t)]/( t)2 ; |
(1.34) |
||
|
0,693 / T1/ 2 ; |
|
(1.35) |
|
t – время экспозиции; D – полная доза; d – имеет тот же смысл, что и во фракционной терапии. Для однократного облучения с низкой мощностью дозы d = D. Если полное восстановление между экспозициями не происходит, то необхо-
димо добавить дополнительный фактор Hm, как в уравнении
(1.30).
В отличие от репарации, пролиферация является очень медленным процессом. Время клеточного цикла для клеток человека находится в интервале от 1 до нескольких дней и даже месяцев, и только когда время экспозиции равняется дню или больше, пролиферация будет оказывать заметное влияние.
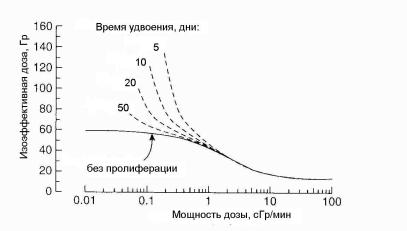
Рис. 1.42. Расчетные зависимости изоэффективных доз от мощности дозы при однократной экспозиции для разных скоростей пролиферации [5]
113
На рис. 1.42 это влияние демонстрируется в виде расчетных изоэффективных кривых для популяции клеток, имеющих отношение α/β ≈ 3,7 Гр. Сплошная линия показывают щадящий эффект репарации (время полувосстановления 0,85 час), основное влияние которого проявляется в дозовом диапазоне от 20 сГр/мин до 0,2 сГр/мин. Пунктирные линии показывают зависимость эффекта пролиферации от мощности дозы при различных временах удвоения клеток. Представленные данные указывают на существенное щажение, которое имеет место при очень малых мощностях доз в пролиферирующих тканях.
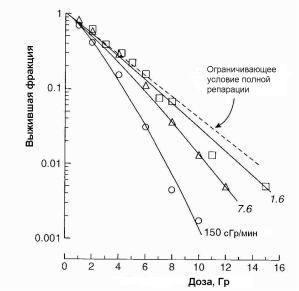
Рис. 1.43. Зависимость выживаемости клеток меланомы от дозы при различной мощности дозы [5]
Влияние изменения мощности дозы на выживаемость клеток показано на рис. 1.43 [5]. Из представленных данных видно, что выживаемость клеток увеличивается с уменьшением мощности дозы. Плечевая часть кривой переходит в прямую линию при мощности дозы ~1 сГр/мин. Происходит
114
так потому, что зависимые от времени процессы, создающие плечо кривой, могут продолжаться в течение экспозиции и даже доходить до полного завершения.
У разных линий клеток наблюдается большое различие в радиочувствительности при низких уровнях мощности дозы, так как в этой области чувствительность определяется, главным образом, α-компонентой LQ-уравнения, которая широко варьирует среди разных клеточных линий (см. рис. 1.13). Многие виды клеток успешно восстанавливаются после облучения, показывая сильную зависимость от мощности дозы. Редким исключением является костный мозг, радиочувствительность стволовых клеток которого слабо зависит от мощности дозы.
Оценивая терапевтические перспективы этих данных, следует понимать, что клиническое применение излучения с низкой мощностью дозы определяется, в первую очередь, не радиобиологическими причинами, а тем, что эта технология позволяет получать лучшие дозовые распределения во внутритканевой и внутриполостной ЛТ. Кроме того, основной выбор происходит не между однократным облучением при высокой мощности дозы или облучением при низкой мощности дозы, а между фракционным облучением при высокой мощности дозы и однократной (или небольшим количеством) экспозицией при низкой мощности дозы. Как отмечалось выше, оба эти направления продленного лучевого лечения эксплуатируют одинаковые биологические процессы (репарацию и репопуляцию) и в широком смысле щадящие эффекты у них близки.
Фаулер в работе [60] рассчитал на основе LQ-модели соотношение эквивалентности между фракционным облучением и экспозицией с низкой мощностью дозы. Для опухоли с отношением α/β = 10 Гр и поздно реагирующей нормальной ткани с отношением α/β = 3 Гр относительные эффекты экспозиции с мощностью дозы 50 сГр/ч будут эквивалентны
115
фракционному облучению с высокой мощностью дозы: 30 фракций по 2 Гр каждая. Преимущество непрерывной экспозиции в том, что она будет завершена за 5 дней. Таким образом, ЛТ с низкой мощностью дозы является одним из наиболее эффективных способов максимизации восстановления при короткой продолжительности лучевого лечения. Теоретически оно наиболее эффективно для опухолей, имеющих быстрый процесс репопуляции.
Контрольные вопросы к главе 1
1.Какую роль играет радиобиология в развитие лучевой терапии?
2.Охарактеризуйте временной масштаб процессов, имеющих место при воздействии ионизирующих излучений на биологические объекты.
3.Какие клетки называют клоногенными?
4.Охарактеризуйте основные механизмы и причины гибели клеток в результате облучения.
5.Как проводятся тесты клеток на клонообразующую способность и как определяется выжившая фракция?
6.Какие формы имеет зависимость выживаемости клеток от дозы в линейном и полулогарифмическом масштабах?
7.Каким образом достигается локальный контроль (резорбция) опухоли?
8.Как происходит изменение объема не взятой под контроль опухоли во времени до и после облучения?
9.Какие особенности восстановления (репарации) клеток после облучения важны для успешного результата лучевого лечения?
10.Как изменяется радиочувствительность клеток на разных стадиях клеточного цикла?
11.В чем заключается эффект перераспределения (reassortment) клеток в процессе облучения?
116
12.Что такое кислородный эффект и какие у него особенности?
13.Почему появляется гипоксия клеток в опухоли и как она влияет на радиорезистентность клеток?
14.Что такое реоксигинация опухоли?
15.Какую временную зависимость имеет гипоксическая фракция клеток опухоли?
16.Из каких компонентов состоит LQ-модель, аппроксимирующая зависимость выживаемости клеток от дозы излучения?
17.При каких дозах LQ-модель неудовлетворительно описывает зависимость выживаемости клеток от дозы?
18.На какие классы делятся ионизирующие излучения с точки зрения качества?
19.Как количественно оценивается качество ионизирующего излучения?
20.От каких величин зависит ОБЭ излучения?
21.Как изменяется ККУ с увеличением ЛПЭ?
22.Какие имеются радиобиологические предпосылки для использования в лучевой терапии излучений с высоким ЛПЭ?
23.Какие факторы влияют на тяжесть радиационного повреждения нормальных тканей?
24.Что такое пролиферативная структура тканей?
25.В чем различие между ранними и поздними реакциями тканей на облучение?
26.Как формулируется в лучевой терапии концепция толерантности нормальных тканей?
27.Какую форму имеют кривые доза-отклик?
28.С помощью какой величины определяется первоначальный наклон кривой доза-отклик?
29.Какие факторы влияют кривые доза-отклик?
30.Как количественно оцениваются радиационноиндуцированные эффекты в нормальных тканях?
117
31.Что такое объемный эффект и как он связан со структурной организацией ткани?
32.Какие основные биологические факторы влияют на отклик нормальных тканей и злокачественных опухолей при проведении фракционной лучевой терапии?
33.В чем причины перехода в лучевом лечении на фракционированное облучение?
34.В чем заключается концепция ВДФ?
35.Какая разница у чувствительности к фракционированию наблюдается у рано и поздно реагирующих тканей?
36.Как определяется биологически эффективная доза?
37.Каким образом рассчитывается EQD2 при пересчете от конкретного режима фракционирования к стандартному режиму по 2 Гр за фракцию?
38.Охарактеризуйте обоснование режима фракционирования на базе LQ-модели?
39.Как можно определить коэффициенты LQ-модели?
40.В чем состоят особенности гипофракционирования?
41.Каким образом определяется дополнительная компенсирующая доза при изменении общего времени курса?
42.Что такое гиперфракционирование и ускоренное фракционирование?
43.Какой интервал между фракциями следует выдерживать при нескольких фракциях в день?
44.Каким образом учитываются перерывы в облучении?
45.Назовите преимущества и недостатки использования низкой мощности дозы в брахитерапии?
Список литературы
1. Steel G.G. Introduction: the significance of radiobiology for radiotherapy // In: Basic clinical radiobiology. 3-rd edition / Edited by G.G. Steel. 2002. Hodder Arnold. P. 1 – 7.
118
2.Boag J.W. The time-scale in radiation biology. 12th Faila memorial lecture // In: Radiation Research / Edited by O.F. Nygaard, H.I. Adler, W.K. Sinclair. 1975. Academic Press. San Diego.
3.Trott K.R. // Curr. Top. Radiat. Res. V. 7. 1972. P. 336 –
337.
4.Ярмоненко С.П., Вайнсон А.А. Радиобиология человека
иживотных. 4-e изд. 2004. М.: Высш. шк. С. 86.
5.Steel G., Nahum A. Radiobiology // In: Handbook of radiotherapy physics. Theory and Practice / Edited by P. Mayles, A. Nahum, J.C. Rosenwald. 2007. Taylor & Francis Groop. P. 127 – 182.
6.Sinclair W.K., Morton R.A. X-ray and ultraviolet sensitivity of sinchronised Chinese hamster cells at varios stages of cell cycle // Biophys. J. V.5. 1965. P. 1 – 25.
7.Denekamp J. Physiological hypoxia and its influence on radiotherapy // In: The biological basis of radiotherapy. 2-nd edition / Edited by G.G. Steel, G.F. Adams, A. Horwich. 1989. Elsevier Science, Amsterdam.
8.Thomlinson R.H., Gray L.H. The histological structure of some human lung cancers and the possible implication for radiotherapy // Br. J. Cancer. V. 9. 1955. P. 539 – 549.
9.Horsman M.R., Overgaard J. Oxygen effect and tumor microenvironment // In: Basic clinical radiobiology. 3-rd edition / Edited by G.G. Steel. 2002. Hodder Arnold. P. 158 – 168.
10.Hill R.P., Bush R.S., Yeung P. The effect of anemia on the fraction of hypoxic cells in an experimental tumor // Br. J. Radiol. V. 44, 1971, P. 299 – 304.
11.Fertil B., Malaise E.P. Inherent radiosensitivity as a basic concept for human tumor radiotherapy // Int. J. Radiat. Oncol. Biol. Phys. V. 7. 1981. P. 621 – 629.
12.Deacon J., Pecham M.J., Steel G.G. The radioresponsiveness of human tumors and the initial slope of cell survival curve // Radiother. Oncol. V. 2. 1984, P. 317 – 323.
119
13.Steel G.G. Cellular sensitivity to low dose-rate irradiation focuses the problem of tumor radioresistance // Radiother. Oncol. V. 20. 1991, P. 71 – 83.
14.Chapman J.D. The single-hit mechanism of tumor cell killing by radiation // Int. J. Radiat. Biol. V. 79. 2003. P. 71 – 81.
15.Low dose hypersensitivity in T98G human glioblastoma cell line / S.C. Short, C. Mayes, M. Woodcock et al. // Int. J. Radiat. Biol. V. 75. 1999. P. 847 – 855.
16.Low-dose hypersensitivity: current status and possible mechanism / M.C.Joiner, B. Marples, P. Lambin et al. // Int. J. Radiat. Oncol. Biol. Phys. V. 49. 2001. P. 379 – 389.
17.Goodhead D.T. Spatial and temporal distribution of energy // Health. Phys. V. 55. 1988, P. 231 – 240.
18.Goodhead D.T. The initial physical damage produced by ionizing radiation // Int. J. Radiat. Biol. V. 56. 1989. P. 623 – 624.
19.Barendsen G.W. Responses of cultured cells, tumors and normal tissues to radiation of different linear energy transfer // Curr. Topics Radiat. Res. V. 4. 1968, P. 293 – 356.
20.Dasu A., Denekamp J. New insights into factors influencing relevant oxygen enhancement ratio // Radiother. Oncol. V. 46. 1998. P. 269 – 277.
21.Incorporating clinical measurements of hypoxia into tumor local control modeling of prostate cancer: implications for the α/β ratio / A.E. Nahum, B. Movsas, E.M. Horwitz et al. // Int. J. Radiat. Oncol. Biol. Phys. V. 57. 2003. P. 391 – 401.
22.Joiner C.M. Particle beams in radiotherapy // In: Basic clinical radiobiology. 3-rd edition / Edited by G.G. Steel. 2002. Hodder Arnold. P. 205 – 216.
23.Joiner M.C., Johns H. Renal damage in the mouse: the ef-
fect of d(4)-Be neutrons // Radiat. Res. V. 109. 1987. P. 456 – 468.
24. Withers H.R., Thames H.D., Peters L.J. Biological bases for high RBE values for late effects of neutron irradiation // Int. J. Radiat. Oncol. Biol. Phys. V. 8. 1982. P. 2071 – 2076.
120
