
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdfПервопричина объемного эффекта отличается в разных нормальных тканях. Ситуация осложняется, когда в области облучения находятся несколько разных органов (пример, область вблизи почечной лоханки). Тогда объемный эффект зависит от вероятностей осложнений, обусловленных долей объемов каждого органа, находящихся в районе высокой дозы (см. рис. 1.30). Сериальный тип тканей будет показывать существенно более крутую зависимость, чем параллельный тип на графиках данного вида. Кроме того, отметим что концепция осложнений определяется не только измеряемыми биологическими факторами, но и также восприятием пациента.
4.8.3. Математическое моделирование объемного эффекта
В настоящее время разработан ряд математических моделей
для оценки вероятности осложнений в нормальных тканях
(англ. normal tissue complication probability (NTCP)) при облу-
чении парциального объема органов и негомогенном дозовом распределении. Эти модели будут подробно рассмотрены в главе 11 части 2 , здесь же мы обсудим некоторые вопросы, связанные с учетом объемного эффекта.
Одним из наиболее ранних способов учета объемного эффекта был так называемый степенной закон. Следом появились модели, имеющие больший биофизический базис. В модели Лимана (1985 г.) степенной закон предлагается для соотношения между толерантными дозами при однородном облучении всего объема органа и парциального объема органа. Параметр n (степень парциального объема) описывает зависимость толерантной дозы от облучаемого объема. При n→1 объемный эффект большой, и наоборот, при n→0 объемный эффект отсутствует. Независимый эмпирический поход к учету объемного эффекта был разработан в СССР Л.Я. Клеп-
81
пером (1986 г.) на основе использования функции Вейбулла. Обе модели обобщены на случай негомогенного дозового распределения. В модели Лимана для этого используется понятие эффективного объема, предложенное Катчером и Бьюрманом. Результирующая, так называемая LKB модель является в настоящее время наиболее часто используемой моделью для предсказания NTCP.
Промежуточную модель между чисто эмпирической и более биофизической моделями разработал Кальман (1992 г.) для органов с относительно сериальной структурой. В этой модели вводится дополнительный параметр s, вводящий «степень сериальности» для описания структурной организации ткани. Значение s, близкое к нулю, представляет параллельную структуру, и s, близкое к единице, представляет орган с сериальной организацией. В первом случае предполагается, что
орган делится на дискретные ячейки или функциональные небольшие единицы (англ. functional subunits (FSU)). FSU оп-
ределяется как максимальная ячейка клеток, которая может быть регенерирована из одной выжившей клоногенной клетки. Радиационный отклик каждой независимой FSU описывается статистикой Пуассона, пространственная организация FSU определяет ответ органа на облучение парциального объема.
Для органов с сериальной организацией каждое FSU жизненно необходимо для функционирования органа, и непоправимое повреждение любого критического элемента приведет к осложнению. Модели, базирующиеся на сериальной организации, предсказывают слабую объемную зависимость NTCP, если облучаемый объем больше нескольких FSU и крутую зависимость доза-эффект. Для органов, где FSU организованы в параллельные структуры (например, легкие), интегральный ответ органа, как целое, зависит от фракции поврежденных FSU и функционального резерва органа. Модели, базирующиеся на параллельной организации, предсказы-
82
вают большой объемный эффект, и высокая доза в малом объеме не приводит к осложнению. Такие ткани, как кожа и слизистая оболочка имеют смешанную структуру и функционально определенные FSU . Эти ткани показывают дифференцированный отклик на облучение, зависящий от локальной плотности инактивированных FSU.
4.9.Основные биологические факторы фракционной лучевой терапии
Перед тем как перейти к обсуждению вопросов фракционирования облучения, выделим еще раз основные биологические факторы, влияющие на отклик нормальных тканей и злокачественных опухолей при проведении фракционной лучевой терапии [5]:
Радиочувствительность (англ. radiosensitivity). При дан-
ном режиме фракционирования (или однократного облучения) некоторые органы и системы организма показывают более сильную ответную реакцию, чем другие (например, кроветворная система и почки). Аналогичная ситуация имеет место у опухолей.
Репарация (англ. repair). Процесс восстановление клеток в течение нескольких часов после облучения.
Пересортировка (англ. reassortment). Эффекты, связанные
сразвитием клеточного цикла. После первой дозы облучения выживают клетки, находящиеся в основном в радиорезистентной фазе клеточного цикла, и через несколько часов они могут перейти в более радиочувствительную фазу.
Репопуляция (англ. repopulation). В течение 4 – 6 недель
курса ЛТ выжившие клетки опухоли могут пролиферировать и, таким образом, увеличить число клеток, которые необходимо убить.
Реоксигенация (англ. reoxygenation). Наиболее резистентными в опухоли являются гипоксические клетки. Они выжи-
83
вают, как правило, после первых фракций ЛТ. Однако затем их снабжение кислородом улучшается, и радиочувствительность этих клеток увеличивается.
В англоязычной учебно-научной литературе эти факторы часто называют ―5 Rs‖ радиотерапии.
5.Фракционирование дозы в лучевой терапии
Вначальном периоде развития лучевого лечения злокачественных новообразований онкологи использовали однократное облучение. Однако через некоторое время опытным путем было найдено, что распределяя полную дозу на несколько недель, можно также достигнуть хорошего контроля над опухолью при существенно меньших побочных эффектах. С тех пор прошли десятилетия интенсивных лабораторных и клинических исследований в поисках научного обоснования фракционирования облучения в ЛТ. Особенно важные успехи в теоретическом обосновании принципов фракционирования дозы были получены в последние двадцать лет. Новое понимание вопросов: почему работает фракцио-
нирование, и как его можно оптимизировать, было достигнуто на основе линейно-квадратичной модели (LQ-модель) для выживаемости клеток. В настоящее время вопросы фракционирования являются ключевой областью клинической ЛТ, и
имеются бесспорные доказательства, что оптимизация взаимосвязи время-доза имеет решающее значения для получения хороших клинических результатов.
5.1.История подходов к фракционированию
Попытки разработки количественного базиса для изменений в дозовом фракционировании начались с работы Страндквиста и Коэна в сороковых годах прошлого века. Эти ученые документировали свои успехи и неудачи в контролиро-
84
вании новообразований кожи с помощью ЛТ и регистрировали частоту образования некроза кожи. Они обнаружили, что полная доза, необходимая для контроля над опухолью, увеличивается с увеличением числа фракций. В то время было принято облучать пять раз в неделю и было трудно разделить эффект времени облучения от эффекта числа фракций. Для каждого пациента с раком кожи Страндквист строил в двойном логарифмическом масштабе зависимость полной дозы от общего времени облучения. При этом он использовал разные символы для локального контроля и для некроза кожи. Анализируя результаты, он обнаружил, что через эти данные возможно провести прямые линии, явно разделяющие два вида символов. Эти линии имели направление вверх (полная доза увеличивалась с увеличением числа фракций) и стали часто называться кривыми Страндквиста [34]. Это было первой количественной демонстрацией процесса восстановления опухолей и нормальных тканей. Кривые Страндквиста явились также первыми примерами изоэффективных кривых, которые играют важную роль в поиске подходов к оптимизации ЛТ. Страндквист получил коэффициент наклона кривых равной 0,22, но позднее Коэн [35], используя дополнительные данные, уточнил величину наклона, увеличив ее до 0,33. Впоследствии эта закономерность получила название закона кубического корня. Если радиационному онкологу нужно изменить общее время облучения, ему требуется снять с кривой Страндквиста новое значение полной дозы, приводящее к такому же выходному результату.
В 1969 году Еллис выдвинул гипотезу [36], что данные, использованные Страндквистом и Кохеном, можно было бы резюмировать в виде простой формулы. Их прямые линии в логарифмических координатах подразумевают соотношение в виде степенного закона между полной дозой и общим временем облучения для фиксированного уровня эффекта. Хотя точных данных относительно роли числа фракций (N) и об-
85
щего времени облучения (T) у Еллиса не имелось, он, используя интуицию, разделил показатели для N и T в следующем виде:
D NSD N 0,24 T 0,11, |
(1.15) |
где D – полная (изоэффективная) доза; NSD – номинальная стандартная доза определяет интенсивность облучения и предполагается постоянной для конкретной клинической ситуации.
Выражение (1.15) часто называют NSD формулой. Эта формула использовалась многие годы как стандартный метод корректировки полной дозы при изменении во фракционировании, хотя научное обоснование у нее довольно слабое. Оригинальные данные, которые использовались при ее получении, имели большой разброс и относились только к коже. Постепенно стало ясно, что формула работает только внутри строго определенных условий и для ограниченного числа фракций. Практика показала, что этот рабочий диапазон числа фракций для NSD формулы составляет N ≈ 10 ÷ 30. Из детальных исследований на животных было получено, что степенной закон в большинстве случаев неудовлетворительно описывает экспериментальные данные, и их наклон во многих случаях сильно отличается от NSD формулы.
Конечно, эксперименты с лабораторными животными имеют ограничения, так как временной масштаб развития опухоли и эффектов в нормальных тканях грызунов обычно существенно короче, чем у человека. Но они позволили усовершенствовать планирование фракционирования. Важным результатом этих экспериментов явилось открытие, что кривые Страндквиста не являются, как правило, прямыми. Пример показан на рис. 1.32. В экспериментах с кожей мышей число фракций изменялось от 1 до 64 при общем времени облучения 8 дней. Определялась полная доза, приводящая к произвольно выбранному (но одинаковому) изоэффекту [37]. Эти дозы приводятся на рис. 1.32,а. Как видно из рисунка,
86
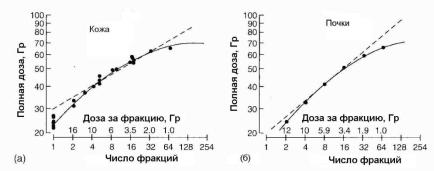
кривая имеет выпуклость вверх, и данные оказываются ниже NSD линии для малого и большого числа фракций. Поэтому использование NSD формулы в этих областях оказывается небезопасным, так как она предсказывает более высокие изоэффективные дозы, чем толерантный уровень.
Рис. 1.32. Изоэффективные кривые для кожи и почки мышей: а – острые реакции кожи [37]; б – поздние поражения почки [38]. Пунктирные линии – результат аппроксимации NSD формулой; сплошные линии – результат аппроксимации по LQ- модели
На рис. 1.32,б показаны результаты подобных экспериментов с почками как поздно реагирующими тканями [38]. Здесь изоэффективная кривая опять имеет выпуклость вверх. Как результат таких исследований ученые предприняли неоднократные попытки усовершенствовать NSD формулу. В частности, появились варианты, известные как КРЭ (кумулятивный радиационный эффект, англ. CRE) и ВДФ ( фактор вре- мя-доза-фракционирование, англ. TDF) формулы.
Концепция ВДФ, разработанная Ортоном и Еллисом, широко использовалась в России и странах СНГ. Она позволяет рассчитывать уровень поражения ткани относительно толерантного уровня при изменении общего времени курса, разовой дозы и числа фракций. Приведем описание этой концепции, данное в работе [4]. В концепции принимается, что при стандартном курсе ЛТ происходит достижение уровня толерантности без его превышения, а «биологическая доза», рав-
87
ная уровню толерантности, называется ВДФ. Биологическая доза, характеризующая степень поражения ткани, рассчитывается, исходя из физической дозы путем введения поправок: а) на восстановление клеток между фракциями (в основном, от сублетальных поражений); б) на восстановление клеточной популяции, т.е. деление клеток, проходящее в течение всего курса ЛТ.
Физическая разовая доза d для «универсальной соединительной ткани» конвертируется в биологическую возведением ее в степень 1,538, а поправка на восстановление клеточной популяции в течение курса облучения вносится возведением в степень 0,169 времени в днях (x), приходящихся в среднем на одну фракцию курса. Смысл этих поправок состоит как бы в подсчете величины толерантной дозы для условий однократного облучения, с которыми можно сравнить различные режимы фракционирования. Расчеты традиционно ведутся в сантигреях:
ВДФ x-0,169d 1,538n . |
(1.16) |
Длительность стандартного курса ЛТ из 30 фракций принята равной 39 дням (за счет перерыва на субботу и воскресенье), на одну фракцию приходится 1,3 дня. Таким образом, для этого курса
ВДФ 1,3 0,169 2001,538 30 99277.
Для удобства пользования это число уменьшено в 1000 раз и округлено до 100. Величина ВДФ, равная 100, принята за уровень толерантности нормальной ткани.
Показатели степени у x и d должны быть определены отдельно для каждой ткани, так как изменяются в широких пределах. Широко варьирует и рассчитанная величина ВДФ (см. табл. П.3). Знание показателей у x и d позволяет сравнивать два режима облучения и без привязки их к ВДФ. Если один режим облучения приводит к достижению, но не превышению толерантного уровня, то для другого режима может быть, например, определено число фракций (в конечном ито-
88
ге, полная доза), при котором он будет приводить к такому же поражению нормальных тканей. В качестве примера рассмотрим отдаленную энцефалопатию, возникающую при попадании спинного мозга в зону высокой дозы. Показатель степени при x в уравнении (1.16) в этом случае равен -0,07, а при d равен 2,439. Два режима, обозначенные как 1 и 2, будут эквивалентны в этом плане, когда при изменении разовой дозы d и числа фракций n будет сохраняться равенство
n1d12,439x1 0,07 |
n2 d22,439x2 0,07. |
(1.17) |
Использование представлений об изоэффективных (в плане лучевых осложнений) режимах предполагает получение собственных коэффициентов для каждого вида тканей и критерия поражения, а также учет облучаемого объема. Но и в этих условиях сравнению подлежат режимы облучения, относительно близкие по величине дозы за фракцию и интервалам между фракциями. Кроме того, значения параметров модели ВДФ, необходимые для проведения расчетов, имеются в настоящее время, в основном, только для универсальной соединительной ткани.
В начале восьмидесятых годов пришло понимание, что степенной закон не подходит для описания соотношения время-доза в ЛТ. Более того, появилась настоятельная потребность в изобретении модели и расчетных формул, которые работали бы в конкретных клинических условиях для разных видов тканей. Критика формулы Еллиса и различные ее усовершенствования подробно описаны в работе [29].
5.2. Чувствительность к фракционированию у рано и поздно реагирующих тканей
Различие в ответах на фракционирование у рано и поздно реагирующих тканей у мышей было замечено в работе [39]. Авторы суммировали опубликованные данные для мышей, отбирая только те, где общее время было коротким, чтобы
89
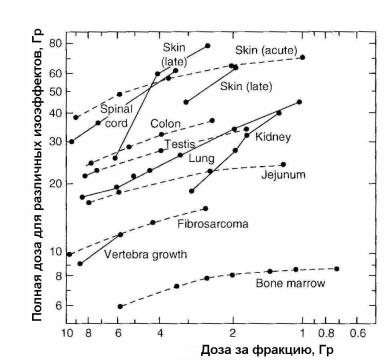
минимизировать эффект репопуляции клеток. На рис. 1.33 представлена их коллекция изоэффективных кривых для различных тканей в зависимости от дозы за фракцию, увеличивающейся на графике справа налево.
Рис. 1.33. Сводка изоэффективных кривых для повреждения нормальных тканей мыши при облучении фотонами в зависимости от дозы за фракцию для рано (пунктирные кривые) и поздно (сплошные кривые) реагирующих тканей. Число фракций увеличивается с уменьшением значения абсциссы [39]
Из рис. 1.33 видно, что для поздно реагирующих тканей изоэффективные кривые имеют тенденцию к более крутому подьему, чем для рано реагирующих тканей. Это означает, что поздно реагирующие ткани являются более чувствительными к изменению фракционной дозы. Положение кривых вдоль вертикальной оси покрывает широкий интервал доз и это отражает два главных фактора. Первое, некоторые ткани
90
