
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdf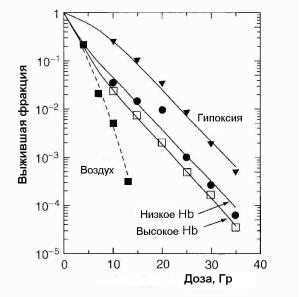
клеток. Причина такого поведения заключается в том, что однократная высокая доза истребляет аэрированные клетки и оставшиеся выжившие клетки почти все гипоксические.
Рис. 1.11. Зависимость доли выживших клеток EMT6 опухоли молочной железы мышей в различных условиях облучения [10]
3.9.2. Гипоксическая фракция
Термин «гипоксическая фракция» (ГФ) связан с относительной долей клоногенных клеток опухоли, радиочувствительность которых такая же, как у гипоксических клеток. На рис. 1.11 показан стандартный способ измерения ГФ. У животных, дышащих воздухом, кривая выживаемости имеет, как указывалось выше, два участка, отражающих радиочувствительность смеси аэрированных и гипоксических клеток. У убитых животных видна только гипоксическая компонента. Факт, что две кривых выживаемости являются параллельными, подтверждает, что обе характеризуют гипоксические клетки. Если на рис. 1.11 провести вертикальную линию через любую точку там, где кривые параллельны, то отношение (выживание для мышей, дышащих воздухом)/(выживание для убитых
мышей) дает ГФ в опухоли для мышей, дышащих воздухом. При-
41

мер, показанный на рис. 1.11, также иллюстрирует терапевтически важное заключение, что ГФ опухоли оказывается больше у пациентов, чья кровь имеет пониженное содержание гемоглобина. Курение уменьшает содержание кислорода в крови, поэтому оно настоятельно не рекомендуется для пациентов, проходящих лучевое лечение.
3.9.3. Реоксигинация
Временное изменение ГФ клеток в опухоли до и после облучения показано на рис. 1.12. Исследования показывают, что злокачественные узлы диаметром меньше 1 мм всегда оказываются полностью оксигенированными. При превышении этого значения ГФ начинает расти, достигая величины от 10 до 50 % от числа клоногенных клеток. Облучение опухоли приводит к уменьшению числа выживших как оксигенированных, так и гипоксических клеток, при этом доля гипоксических клеток будет неизбежно возрастать. Если же выполняется однократное облучение достаточно большой дозой, то ГФ может достигнуть 100 %.
Рис. 1.12. Временная зависимость гипоксической фракции в истории существования опухоли и реакции на облучение [5]
Термин реоксигенация обозначает процесс, при котором у пациентов улучшается снабжение гипоксических клеток кислородом. Клетки, будучи гипоксическими во время облучения в одном се-
42
ансе, могут стать оксигенированными в следующем сеансе. Реоксигенация изучалась с помощью измерения ГФ в разные моменты времени после облучения во многих экспериментальных исследованиях. Полученные результаты свидетельствуют, что у некоторых опухолей процесс реоксигенации происходит быстро. Величина ГФ падает со 100 до 10 % за одни сутки. У других опухолей процесс реоксигенации продолжается неделю и больше. Учитывая, что фракционная ЛТ продолжается обычно несколько недель, то влияние гипоксии представляет менее серьезную проблему для успеха лечения с помощью типового режима фракционирования ЛТ, чем вытекало из экспериментов на клеточном уровне. Однако при укороченных курсах лечения, как это имеет место, например в брахитерапии или радиохирургии, гипоксия может представлять важную проблему. В этом случае, если предварительные исследования указывают на наличие гипоксических клеток в опухоли, целесообразно применять радиосенсибилизаторы.
3.10. Радиочувствительность клеток в опухолях человека
3.10.1. Первоначальный наклон кривой выживаемости клеток
Клиническая ЛТ ставит перед радиобиологией следующие два ключевых вопроса: какова радиочувствительность клеток опухолей человека и как эта радиочувствительность связана с эффективностью клинического применения ЛТ. Первое обобщение по этому вопросам было опубликовано в 1981 г. [11]. Позднее подробный обзор данной проблемы был выполнен Диконом и др. [12]. Авторы проанализировали 17 различных гистопатологических типов новообразований и разделили их по радиочувствительности на пять групп:
•А: лимфома, миелома, нейробластома;
•B: медуллобластома, мелкоклеточный рак легкого;
•C: рак молочной железы, рак мочевого пузыря, шейная карцинома;
•D: рак поджелудочной железы, рак прямой кишки, сквамозный рак легкого;
43
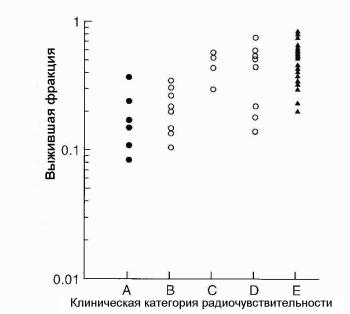
• E: меланома, остеосаркома, глиобластома, почечная карцинома.
Помещение определенного типа новообразования в конкретную группу достаточно условно, однако ранжирование опухолей на группы отражает клинический опыт.
Опубликованные in vitro данные для каждой клеточной линии были использованы для определения фракции выживших клеток после облучения дозой 2 Гр (SF2) [12], выбранной в качестве меры первоначального наклона кривых выживаемости клеток. Полученные результаты представлены на рис. 1.13. Внутри каждой группы наблюдается значительное рассеивание результатов, что неудивительно, учитывая, что исходные данные получены из разных источников и с помощью разной техники. Тем не менее распространено убеждение, что первоначальный наклон является важным фактором в клинической реакции опухоли на ЛТ.
Рис. 1.13. Фракции выживших клеток после облучения дозой 2 Гр для 51 клеточной линии опухолей человека, разделенные по клинической радиочувствительности на пять групп [12]
44
3.10.2. Кривые выживаемости клеток для опухолей человека
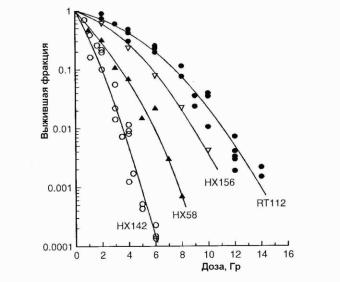
Кривые выживаемости (SF), иллюстрирующие диапазон радиочувствительности, обычно наблюдаемый среди различных клеточных линий опухолей человека, показан на рис. 1.14. Интервал доз, соответствующий выживанию 1 % клеток, изменяется на рисунке почти в три раза. Интервал крутизны первоначального наклона этих кривых еще шире. Сплошные линии на рисунке представляют собой аналитическую аппроксимацию данных линейноквадратичным уравнением:
SF exp(- D - D2 ), |
(1.7) |
где D – поглощенная доза ионизирующего излучения; α,β – эмпирические коэффициенты.
Рис. 1.14. Зависимости выживаемости клеток от поглощенной дозы для четырех клеточных линий опухолей человека: HX142 – нейробластома; HX58 – рак поджелудочной железы; HX156 – рак матки; RT112 – карцинома мочевого пузыря [13]
В литературе уравнение (1.7) получило название LQ-модель. Выделение в формуле (1.7) двух членов достаточно обосновано. Оно опирается на фундаментальный молекулярный механизм воз-
45
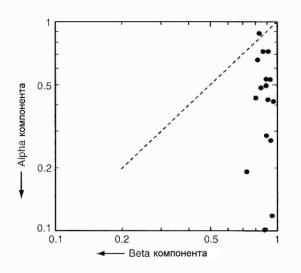
действия ионизирующего излучения на биообъекты. Линейная компонента [exp(-αD)] могла бы быть обусловлена однотрековыми (или одноударными) событиями, в то время как квадратичную компоненту [exp(-βD2)] можно связать с двухтрековыми (или многоударными) событиями. Такая интерпретация поддерживается результатами исследований эффекта мощности дозы, которые показывают, что при уменьшении мощности дозы кривая выживаемости приближается к прямой. Поэтому интересно сравнить вклад обоих членов в величину SF. Такие данные приводятся на рис. 1.15 для 17 клеточных линий опухолей человека при облучении стандартной фракционной дозой 2 Гр. Из рисунка видно, что различие в радиочувствительности разных клеточных линий практически целиком связано с линейной компонентой. Отсюда можно сделать вывод, что убийство клоногенных клеток при клинически реалистичной дозе за фракцию обусловлено линейной компонентой кривой выживаемости клеток. Всесторонний обзор механизмов унич-
тожения клоногенных клеток при лучевой терапии сделан в работе
[14].
Рис.1.15. Вклад в выжившую фракцию при облучении клеток стандартной дозой 2 Гр линейной и квадратичной компонент LQ-модели для 17 линий клеток человеческих опухолей. Пунктирная линия указывает равенство двух компонент [5]
46
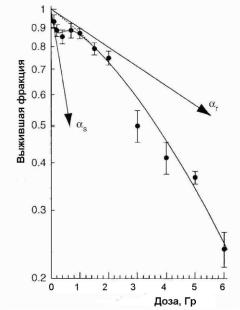
В настоящее время имеется много экспериментальных фактов, из которых следует, что аппроксимация кривых выживаемости
клеток линейно-квадратичным уравнением бывает неудовлетворительной в области доз D < 1 Гр. В качестве примера на рис. 1.16
приводится зависимость выживаемости клеток T98G глиобластомы человека от дозы [15]. Из рисунка видно, что клетки проявляют увеличенную радиочувствительность по сравнению с предсказанием LQ-модели при дозах до 1,0 Гр.
Рис. 1.16. Экспериментальные данные по зависимости выживаемости клеток глиобластомы человека от дозы. Сплошная линия – аппроксимация данных с помощью модели индуцированной репарации (англ. Induced Repair Model (IndRep)).
Параметры первоначального наклона обозначены для IndRep модели как αs и для LQ-модели как αr [15]
В работе [16] была предложена модификация LQ- модели, получившая название IndRep модель и неплохо описывающая экспериментальные данные. Модифицированная форма имеет вид:
SF exp r D 1 ( s / r 1) exp( D / Dc ) D2 , (1.8)
где Dc – доза, при которой начинается переход от гиперчувствительного поведения клеток к увеличенной радиорезистентности,
47
соответствующей LQ-модели. Отметим, что уравнение (1.8) переходит в (1.7) при D >> Dc.
Убедительного теоретического объяснения подобного поведения кривых выживаемости в области доз D < 1 Гр пока не существует. Так как повышенная радиочувствительность клеток в области небольших доз была открыта в экспериментах in vitro, то возникает еще один важный вопрос: имеет ли место этот эффект in vivo. В некоторых исследования с мышами был получен положительный ответ [16]. Если это подтвердится для человека, то потребуется пересмотр некоторых догм ЛТ.
3.11. Относительная биологическая эффективность ионизирующих излучений
3.11.1. Качество ионизирующего излучения
До настоящего раздела, рассматривая биологическое действие излучения, мы не делали различия между разными видами ионизирующего излучения. В какой-то мере это являлось оправданным в силу того, что современная дистанционная ЛТ в большинстве случаев имеет дело с гамма-излучением радионуклида 60Со и тормозным, и электронным излучением медицинских линейных ускорителей, а в брахитерапии применяются радионуклиды, испускающие гамма-излучение с энергией от 0,03 до 1,25 МэВ. По биологическому действию на единицу поглощенной дозы эти виды ионизирующего излучения являются близкими. Однако в ЛТ все шире начинают использоваться и другие виды ионизирующего излучения. В то же время экспериментальные исследования показывают, что при одинаковых значениях поглощенных доз воздействие разными видами излучений приводит к различным биологическим эффектам. Это свойство излучения называют качеством. С точки зрения качества все ионизирующие излучения, используемые в ЛТ, часто разделяют на три класса:
1) гамма-излучение радионуклидов, тормозное излучение, создаваемое в ЛУЭ, и электроны; 2) легкие частицы, включающие протоны, нейтроны и α- частицы;
48
3) тяжелые частицы, включающие ионы углерода, неона, кремния или аргона.
Для количественной оценки качества излучения введено понятие относительной биологической эффективности (ОБЭ, англ.
RBE). Эта величина определяется следующим образом: |
|
|||
ОБЭ |
доза от стандартно го излучения |
, |
(1.9) |
|
доза от тестируемого излучения |
||||
|
|
|
||
где обе величины дозы приводят к одинаковому биологическому эффекту. За стандартное излучение обычно берется 250 кВ рентгеновское излучение.
Одной из главных причин разницы в значениях ОБЭ является различие в линейной потере энергии (ЛПЭ, англ. LET). Под этой величиной понимается количество энергии, теряемой данным видом ионизирующего излучения на единицу пути в конкретном веществе (в ЛТ на единицу пути в биологической ткани). По величине ЛПЭ первый класс излучений относят к излучениям с низким ЛПЭ или редко ионизирующим (ЛПЭ ~ 1 кэВ/мкм). Для частиц второго и третьего классов величина ЛПЭ очень существенно за-
висит от энергии и вида частиц. Так для протонов с энергиями 1,0 и 200,0 МэВ ЛПЭ равняется, соответственно, 25,8 и 4,45 кэВ/мкм,
для α-частиц с энергиями 2,5 и 26,0 МэВ ЛПЭ равняется, соответственно, 165,0 и 25,0 кэВ/мкм. Частицы второго и третьего класса относят к частицам с высоким ЛПЭ или плотно ионизирующим. Кроме ЛПЭ, весьма важным параметром является также глубинное дозовое распределение конкретного излучения. Но эта проблема будет рассматриваться позднее, так же как и причина помещения во второй класс нейтронов, которые являются нейтральными частицами.
3.11.2. Микродозиметрический подход
Микродозиметрия – это раздел дозиметрии ионизирующих излучений, в котором учитываются флуктуации энергетических потерь излучения, имеющие место в малых объемах среды. С помощью микродозиметрических методов возможно восстановить микроскопическую картину событий ионизации, происходящих внутри наиболее чувствительной части клетки, а именно его ядра. На
49
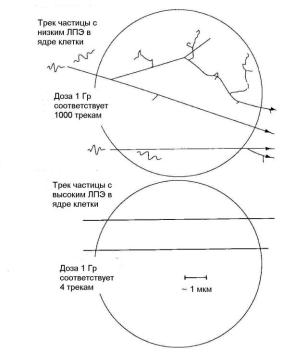
рис. 1.17 показан пример микродозиметрического расчета треков γ- кванта и α-частицы, проходящих через клеточное ядро, который
демонстрирует существенную разницу между ионизационными треками частиц с высоким и низким ЛПЭ [17,18].
Рис. 1.17. Структура треков частицы с низким (а) и высоким (б) ЛПЭ. Круги по размеру соответствуют размеру ядра типичной клетки млекопитающего [17]
В объеме ядра γ-квант передает значительную долю своей энергии в изолированных актах ионизации или возбуждения атомов. В результате большая часть повреждений ДНК эффективно репарируется ферментами. Поглощенная доза в 1 Гр, создаваемая гамма-излучением в объеме, равном ядру клетки, соответствует ~ 1000 электронных треков. В то же время такая же доза создается только четырьмя α-частицами, но плотность ионизации внутри их треков во много раз больше. Это ведет к значительно более суровому повреждению ДНК, так как подобная ионизация приводит к
50
