
Климанов Радиобиологическое и дозиметрическое планиров. Ч.1 2011
.pdfного утверждения, что «уничтожение 99 % клеток опухоли является полной неудачей лечения».
Таким образом, главным фактором, определяющим успех клинической ЛТ, следует считать величину дозы излучения. Низкие дозы являются неэффективными, если же имеется возможность дать очень высокую полную дозу, то, в принципе, любая опухоль может стать локально контролируемой. Между этими двумя экс-
тремальными случаями находится вероятность контроля над опу-
холью (англ. tumor control probability (TCP)), которая имеет сиг-
моидальную зависимость от дозы (см. рис. 1.25). Для любого конкретного злокачественного новообразования характеристики этой кривой являются решающими для успеха ЛТ. К таким характеристикам относятся положение кривой TCP на дозовой оси и крутизна кривой.
3.4.3. Проблема избирательности
Обозначим для удобства логарифм отношения первоначального количества клеток в облучаемом объеме (в случае опухоли это клоногенные клетки) к количеству этих клеток, выживших после ЛТ (или химиотерапии), через Klog. Как видно из предыдущего раздела, для получения локального контроля опухоли необходимо в результате лечения достичь больших значений Klog и при этом не превысить пределы толерантности критических нормальных тканей, которые находятся внутри или примыкают к области высокой дозы. Такая задача чрезвычайно сложна, потому что имеются органы, например тонкая кишка, которые выходят из строя (из-за образования язв на слизистой оболочке), если доля стволовых клеток становится меньше 1 %. Из этого вытекает, что значение Klog, равное Klog= 10 для клеток опухоли необходимо достигнуть, не превышая Klog≈ 2 для нормальных тканей. Другими словами, доза в опухоли должна быть в пять раз меньше, чем в радиочувствительной нормальной ткани.
Лучевая терапия прошла длинный путь, прежде чем с помощью физических методов стало возможным достигать такую фокусировку излучения в области мишени и выводить из районов высо-
кой дозы большую часть объема критических органов (КО, англ. organ a risk (OAR)). Без этого ЛТ почти всегда была бы неуспеш-
31
ной. Между прочим, аналогичная проблема является серьезным препятствием для успеха химиотерапии. При планомерном лечении такие КО, как костный мозг и кишечник, получают полную дозу лекарственных препаратов и успех приходит только тогда, когда (это редкий случай) препараты обладают высоким уровнем избирательности именно для уничтожения клеток опухоли.
3.5.Причины гибели облученных клеток
Втечение химической фазы (см. раздел 2) повреждаются все компоненты клеток: белки, ферменты, мембранные компоненты и др. Однако такие молекулы представлены в клетке в большом количестве, и повреждение некоторых из них оказывает слабое влияние на жизнеспособность клетки. Они быстро регенерируются. Но
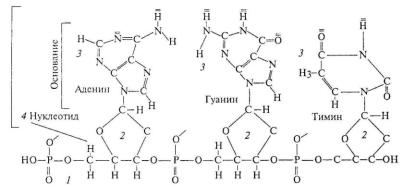
вклетке имеется уникальная компонента, а именно ДНК. ДНК представляет собой молекулу в виде очень длинной двойной спирали, которая состоит из повторяющихся звеньев, образуемых дезоксирибизой (относящейся в химическом плане к сахарам) и фос-
форной кислоты. Звенья соединены между собой эфирными связями, образуя так называемый сахарно-фосфатный скелет (рис. 1.6).
Рис. 1.6. Строение одной из двух нитей ДНК: 1 – сахарно-фосфатный скелет; 2 – пятичленный сахар (дозоксирибоза); 3 – основание (здесь аденин); 4 – нуклеотид (здесь дезоксиаденозин) [4]
К каждому кольцу дезоксирибозы прикреплено одно из четырех оснований (аденин или гуанин, тимин или цитозин), образуя нуклеозид. Общая длина всех молекул ДНК в клетке человека со-
32
ставляет ~ 2 м. ДНК распределены по 46 хромосомам, каждая из которых содержит одну молекулу ДНК, чья длина в зависимости от размера хромосомы варьируется от 1,7 до 8,5 мм. В клетке различные участки ДНК одной молекулы находятся очень близко друг к другу из-за многократного сворачивания ДНК в структуры все большего диаметра. Группы оснований формируют гены, которые содержат инструкции для белков и, таким образом, для всех аспектов функционирования клетки.
В результате прямой ионизации самой молекулы ДНК и ее атаки свободными радикалами происходит разрыв химических связей между атомами. Разрыв одной из нитей называют одиночным разрывом. Совпадение разрывов противоположных нитей ДНК в одной точке приводит к появлению двойных разрывов. Интересно, что одиночные разрывы возникают в клетке в нормальных условиях и без всякой связи с облучением в результате теплового движения молекул, окислительных процессов и др. При дозе ионизирующего излучения в 1 Гр в ядре каждой клетки создается около 2 × 105 ионизаций, приводящих к ~ 1000 одиночных разрывов ДНК, 40 двойных разрывов и повреждению ~ 500 оснований. Однако в клетке существует специальный ферментативный механизм, который непрерывно мониторирует целостность ДНК, распознает повреждения и успешно репарирует подавляющую часть разрывов. Репарационные процессы настолько эффективны, что, несмотря на все повреждения, большая часть клеток выживает.
Двойные разрывы репарируются значительно хуже, чем одиночные. Кроме того, репарация не всегда заканчивается восстановлением исходной молекулы. Например, вместо воссоединения разорванной связи может возникнуть связь между свободными концами двух противоположных нитей молекулы ДНК, между свободными концами в местах разных разрывов одной и той же нити ДНК и даже между свободными концами разных молекул ДНК. Неправильное воссоединение разрывов приводит к возникновению хромосомных аберраций.
Неверная репарация сахарно-фосфатного скелета и оснований, а также их химическая модификация препятствует считыванию с нее генетической информации, а также нормальной репликации ДНК и последующему распределению генетического материала между клетками при их делении. Таким образом, радиационные повреж-
33
дения ДНК могут привести к потере (или модификации) некоторых генов и, следовательно, к потере специфических функций, часть из которых может быть существенной для выживания клетки. Все это является причиной, почему ДНК считается наиболее уязвимой частью клетки по отношению к радиационному повреждению.
Прямое доказательство того, что именно повреждение ДНК в большинстве случаев является критическим событием для выживания клетки, вытекает из экспериментов с изотопами, испускающими короткопробежные оже-частицы. Когда эти изотопы встраивались в структуру ДНК, они оказывались намного более токсичными, чем когда они находились в других частях клетки.
После фатального повреждения излучением большинство клеток не умирает немедленно; после дозозависимой задержки в реализации клеточного цикла клетка обычно вступает в фазу митоза. Поврежденным клеткам часто не удается полностью завершить митоз или они проходят далее через один или несколько клеточных циклов, прежде чем увязнуть в очередном делении (см. рис. 1.2). Вместе с тем существуют некоторые виды клеток, например лимфоциты, которые погибают, не доходя до митоза. Это явление называют интермитозной гибелью клетки. Оно тесно связано с процессом, который называют программируемой смертью клетки или апоптозом.
3.6. Восстановление клеток после радиационных повреждений
Процессы восстановления клеток и тканей после радиационного облучения имеют важнейшее значение для клинического применения ЛТ. Для их изучения был разработан ряд экспериментальных методов.
1. Эксперименты с расщеплением дозы на две фракции. Эффект воздействия конкретной величины дозы оказывается меньше, если она расщепляется на две фракции, которые подводятся с промежутком в несколько часов. Эффект получил название «сублетальное поражение» (англ. SLD). Почти все клетки показывают этот эффект. Причина эффекта в том, что после первого облучения запускается репарационный механизм, и если дать достаточно времени перед вторым облучением, то этот механизм позволяет клет-
34
ке подготовиться ко второму облучению. Если же обе фракции даются одновременно, то клетка получает летальное повреждение.
2.Эксперименты с отложенным посевом. Если клетка облуча-
ется в нерастущем состоянии (состоянии покоя) и оставляется в
том же состоянии возрастающие периоды времени перед тестом на выживаемость, то часто наблюдается увеличение выживаемости.
Эффект получил название «потенциально летальное поражение» (англ. PLD). Разумное объяснение эффекту заключается в том, что тест инициирует пролиферацию клеток и клетки, которые вовлекаются в репликацию, используя нерепарированный геном, с большой вероятностью умрут. Кинетики PLD восстановления и SLD восстановления являются сходными.
3.Эксперименты с изменением мощности дозы. Уменьшение радиационного поражения клеток при уменьшении мощности дозы ниже 1 Гр/ч связано, в основном, с восстановлением клетки. Эффект объясняется увеличением временного интервала между последующими случайными событиями повреждения клетки ионизирующими частицами с уменьшением мощности дозы. За это время
вклетке успевает запуститься механизм репарации повреждений. Ситуация похожа на эффект расщепления дозы.
4.Эксперименты с разделением на много фракций. Эффект смягчения лучевого поражения при фракционировании облучения
впределах относительно короткого общего времени обусловлен процессами восстановления. При ежедневных фракциях с перерывами между ними в 24 часа проявляется механизм репарации повреждений. Этим объясняется, почему в клинической радиотерапии полная доза, требуемая для контроля опухоли, должна увеличиваться при увеличении числа фракций.
Скорость клеточного восстановления измерялась для многих видов клеток и тканей. Было найдено, что это многокомпонентный процесс, описываемый суммой показательных функций. Первая компонента имеет полупериод в несколько минут, основная компонента – около 1 ч, наблюдаются также более медленные компоненты. Клиническое применение этого факта состоит в том, что когда ЛТ проводится в режиме нескольких фракций в день, то необходимо обеспечить полное восстановление между фракциями. Это требует, чтобы временной интервал между фракциями был не меньше 6 часов.
35
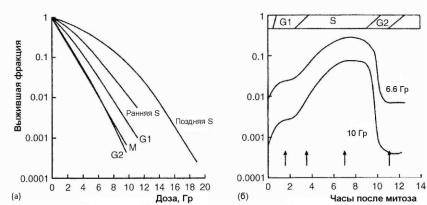
3.7. Радиочувствительность клеток на разных стадиях клеточного цикла
Жизнь клетки принято разделять на четыре фазы: рождение при митозе, период синтеза ДНК, известный как S-фаза, ей предшествует G1-фаза, и за S-фазой следует G2-фаза. Радиочувствительность клеток существенно изменяется по мере прохождения ими клеточного цикла (рис. 1.7). Наиболее радиорезистентной клетка является в S-фазе, особенно в ее конце, и наиболее радиочувствительной в G2-фазе и во время митоза. Как видно из рис. 1.7, выжившая фракция клеток китайского хомячка на разных стадиях цикла изменяется почти в 100 раз.
Рис. 1.7. Зависимость выживания клеток от дозы на разных стадиях клеточного цикла (a) и от времени после митоза (б) [6]
Радиорезистентность клеток в S-фазе можно объяснить конформацией ДНК в этот период времени. Высокая чувствительность в G2-фазе вероятно связана с тем, что у клеток остается мало времени для репарации радиационных повреждений перед переходом клеток к делению.
При дозах, обычно используемых в ЛТ, радиочувствительность клеток в разных фазах цикла согласно [4] отличается в 2-3 раза. Однако практическое применение рассматриваемого эффекта в медицине затруднено необходимостью обеспечить достаточно высокую синхронизацию циклов клеток. Интересно отметить, что облу-
36
чение в какой-то мере само выступает в качестве синхронизатора, так как сразу после облучения популяция обогащается радиорезистентными клоногенными клетками, находящимися, в основном, в S-фазе. Если клеткам дать соответствующее время для перехода из радиорезистентного состояния в более радиочувствительное (из S-фазы в G2-фазу), то эффект от второго облучения в данный мо-
мент будет сильнее. Этот процесс называется перераспределением или пересортировкой (англ. reassortment).
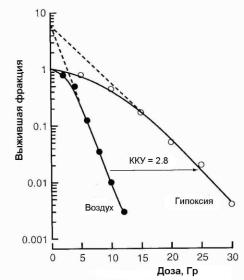
Рис. 1.8. Зависимости выживаемости клеток млекопитающего в культуре от дозы при облучении в воздухе и в условиях гипоксии. Пунктирные линии представляют экстраполяцию к нулевой дозе [5]
3.8. Кислородный эффект
Кислород является одним из наиболее сильных модификаторов радиочувствительности клеток. На рис. 1.8 показаны зависимости выживаемости клеток млекопитающего в культуре от дозы при облучении в нормальных и гипоксических условиях. Гипоксия достигалась с помощью пропускания азота через клеточную суспензию в течение 15 – 30 мин. Усиление радиационного поражения кислородом приводит к модификации дозы, т.е. изоэффективная
доза уменьшается на всех уровнях выживаемости. Этот факт по-
37
зволяет ввести и рассчитать коэффициент кислородного усиления (ККУ, англ. OER), который представляет отношение радиационных доз в условиях гипоксии и в воздухе, приводящие к одинаковым биологическим эффектам.
Для большинства клеток ККУ для тормозного излучения приблизительно равен 3,0. Однако некоторые исследования обнаружили понижение ККУ в рамках линейно-квадратичной модели для одноударного механизма повреждения клетки по сравнению с механизмом двойного удара, что приводит к фактическому уменьшению ККУ при дозах D ≤ 3 Гр. Это является важным фактом, так как данный диапазон доз используется во фракционной ЛТ.
Важной особенностью кислородного усиления является то, что кислород должен присутствовать в клетке в момент облучения или в пределах нескольких миллисекунд после облучения. Это свидетельствует о том, что эффект связан с модифицирующим воздействием кислорода на свободные радикалы, приводящим к фиксированию повреждений.
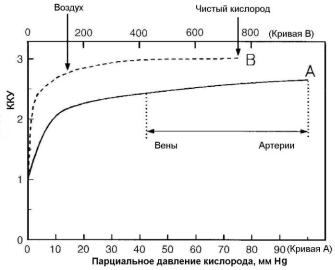
Рис.1.9. Изменение ККУ в зависимости от парциального давления кислорода. Пунктирная кривая связана с масштабом на верхней шкале [7]
38
Сенсибилизирующий эффект кислорода является следствием его высокого сродства к электрону (окислительной активности), благодаря которому он легко присоединяется к макромолекулам ДНК в местах разрыва межатомных связей, вызванных ионизацией. Присоединение кислорода снижает эффективность работы систем репарации ДНК [4]. Величина ККУ зависит от давления кислорода (рис. 1.9). По определению, ККУ в условиях полной гипоксии равен 1,0. С повышением парциального давления кислорода наблюдается соответствующее увеличение радиочувствительности клеток. Наибольшая скорость нарастания ККУ имеет место от 0 до 20 мм рт. ст. Дальнейший рост давления приводит к небольшому повышению ККУ. На рис. 1.9 показано также давление кислорода в венозной и артериальной крови. Эти данные свидетельствуют, что нормальные ткани человека можно считать хорошо оксигенированными.
3.9. Гипоксия в опухоли
3.9.1. Причина появления в опухоли гипоксических клеток
Кислород играет важную роль в ответной реакции опухоли на облучение. Клетки опухоли растут быстрее питающей их сосудистой сети, поэтому в плотной опухоли развиваются районы с недостаточными питанием и обеспечением кислородом. Однако гипоксичекие клетки в этих областях еще могут оставаться жизнеспособными. При дальнейшем росте опухоли в ее центре могут появиться области с практически полным отсутствием капилляров, что приводит к развитию зон асептического некроза.
Первое упоминание о том, что в опухоли возможно развитие гипоксии, появилось в 1955 г. в работе [8]. Авторы взяли гистологические срезы свежих препаратов карциномы легких человека и наблюдали жизнеспособные районы опухоли, окруженные сосудистой стромой, из которой клетки опухоли получали питание и кислород. При расширении этих районов в их центре появлялись некротические области (рис. 1.10). Толщина результирующих цилиндрических ячеек жизнеспособной опухоли оказалась сравнимой с расчетной величиной длины диффузии кислорода в нормально дышащих тканях. Таким образом, клетки, находящиеся за преде-
39
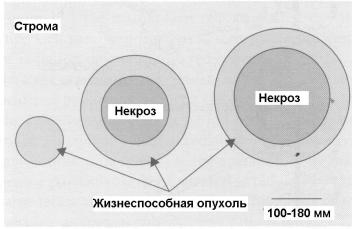
лами области диффузии кислорода, не способны выжить, в то время как клетки, расположенные в пограничных районах, остаются жизнеспособными, но при этом становятся гипоксическими.
Рис.1.10. Схематическое представление развития микроскопических районов некроза в растущих опухолях
Так как гипоксические клетки обладают высокой радиорезистентностью, их присутствие в опухоли имеет определяющее значение в ответной реакции опухолей на облучение высокими дозами. Наличие таких клеток в экспериментальных опухолях наглядно демонстрируется на рис. 1.11, где показаны кривые выживаемости клеток EMT6 опухоли молочной железы мышей в различных условиях облучения: а) суспензия в виде монослоя из одиночных клеток в аэрированной среде; б) облучение клеток in situ внутри мышей, дышащих воздухом и имеющих высокий и низкий уровень гемоглобина (Hb); в) облучение клеток in situ внутри мышей, погибших от замены воздуха азотом. Выживаемость клеток измерялась сразу после облучения с помощью теста in vitro. Характерная особенность кривых выживания для мышей, дышащих воздухом, заключается в наличии двух участков. На первом участке до дозы D < 5 Гр эти кривые совпадают с кривой для клеток в суспензии, находящихся в аэрированной среде. На втором участке, где D > 5 Гр, кривые становятся параллельными кривой для гипоксийных
40
