
- •Основные понятия химии. Классы неорганических соединений
- •Cодержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные положения атомно-молекулярной теории
- •Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
- •1.2 Химический эквивалент
- •1Моль Са(он)2 2 эквивалента
- •1/2 Са(он)2 1 эквивалент
- •1). Определить степень окисления элемента образующего оксид.
- •2). По формуле оксида определить число атомов элемента образующего оксид и число атомов кислорода.
- •3). Определить молярную массу оксида:
- •5). Для других сложных веществ:
- •1.3 Степень окисления
- •Номер группы, в которой находится элемент, минус 8.
- •Примеры: а) Вычислить степень окисления хрома в хромовой кислоте h2CrO4 .
- •1.4 Химические реакции. Уравнения химических реакций
- •Классификация химических реакций
- •Вопросы и задачи для самоконтроля
- •1.5 Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
- •2 Классы неорганических соединений
- •Простые вещества;
- •2.1 Оксиды
- •2.1.1 Основные оксиды
- •Химические свойства основных оксидов
- •2.1.2 Кислотные оксиды
- •Химические свойства кислотных оксидов
- •2.1.3 Амфотерные оксиды
- •Химические свойства амфотерных оксидов
- •2.2 Гидроксиды
- •2.2.1 Основания
- •Номенклатура (название) оснований:
- •Получение оснований
- •Получение труднорастворимых оснований
- •Химические свойства оснований
- •2.2.2 Кислородные кислоты
- •Номенклатура (название) кислот
- •Получение кислот
- •Химические свойства кислот
- •2.2.3 Амфотерные гидроксиды
- •Получение амфотерных гидроксидов
- •Химические свойства амфотерных гидроксидов
- •2.3 Соли
- •2.3.1 Средние (или нормальные) соли
- •Номенклатура (название) средних солей
- •Способы получения средних солей
- •Химические свойства средних солей
- •2.3.2 Кислые соли
- •Номенклатура (название) кислых солей
- •Способы получения кислых солей
- •Химические свойства кислых солей
- •2.3.3 Основные соли
- •Номенклатура (название) основных солей
- •Способы получения основных солей
- •Химические свойства основных солей
- •2.3.4 Двойные соли
- •2.3.5 Смешанные соли
- •2.3.6 Комплексные соли
- •Рассмотрим состав комплексных солей:
- •Названия электронейтральных комплексов:
- •2.4 Бинарные соединения
- •2.5 Генетическая связь между классами неорганических соединений
- •2.6 Лабораторные работы
- •2.6.1 Техника безопасности и основные требования при работе в химической лаборатории
- •При возникновении несчастных случаев сразу же поставить в известность преподавателя или лаборанта обслуживающего лабораторную работу.
- •2.6.2 Вопросы для рассмотрения основных понятий и определений
- •2.6.3 Получение оксидов и определение их свойств
- •2.6.4 Получение амфотерных гидроксидов и определение их свойств
- •2.6.5 Получение солей и их свойства
- •2.6.6 Вопросы и задачи для практического занятия
- •2.7 Вопросы и задачи для самостоятельной работы
- •2.8 Входной тестовый контроль Вариант № 1
- •Выберите правильный ответ:
- •1) Основным оксидам; 3) амфотерным оксидам;
- •2) Кислотным оксидам; 4) безразличным оксидам.
- •Вариант № 2
- •Выберите правильный ответ:
- •Вариант № 3
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства сильных электролитов.
- •Вариант № 4
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства безразличного оксида.
- •2.9 Задания для контрольной работы
- •1. Назовите перечисленные ниже соединения Вариант:
- •2. Составьте молекулярные и ионные уравнения, характеризующие способы получения и свойства соединений Вариант:
- •Вариант:
- •4. Составьте уравнения всех возможных реакций, протекающих между веществами Вариант:
- •5. Осуществите следующие превращения Вариант:
- •Темы реферативных работ
- •Рекомендуемая литература Основная литература:
- •Дополнительная литература:
- •Список использованных источников
- •Периодическая система химических элементов д.И. Менделеева
- •Ряд стандартных электродных потенциалов (ряд активности металлов)
- •Меры первой помощи при возможных несчастных случаях при выполнении лабораторной работы
- •Термины и определения в химии (номенклатура неорганических соединений июпак) (глоссарий)
- •Основные понятия химии. Классы неорганических соединений
- •426069, Г. Ижевск, ул. Студенческая, 11
2.6.6 Вопросы и задачи для практического занятия
№ 1
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: KMnO4; NaHS; Cu(OH)Cl; Zn(OH)2; H2CO3; CO; Mn(OH)3; Fe2O3; H2MnO4. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства оксида углерода (ΙV).
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:



S

 → CuS → SO2
↔ H2SO3
→ KHSO3
→ K2SO3
→ K2SO4
→ BaSO4
→ CuS → SO2
↔ H2SO3
→ KHSO3
→ K2SO3
→ K2SO4
→ BaSO4
 ________________H2SO4
________________H2SO4
№ 2
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: Cu2O; HMnO4; Zn(OH)Cl; FeCl3; Pb(OH)2; NH4OH; CO2; H2SO4; KHCO3. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства NaHCO3.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:

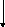





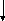 FeCI2
→ Fe(OH)Cl → Fe(OH)2
FeCI2
→ Fe(OH)Cl → Fe(OH)2
F eO
↔ Fe →
eO
↔ Fe →


 FeCl3
→ Fe(OH)Cl2
→ Fe(OH)3
FeCl3
→ Fe(OH)Cl2
→ Fe(OH)3

№

 3
3
1. Из приведенного списка соединений выберите: а) оксиды; б) основания;
в) кислоты; г) соли: H2S; Sn(OH)2; CuO; KH2PO4; AlCl3; Fe(OH)3; SO3; KOH; H2CO3. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства КОH.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:




N
 H4Cl
↔ NH3
→ NO → NO2
→ HNO2
→ KNO2
↔ KNO3
→ HNO3
→ Cu(NO3)2
H4Cl
↔ NH3
→ NO → NO2
→ HNO2
→ KNO2
↔ KNO3
→ HNO3
→ Cu(NO3)2

№ 4
1. Из приведенного списка соединений выберите: а) основные оксиды;
б) гидроксиды; в) кислые соли; г) бинарные соединения: (CaOH)2CO3; PbO; KH2PO4; MnO; KOH; H2S; HClO; Ba(HCO3)2; NH3; CrO; K2H2SiO4; Fe(OH)2; CO2. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства оксида алюминия (ΙΙΙ).
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:



CuS → CuO → Cu → CuSO4 → Cu(OH)2 → CuOHCl → CuCl2 ↔ [Cu(NH3)4]Cl2





K2[Cu(OH)4] CuI
№ 5
1. Из приведенного списка соединений выберите: а) кислородные кислоты;
б) амфотерные оксиды; в) основные соли; г) щелочи: H2S; HClO2; KOH; H2SO4; (CaOH)2CO3; PbO; K2HPO4; MnO; NH3; Cr2O3; FeOHCl; CO; NH4OH. Назовите соединения. Составьте уравнения реакций, характеризующих способы получения и свойства разбавленной азотной кислоты.
2. Составьте уравнения реакций, протекающих в следующем ряду превращений:

 KCl
→AgCl→
[Ag(NH3)2]Cl→
NH4NO3→NH3
→ [Zn(NH3)4]Cl2
KCl
→AgCl→
[Ag(NH3)2]Cl→
NH4NO3→NH3
→ [Zn(NH3)4]Cl2
 KCl
→Cl2→
KClO
→ I2
→ KI3
KCl
→Cl2→
KClO
→ I2
→ KI3
 KClO3
→ O2.
KClO3
→ O2.
2.7 Вопросы и задачи для самостоятельной работы
1. Составьте формулы оксидов лития, кальция, алюминия, кремния,
азота (V), серы (VI), хлора (VII), хрома (VI), железа (II), железа (III), азота (II), азота (I) и укажите, к какому типу оксидов они относятся?
2. Дайте химические названия оксидов: B2O3, K2O, CrO3, CrO, P2O5, Cu2O, PbO2, NiO, CO2, Ag2O.
3. Сравните химические свойства оксидов:
а) CO и CO2 б) Na2O и MgO в) FeO и Fe2O3
Ответ подтвердите составлением соответствующих уравнений реакций.
4. Какие кислоты соответствуют следующим кислотным оксидам: SiO2, P2O5, N2O5, N2O3?
5. Приведите примеры бескислородных и кислородных кислот. Дайте химические названия следующих кислот:
HCl, H2CO3, H2CrO4, H2SO3, H2SiO3, H2S.
6. С какими из указанных веществ будет реагировать серная кислота:
Ca(OH)2, CO2, K2O, BaCl, Cu(NO3)2, H3PO4, Fe2O3?
Составьте уравнения протекающих реакций.
7. Укажите, какие из указанных оснований являются растворимыми, а какие – труднорастворимыми в воде: KOH, Ba(OH)2, Al(OH)3, Mg(OH)2, Fe(OH)2, Cr(OH)3, NH4OH, Zn(OH)2. Какие основания называются щелочами? Какие из указанных оснований к ним относятся?
8. Напишите уравнения реакций получения NаОН, Ba(OH)2, исходя:
1) из металлов натрия и бария;
2) из их оксидов.
9. Составьте уравнения реакций между соответствующими кислотами и основаниями (или амфотерными гидроксидами), приводящие к образованию следующих солей:
PbI2, KHCO3, CaHPO4, MgSO4, AlOHCl2, (MgOH)2CO3.
10. Составьте уравнения перевода нижеследующих кислых солей в средние: Mg(HCO3)2, K2HPO4, KH2PO4, NaHS.
11. Как перевести основные соли в средние соли:
CuOHCl, FeOHNO3, MgOHBr, Al(OH)2Cl? Напишите уравнения реакций.
12. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) BaO → Ba(OН)2 → BaCl2 → Ba(NO3)2 → BaSO4 → H2[Ba(SO4)2],
б) Fe → Fe2O3 → FeCl3 → Fe(NO3)3 → Fe(OH)3 → Fe2O3 → NaFeO2,
в) Cu ← CuO → CuSO4 → Cu(OH)2 → CuО → K2CuO2 → CuСl2,
г) K → KOH → KHS → K2S → FeS → SO2 → KHSO3,
д
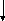 )
CaO → CaCl2
)
CaO → CaCl2
C
 a
a
Ca(OH)2 → Ca(NO3)2.
13. Напишите полные и краткие ионные уравнения следующих реакций:
а) Ca(NO3)2 + K2CO3 → CaCO3 + 2KNO3,
б) 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O,
в) Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3,
г) K2CO3 + 2HCl → 2KCl + H2O + CO2,
д) Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2,
е) 2NaOH + Fe(NO3)2 → Fe(OH)2 + 2NaNO3,
ж) Pb(NO3)2 + K2SO4 → PbSO4 + 2KNO3,
з) Na2SiO3 + Ba(OH)2 → BaSiO3 + 2NaOH,
и) FeCl3 + 3CsOH → Fe(OH)3 + 3CsCl,
к) 3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4.
14. Составьте молекулярные и ионные уравнения реакций между веществами:
|
a) KOH и MgCl2, |
е) Pb(OH)2 и HNO3, |
|
б) NaOH и H2SO3, |
ж) Na2SO4 и BaCl2, |
|
в) K2S и HCl, |
и) Na2CO3 и HCl, |
|
г) CH3COOК и H2SO4, |
к) H2SiO3 и KOH, |
|
д) KHCO3 и H2SO4, |
л) Fe(OH)Cl и HNO3. |
15. Составьте молекулярные уравнения реакций по кратким ионным уравнениям:
|
а)
|
е)
|
|
б)
|
ж)
|
|
в)
|
и)
|
|
г)
|
к)
|
|
д)
|
л)
|
16. Закончите уравнения реакций: Напишите в молекулярной и ионной форме уравнения реакций:
|
1) CO2 + NaOH → _________________, |
6) CaCl2 + Na2CO3 → ______________, |
|
2) P2O5 + NaOH → ________________, |
7) Pb(NO3)2 + 2KI → _______________, |
|
3) HNO2 + O2 → __________________, |
8) BaCl2 + Na2CrO4 → _____________, |
|
4) MnCl2 + Na2S → ________________, |
9) KH2PO4 + HCl → _______________, |
|
5) H3PO4 + 3NaOH → ______________, |
10) Fe(OH)Cl2 + KOH → ___________. |
17. Определите тип солей и дайте им названия:
Na3PO4; FeCl2; Na2HPO4; FeOHCl; NaH2PO4; Fe(OH)2NO3; Na2CO3; (CuOH)2CO3; NaHCO3; NiSO4; PbI2; NaHS; Cr2S3; K4[Fe(CN)6]; [Al(OH2)6]Cl3.
18. Напишите формулы солей: сульфат калия; гидросульфат натрия; метасиликат натрия; гидроксохлорид цинка; гидроксокарбонат магния; сульфат алюминия; гидроксосульфат алюминия; сульфат аммония железа (ΙΙΙ).
19. Составьте уравнения реакций, протекающих в следующей цепи превращений:
 K[Fe(OH)4]
K[Fe(OH)4]
↑
Fe → FeCl3 → Fe(OH)Cl2 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → FeSO4 → Fe.
20. Амфотерность указанных ниже гидроксидов проявляется в том, что они:
|
1) гидроксида бериллия |
а) взаимодействуют с растворами щелочей |
|
2) гидроксида цинка |
б) при прокаливании превращаются в амфотерные оксиды |
|
3) гидроксида алюминия |
в) взаимодействуют с растворами кислот и щелочей |
|
4) гидроксида олова (ΙΙ) |
г) взаимодействуют с растворами кислот |
|
5) гидроксида свинца (ΙΙ) |
д) растворяются в воде |
|
6) гидроксида хрома (ΙΙΙ) |
е) проявляют кислотные свойства |
|
7) гидроксида меди (ΙΙ) |
|
|
8) гидроксида железа (ΙΙΙ) |
|
|
9) гидроксида титана (ΙV) |
|
|
10) гидроксида марганца (ΙV) |
|
21. Напишите уравнения диссоциации электролитов:
|
1) H3BO3; Be(OH)2; Cu(OH)Cl, |
6) H2CO3; Al(OH)3; KHCO3, |
|
2) H3PO4; KH2PO4; Ca(OH)2, |
7) H4SiO4; Na2HPO4; Ni(OH)2, |
|
3) Ba(OH)2; H2S; MgOHCl, |
8) KHS; NaHSO3; H2SO4, |
|
4) Mn(OH)2; H2CO3; KHCO3, |
9) CuCl2; CuOHCl; Fe(OH)3, |
|
5) KH2PO4; H2S; Fe(OH)3, |
10) Al(OH)2Cl; K2HPO4; H3BO3. |
22. Вычислите эквивалент кислот и оснований в следующих уравнениях реакций:
1) H2SO4 + KOH → KHSO4 + H2O,
2) H2SO4 + Ca(OH)2 → CaSO4 + 2H2O,
3) Al(OH)3 + HCl → Al(OH)2Cl + H2O,
4) Al(OH)3 + H2SO4 → Al(OH)SO4 + 2H2O,
5) Al(OH)3 + H3PO4 → AlPO4 + 3H2O,
6) H3PO4 + Ba(OH)2 → BaHPO4 + 2H2O,
7) H3PO4 + KOH → KH2PO4 + H2O,
8) Mg(OH)2 + HNO3 → Mg(OH)NO3 + H2O,
9) Mg(OH)2 + H2CO3 → MgCO3 + 2H2O,
10) Fe(OH)3 + 2HNO3 → Fe(OH)(NO3)2 + 2H2O.
