
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
4.3. Гидроксиды
Среди многоэлементных соединений важную группу составляют гидроксиды – сложные вещества, содержащие гидроксогруппы OH. Некоторые из них (основные гидроксиды) проявляют свойства оснований - NaOH, Ba(OH)2 и т.п.; другие (кислотные гидроксиды) проявляют свойства кислот – HNO3, H3PO4, и др.; существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства - Zn(OH)2, Al(OH)3 и др.
Свойства и характер гидроксидов также находятся в зависимости от заряда ядра центрального атома (условное обозначение Э) и его радиуса, т.е. от прочности и полярности связей Э – О и О – Н.
Если энергия связи EO - H EЭ - О, то диссоциация гидроксида протекает по кислотному типу , т. е. разрушается связь О –Н.
ЭОН ЭО- + H+
Если EO-H EЭ – O, то диссоциация гидроксида протекает по основному типу , т. е. разрушается связь Э - O
ЭOH Э+ + OH-
Если энергии связей O – H и Э – О близки или равны, то диссоциация гидроксида может протекать одновременно по обоим направлениям. В этом случае речь идет об амфотерных гидроксидах :
Эn+ + nOH- Э(OH)n = HnЭOn nH+ + ЭОnn-
В соответствии с изменением химической природы элементов в периодической системе элементов закономерно изменяется кислотно-основная активность их гидроксидов: от основных гидроксидов через амфотерные к кислотным. Например, для высших гидроксидов элементов 3 периода:
NaOH, Mg(OH)2 – основания (слева направо основные свойства ослабевают);
Al(OH)3 – амфотерный гидроксид;
H2SiO3, H3PO4, H2SO4, HСlO4 – кислоты (слева направо сила кислот увеличивается).
Гидроксиды металлов относятся к основаниям. Чем ярче выражены металлические свойства элемента, тем сильнее выражены основные свойства соответствующего гидроксида металла в высшей с.о. Гидроксиды неметаллов проявляют кислотные свойства. Чем ярче выражены неметаллические свойства элемента, тем сильнее кислотные свойства соответствующего гидроксида.
4.4. Кислоты
Кислоты – это вещества, диссоциирующие в растворах с образованием катионов водорода и анионов кислотного остатка (с позиций теории электролитической диссоциации).
Кислоты классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по основности (по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли – на одноосновные, двухосновные, трехосновные), по наличию или отсутствию кислорода в составе кислоты (на кислородсодержащие и бескислородные). Например, азотная кислота HNO3 – сильная, одноосновная, кислородсодержащая кислота; сероводородная кислота H2S – слабая, двухосновная, бескислородная кислота.
Химические свойства кислот:
Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + Cu (OH)2 = CuSO4 + 2H2O.
Взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HNO3 + MgO = Mg(NO3)2 + H2O,
H2SO4 + ZnO = ZnSO4 + H2O.
Взаимодействие с металлами. Металлы, стоящие в “Ряду напряжений” до водорода, вытесняют водород из растворов кислот (кроме азотной и концентрированной серной кислот); при этом образуется соль:
Zn + 2HCl =ZnCl2 + H2 .
Металлы, находящиеся в “Ряду напряжений” после водорода, водород из растворов кислот не вытесняют
Cu + 2HCl ≠.
Взаимодействие металлов с азотной и концентрированной серной кислотами см. в разделе 11.
Некоторые кислоты при нагревании разлагаются:
H2SiO3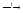
 H2O
+ SiO2.
H2O
+ SiO2.
Менее летучие кислоты вытесняют более летучие кислоты из их солей:
H2SO4конц + NaClтв = NaHSO4 + HCl↑.
Более сильные кислоты вытесняют менее сильные кислоты из растворов их солей:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
Номенклатура кислот. Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN – циан, CNS – родан) суффикс -о-, окончание водородная и слово “кислота”. Например, HCl – хлороводородная кислота, H2S – сероводородная кислота, HCN – циановодородная кислота.
Названия кислородосодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением соответствующих суффиксов, окончаний и слова “кислота”. При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на -ная или -овая; например, H2SO4 – серная кислота, HClO4 – хлорная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая (HClO3 - хлорноватая кислота), истая (HClO2 - хлористая кислота), -оватистая (HClO - хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее более низкой степени окисления элемента, имеет окончание истая (HNO3 – азотная кислота, HNO2 – азотистая кислота).
В некоторых случаях к одной молекуле оксида может присоединиться различное количество молекул воды (т.е. элемент в одной и той же степени окисления образует несколько кислот, содержащих по одному атому данного элемента). Тогда кислоту с большим содержанием воды обозначают приставкой орто- , а кислоту с меньшим числом молекул воды обозначают приставкоймета- . Например :
P2O5 + H2O = 2HPO3 - метафосфорная кислота;
P2O5 + 3H2O = 2H3PO4 - ортофосфорная кислота.
