
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
8.6. Типы и свойства растворов
Типы растворов. По количеству растворенного вещества растворы могут быть разбавленными (в одном литре разбавленного раствора содержится менее одного моля растворенного вещества) и концентрированными.
По количеству растворенного вещества и характеру установившегося равновесия между растворенным веществом и растворителем растворы делятся на ненасыщенные , насыщенные и пересыщенные (раздел 8.4).
По результату взаимодействия вещества с растворителем растворы делят на ионные (в них растворяемое вещество частично или полностью диссоциировано на ионы) и молекулярные (растворяемое вещество распределяется в растворителе в виде отдельных молекул).
По электрической проводимости растворы делятся на:
растворы неэлектролитов, не способные проводить электрический ток (молекулярные растворы);
растворы электролитов, проводящие электрический ток (ионные растворы, проводники второго рода).
Растворенные вещества делятся, в свою очередь, на неэлектролиты и электролиты.
Неэлектролиты – это вещества, которые в растворе и расплаве не диссоциируют (не распадаются) на ионы.
Электролиты – это вещества, которые в расплавах, воде и других полярных растворителях диссоциируют на ионы.
Общие свойства жидких растворов. Все растворы обладают рядом общих свойств:
1. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем; при этом, чем больше концентрация растворенного вещества, тем давление ниже (это свойство описывает Iзакон Рауля).
Насыщенный пар – это пар, находящийся в равновесии с жидкостью; Vисп=Vконд.
2. Растворы всегда кипят при температурах более высоких, а замерзают при более низких, чем чистый растворитель (это свойство описывает IIзакон Рауля).
3. Для растворов характерно явление осмоса (это свойство описывает закон Вант-Гоффа).
Эти свойства количественно зависят от числа частиц растворенного вещества, от концентрации раствора и от того, является ли данный раствор раствором электролита или неэлектролита.
Для количественного описания свойств растворов используют модель идеального раствора. Если при образовании раствора тепловой эффект ∆Н=0, изменение объема ∆V=0, изменение энтропии ∆S= ∆Sидеального раствора, то раствор называют идеальным. В идеальном растворе между компонентами нет химического взаимодействия; каждый компонент ведет себя в идеальном растворе независимо от остальных компонентов, и свойства раствора при данных условиях определяются только концентрацией растворенного вещества. Из реальных растворов лишь разбавленные растворы неэлектролитов могут по своим свойствам приближаться к идеальным.
Примерами растворов неэлектролитов могут служить, например, растворы кислорода и сахара в воде, водные растворы органических спиртов, растворы углеводородов в углеводородах и т.д.
8.7. Свойства растворов неэлектролитов
Давление насыщенного пара над раствором. I закон Рауля.
В
результате естественного процесса
испарения над жидкостью образуется
пар, давление которого можно измерить
с помощью манометра (рис. 8.1). Эндотермический
процесс испарения обратим; одновременно
с ним протекает экзотермический процесс
конденсации:
![]()
При равновесии (∆G=0) Vисп=Vконд. Каждый раствор находится в равновесии с его насыщенным паром. Давление насыщенного пара каждого вещества есть величина постоянная при данной температуре, с повышением температуры давление пара увеличивается.
Давление насыщенного пара жидкости определяется числом молекул жидкости, отрывающихся с ее поверхности за единицу времени.
Рассмотрим пример (рис.8.2). В первом сосуде у нас находится чистая вода, во втором – раствор сахара в воде (раствор неэлектролита; сахар -- нелетучее вещество и при данных условиях не испаряется).
При образовании раствора концентрация растворителя уменьшается, его мольная доля становится меньше единицы (N1<1). Поверхность раствора, в отличие от поверхности чистого растворителя, частично занята молекулами нелетучего растворенного вещества. Это приводит к уменьшению числа молекул растворителя, испаряющихся в единицу времени.
N1=1
P0 P0>P
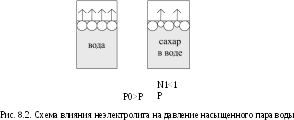
Однако основную роль здесь играют силы сольватационного взаимодействия между молекулами растворителя и растворенного вещества. Эти силы значительно прочнее сил сцепления между молекулами растворителя, чем и объясняется переход меньшего числа молекул растворителя в газовую фазу.
Таким
образом, над раствором давление
насыщенного пара растворителя (Р) всегда
меньше, чем над чистым растворителем
(Р0):
Р < Р0.
(Р0
– Р)=∆P
– понижение давления насыщенного пара
растворителя над раствором. Отношение
![]()
 называется относительным понижением
давления насыщенного пара растворителя.
называется относительным понижением
давления насыщенного пара растворителя.
В 1887 г. французский ученый химик Франсуа Рауль установил I закон: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Математическая запись I закона Рауля:
![]() или
или
![]() ,
,
где N2 – мольная доля растворенного вещества.
Выразив
мольную долю растворенного вещества
N2
через соотношение
![]() ,
подставим данное равенство в выражениеI
закона Рауля, выполнив необходимые
преобразования, получим второй вариант
записи I
закона Рауля:
,
подставим данное равенство в выражениеI
закона Рауля, выполнив необходимые
преобразования, получим второй вариант
записи I
закона Рауля:
![]() ,
,
где N1 – мольная доля растворителя.
Т.е. давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.
Кипение и замерзание растворов неэлектролитов. IIзакон Рауля.
Следствием понижения давления насыщенного пара растворителя над раствором будет:
понижение температуры замерзания раствора;
повышение температуры кипения раствора.
Рассмотрим диаграмму состояния воды и раствора неэлектролита. На рис.8.3 схематически изображена зависимость равновесного давления водяного пара от температуры над чистой водой и раствором.
При температуре кипения давление пара равно внешнему давлению, при температуре замерзания давление пара над веществом в жидком и твердом состояниях одинаково.
Линия АО – кривая сублимации – характеризует давление насыщенного водяного пара надо льдом, ОВ – кривая плавления или кристаллизации воды; ОС – кривая испарения или конденсации воды.
В точке О сосуществуют все три фазы воды: жидкость, пар, лед.
Линия О′С′ – кривая испарения или конденсации раствора;
О′В′ – кривая плавления или кристаллизации раствора.
Обозначение: t1 - температура замерзания (кристаллизации) раствора при 760 мм рт. ст.; t2 - температура замерзания чистой воды (0 °С при 760 мм рт. ст.); t3 - температура кипения чистой воды (100 °С при 760 мм рт. ст.); t4 - температура кипения раствора.
Поскольку
давление насыщенного пара воды над
раствором будет ниже, чем над чистой
водой, то изменение его давления будет
характеризоваться кривой О′С′, все
точки которой располагаются ниже
соответствующих точек кривой ОС для
чистого растворителя, т.е. кривая кипения
для раствора лежит ниже, чем для чистой
воды. Из рис. 8.3 видно, что при t
= 100 °С давление насыщенного пара воды
над раствором меньше атмосферного
давления (точка Е), поэтому при данной
температуре раствор не закипает.
Равенство давлений достигается в точке
D
при температуре t4.
При переходе от воды к раствору изменяется
также положение кривой плавления. И
кривая кипения, и кривая плавления
раствора расположены тем дальше от
соответствующих кривых воды, чем
концентрированнее раствор.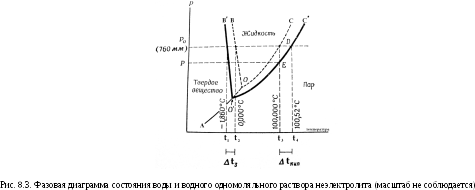
∆tкип = t4 – t3 = (tкип.р-ра – tкип.р-ля) – повышение температуры кипения раствора по сравнению с температурой кипения растворителя.
∆tзам = t2 – t1 = (tзам.р-ля – tзам.р-ра) – понижение температуры замерзания (кристаллизации) раствора по сравнению с температурой замерзания растворителя.
Зависимость ∆tкип и ∆tзам от концентрации растворов определяется вторым законом Рауля:
повышение температуры кипения и понижение температуры замерзания растворов пропорциональны моляльной концентрации растворенного вещества, т.е.
∆tкип = Кэб · Сm,
∆tзам = Ккр ·Сm ,
где Кэб – коэффициент пропорциональности, называемый эбуллиоскопической постоянной растворителя; Ккр – криоскопическая постоянная растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг.
Физический смысл Кэб и Ккр: если Сm= 1 моль/кг, то ∆tзам= Ккр, т.е. Ккр – понижение tзам раствора, моляльность которого равна 1 моль/кг; ∆tкип= Кэб, т.е. Кэб – повышение tкип раствора, моляльность которого равна 1 моль/кг.
Кэб, Ккр – характеристики растворителя, не раствора, зависят от природы растворителя (справочные величины). Например,
для воды: для бензола:
Ккр=1,86 °С · кг/моль, Ккр=5,12 °С · кг/моль,
Кэб=0,52 °С · кг/моль; Кэб=2,53 °С · кг/моль.
Для одномоляльных растворов различных неэлектролитов независимо от их состава температура кипения данного раствора повышается на одну и ту же величину, а температура замерзания – понижается на одну и ту же величину. Так, температура кипения различных по составу одномоляльных водных растворов увеличивается на 0,52°С, а температура замерзания понижается на 1,86°С.
Этот закон показывает, что свойства растворов зависят только от числа частиц растворенного вещества, но не от их размеров, природы и т.д.
Измерение понижения температуры кристаллизации раствора по сравнению с температурой кристаллизации чистого растворителя называют криоскопией. Измерение повышения температуры кипения раствора по сравнению с температурой кипения чистого растворителя называют эбуллиоскопией.
Методами криоскопии и эбуллиоскопии определяют относительные молекулярные массы растворенного неэлектролита. Для этого подставим в уравнение второго закона Рауля «развернутую» формулу для расчета моляльной концентрации растворенного вещества В
![]() =
=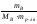 ,
,
получим:
∆tкип
= Кэб
·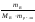 ,
,
∆tзам
= Ккр
·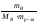 .
.
Откуда
 ;
;
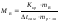 ,
,
где МВ- молярная масса растворенного неэлектролита В, численно равная его относительной молекулярной массе, mB – масса неэлектролита В, г; mр-ля – масса растворителя, кг.
Осмос. Осмотическое давление. Закон Вант-Гоффа.
Если привести в соприкосновение два раствора с разными концентрациями, то молекулы растворителя и растворенного вещества будут диффундировать в противоположных направлениях, преимущественно в том направлении, где их концентрация ниже. Такая двусторонняя диффузия приведет к выравниванию концентраций (С1 = С2).
Рассмотрим особый случай односторонней диффузии, когда на границе между раствором и растворителем или между двумя растворами различной концентрации находится перегородка, проницаемая для молекул растворителя и задерживающая частицы растворенного вещества.
Представим
себе, что в сосуд с водой опущен цилиндр
с раствором, нижняя часть которого
изготовлена из материала, пропускающего
растворитель, но не пропускающего
частицы растворенного вещества
(полупроницаемая перегородка). Получается
неравновесная система, т.к. если в воде
N1=1,
то в растворе мольная доля растворителя
– воды N1<1.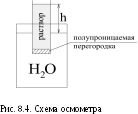
Поэтому в системе начнется самопроизвольный процесс выравнивания концентраций. Молекулы растворителя воды будут переходить в цилиндр с раствором (переход растворенного вещества исключен).
Односторонняя диффузия растворителя в раствор через полупроницаемую перегородку называется осмосом.
На рис. 8.4 представлен простейший прибор для наблюдения осмоса, называемый осмометром. В результате осмоса раствор поднимается по цилиндру вверх за счет того, что число молекул воды, проникающих в единицу времени в направлении от растворителя к раствору, больше числа молекул воды, проходящих через мембрану в обратном направлении. Через некоторое время подъем жидкости в цилиндре прекратится и ее уровень достигнет высоты h над уровнем жидкости в стакане. Столб жидкости с высотой h образовался за счет осмоса. Осмос прекращается тогда, когда скорости перехода молекул растворителя через полупроницаемую перегородку в обоих направлениях становятся одинаковыми.
Для количественной характеристики осмотических свойств растворов по отношению к чистому растворителю вводится понятие об осмотическом давлении. Осмотическое давление (Росм) – мера силы, приходящейся на единицу площади поверхности и заставляющей проникать молекулы растворителя через полупроницаемую перегородку или, другими словами, давление, которое нужно приложить к раствору, чтобы осмос прекратился. Осмотическое давление в растворе не существует, оно проявляется только тогда, когда раствор отделен от растворителя полупроницаемой мембраной.
Осмотическое давление Росм зависит от температуры раствора и его концентрации и не зависит от природы растворителя и растворенного вещества. В 1886 г. голландский химик Вант-Гофф показал, что для разбавленных растворов неэлектролитов зависимость осмотического давления от температуры и концентрации выражается уравнением (закон Вант-Гоффа):
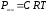 ,
,
где Росм – осмотическое давление раствора, кПа; С – молярная концентрация растворенного неэлектролита, моль/л; Т – абсолютная температура, К.
Заменим
величину С отношением
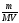 ;
;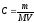 ,
где m – масса растворенного вещества,
г; M – молярная масса растворенного
вещества, г/моль; V – объем раствора, л.
Подставим это отношение в выражение
закона Вант-Гоффа:
,
где m – масса растворенного вещества,
г; M – молярная масса растворенного
вещества, г/моль; V – объем раствора, л.
Подставим это отношение в выражение
закона Вант-Гоффа:
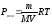 .
.
Формально уравнение Вант-Гоффа аналогично уравнению состояния идеального газа и выражает сходство в поведении разбавленных растворов неэлектролитов с идеальными газами. Из вышеприведенного уравнения выразим величину М:
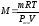 .
.
Данное выражение позволяет определить молекулярную массу растворенного вещества, измерив осмотическое давление в осмометре.
Явление осмоса играет важную роль в жизни растений, животных и человека. Стенки растительных клеток живых организмов представляют собой полупроницаемые мембраны, через которые свободно проходят молекулы воды, но почти полностью задерживаются вещества, растворенные в клеточном соке. Поэтому осмос служит причиной тургора (состояние напряжения) и плазмолиза (сморщивание) клеток. С ним связаны процессы усвоения пищи и обмена веществ. У высших животных и человека осмотическое давление в разных органах и тканях несколько меньше 8 атм и постоянно. Осмотическое давление широко встречается в природе, например, в скважинах осмотическое давление рвет породы и т.д.
