- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
Очень разб.
Активный

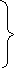
HNO3
+ Me

разб. Средней + Me (NO3)n + H2O
активности

Малоактивный
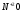

Активный
+4
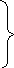
NO
+2

Средней
HNO3
+ Me активности NO2 +
Me(NO3)n
+ H2O
активности NO2 +
Me(NO3)n
+ H2O
+4

конц.
Малоактивный
NO2
Примеры:
Ba + HNO3 NH4NO3 + Ba(NO3)2 + H2O
очень разб.
NO
 + 10H+
+ 8
+ 10H+
+ 8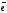
NH4+
+ 3H2O
NH4+
+ 3H2O
Ba – 2
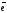
Ba2+
Ba2+
NO + 10H+
+ 4Ba = NH4+
+ 3H2O
+ 4Ba2+
+ 10H+
+ 4Ba = NH4+
+ 3H2O
+ 4Ba2+
4Ba + 10HNO3 = NH4NO3 + 4Ba(NO3)2 + 3H2O
Zn + HNO3 Zn(NO3)2 + N2O + H2O
разб.
4
Zn – 2
Zn2+
Zn2+
1
2NO + 10H+
+ 8
+ 10H+
+ 8
N2O
+ 5H2O
N2O
+ 5H2O
4Zn + 2NO3- + 10H+ = 4Zn2+ + N2O + 5H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O
Особенности
взаимодействия металлов с концентрированной
серной кислотой.
Концентрированная серная кислота
реагирует со всеми металлами, кроме Ag,
Au, Pt. В концентрированной серной кислоте
более сильным окислителем, чем катионы
водорода,
являются сульфат-ионы SO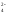 ,поэтому при
её взаимодействии с металлами Н2
не выделяется, а идёт восстановление
серы S+6
в анионе SO
,поэтому при
её взаимодействии с металлами Н2
не выделяется, а идёт восстановление
серы S+6
в анионе SO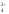 ,
при этом продукт восстановления зависит
от активности металла:
,
при этом продукт восстановления зависит
от активности металла:
|
|
Активный |
H2S |
|
|
H2SO4(конц.)
+
Ме |
Ср. активности |
S |
+ Ме2(SO4)n + Н2О |
|
|
Малоактивный |
SO2 |
|
Например,
Zn + H2SO4 S + ZnSO4 + H2O
конц.
3
Zn – 2
Zn2+
Zn2+
1
SO + 8H+
+ 6
+ 8H+
+ 6
S + 4H2O
S + 4H2O
3Zn + SO42- + 8H+ = 3Zn2+ + S + 4H2O
3Zn + 4H2SO4 = S + 3ZnSO4 + 4H2O
Примечание: в концентрированных растворах НNO3, Н2SO4 такие металлы как Fe, Al, Cr пассивируются образующимися оксидами.
Например,
Fe + HNO3 Fe2O3 + NO2 + H2O
конц.
Восстановительные свойства металлов по отношению к катионам металлов. В общем ионно-молекулярном виде такой тип взаимодействия можно представить следующим образом:
Ме1 + Ме2n+ Ме1m+ + Ме2
в-ль ок-ль пр. ок-ия пр. в-ния
Ме1
– m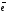
Ме1m+
Ме1m+
Ме2n+
+ n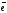
Ме2
Ме2
Е0
=
 –
–
Так
как самопроизвольному процессу отвечает
Е0
0, то

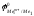 .Это означает,
что более активный металл (с меньшим
электродным потенциалом, Ме1)
вытесняет менее активный металл (с
большим электродным потенциалом, Ме2)
из раствора его соли.
.Это означает,
что более активный металл (с меньшим
электродным потенциалом, Ме1)
вытесняет менее активный металл (с
большим электродным потенциалом, Ме2)
из раствора его соли.
Например,
реакция омеднения цинка в растворе
сульфата меди (II)
возможна, т.к.
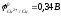
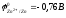 :
:
Zn + CuSO4 = ZnSO4 + Cu.
Литература
Ахметов Н.С. Общая и неорганическая химия. 4-е изд., испр – М.: Высшая школа, 2006. – 743 с.
Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2009. – 727 с.
Коровин Н.В. Общая химия.. – М.: Высшая школа, 2007. – 556 с.
Лидин Р.А. Общая и неорганическая химия в вопросах Учебное пособие для ВУЗов. – М.: Изд-во Дрофа, 2005. – 230 с.
Лидин Р.А. Аликберова Л.Ю. Логинова Г.П. Общая и неорганическая химия в вопросах: Учеб пособие для вузов - 2-е изд перераб и доп. – М.: Изд-во Дрофа, 2004. – 216 с.
Хомченко И.Г. Общая химия. – М.: Новая волна, 2004. – 464 с.