
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
11. Свойства металлов
Все простые вещества можно разделить на металлы и неметаллы изза существенного различия их свойств (табл. 11.1).
Таблица 11.1
Некоторые характерные свойства металлов и неметаллов
|
Характерные свойства | |
|
металлов |
неметаллов |
|
Металлическая связь в кристаллах |
Ковалентная связь в большинстве простых веществ |
|
Металлический блеск |
Различается окраска |
|
Хорошие теплопроводность и электрическая проводимость |
Плохие теплопроводность и электрическая проводимость |
|
Ковкость и пластичность |
Хрупкость твердых тел (как правило) |
|
Восстановители |
Многие из них окислители |
|
Большинство оксидов – ионные соединения, имеют основной характер и при растворении в воде образуют основные растворы |
Большинство оксидов – ковалентные соединения, имеют кислотный характер и при растворении в воде образуют кислотные растворы |
Большинство элементов являются металлами. К ним относятся все s -элементы, кроме водорода и гелия, все d- и f–элементы и часть р– элементов (Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi, Po). Металлическими свойствами обладают и многочисленные сплавы указанных элементов. Если условно провести границу от 5В к 85At, то всё, что находится слева от этой линии – металлы, а справа – неметаллы (р–элементы ).
Граница между металлами и неметаллами размыта, между ними находятся полуметаллы (B,Si,Ge,As,Sb,Te,At). Полуметаллы обладают свойствами как металлов, так и неметаллов. Например, серый мышьяк имеет металлический блеск и электрическую проводимость, но хрупок, а желтый мышьяк имеет чисто неметаллические свойства.
11.1. Физические свойства металлов
Металлы – простые вещества, обладающие рядом ценных для человека специфических свойств (так называемых металлических свойств).
Для металлов в конденсированном состоянии характерна кристаллическая решётка с металлической связью. Для описания металлической связи часто используют модель «свободного электрона» (см. раздел 3.9). Согласно этой модели, в узлах кристаллической решётки металла находятся положительные ионы металла, «погружённые» в электронный газ из нелокализованных валентных электронов атомов, участвующих в образовании кристалла. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом. Именно металлической связью объясняются физические свойства металлов.
Для всех металлов (кроме ртути) характерно твердое агрегатное состояние. Твердость их различна и обусловливается прочностью пространственной кристаллической решетки. Наиболее твердые – простые вещества d-элементовVIгруппы, наименее твердые – простые вещества щелочных металлов. Твердость металлов определяет возможность использования их в качестве конструкционных и инструментальных материалов.
Для металлических тел с гладкой поверхностью характерен металлический блеск – результат отражения световых лучей. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. Интенсивность блеска зависит от доли поглощаемого веществом света; чем меньше света поглощает металл, тем ярче его блеск. Серебро и палладий, отличающиеся наиболее интенсивным блеском, используют для изготовления зеркал. В мелкодисперсном состоянии многие металлы (железо, платина и др.) теряют блеск, приобретают черную или серую окраску.
Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокую электрическую проводимость и теплопроводность. Лучшими проводниками электричества являются серебро, медь, золото и алюминий, худшими – свинец и ртуть. Металлы обладают высокой теплопроводностью. Наибольшая теплопроводность - у металлов с наилучшей электрической проводимостью.
Ионы металлов в кристалле могут скользить относительно друг друга. Этим объясняется ковкость (способность к расплющиванию – можно ковать листы) и пластичность (способность вытягиваться в проволоку и ленту). Наиболее пластичны золото, серебро и медь; из 1 г золота удается получить проволоку длиной в 3км, изготовить «золотую фольгу» толщиной 0,0001 мм.
В технике металлы подразделяют на чёрные, цветные, редкоземельные и драгоценные. К черным относят железо и его сплавы, к драгоценным – золото, серебро, платину и иридий, к редкоземельным – скандий, иттрий, рений, осмий, лантаноиды совместно с лантаном. Остальные металлы, включая магний, алюминий, медь и их сплавы, относят к цветным. Кроме того, различают металлы щелочные (литий, натрий, калий, рубидий, цезий, франций) и щелочно-земельные (кальций, стронций, барий, радий).
В
промышленности
металлы подразделяют
на лёгкие (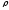
5 г/см3)
и тяжёлые (
5 г/см3)
и тяжёлые (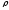
5 г/см3).
Осмий – самый тяжёлый металл (
5 г/см3).
Осмий – самый тяжёлый металл (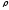 = 22,5 г/см3).
По температуре плавления различают
лёгкоплавкие (< 1000 оС)
и тугоплавкие (> 1500 оС);
самые тугоплавкий металл – вольфрам
(tпл=3400
оС).
= 22,5 г/см3).
По температуре плавления различают
лёгкоплавкие (< 1000 оС)
и тугоплавкие (> 1500 оС);
самые тугоплавкий металл – вольфрам
(tпл=3400
оС).
