
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
Важнейшие восстановители и окислители
|
Восстановители |
Окислители |
|
металлы, водород, уголь |
галогены |
|
оксид углерода (II) CO |
оксид марганца (VII) - Mn2O7 |
|
сероводород H2S |
оксид марганца (IV) - MnO2 |
|
сульфид натрия Na2S |
перманганат калия - KMnO4 |
|
оксид серы (IV) - SO2 |
манганат калия - K2MnO4 |
|
сернистая кислота - H2SO3и ее соли |
оксид хрома (VI) - CrO3 |
|
тиосульфат натрия - Na2S2O3 |
хромат калия - K2CrO4 |
|
иодоводородная кислота - HI |
дихромат калия - K2Cr2O7 |
|
бромоводородная кислота - HBr соляная кислота – HCl хлорид олова (II) - SnCl2 сульфат железа (II) - FeSO4 сульфат марганца (II) - MnSO4 сульфат хрома (III) - Cr2(SO4)3 азотистая кислота - HNO2 аммиак NH3 гидразин N2H4 оксид азота (II) NO фосфористая кислота - H3PO3 ортомышьяковистая кислота - H3AsO3 гексацианоферрат (II) калия - K4[Fe(CN)6] |
азотная кислота - HNO3 кислород - О2 озон - О3 пероксид водорода - Н2О2 серная кислота - H2SO4(конц.) селеновая кислота - H2SeO4 оксид меди (II) - CuO оксид серебра (I) - Ag2O оксид свинца (IV) - PbO2 ионы благородных металлов (Ag+, Au3+и др.) висмутат натрия - NaBiO3 персульфат аммония - (NH4)2S2O8 гексацианоферрат (III) калия –K3[Fe(CN)6] хлорид железа (III) – FeCl3 гипохлориты, хлораты, перхлораты царская водка смесь концентрированных азотной и плавиковой кислот |
9.3. Влияние среды на окислительно-восстановительные реакции
Характер среды (кислотный, нейтральный,
щелочной) влияет на ОВР. В разных средах
при взаимодействии одних и тех же
веществ могут получаться различные
продукты. В этом мы убедились на примерах,
рассмотренных в разделе 9.1, где окислителем
является перманганат – ион MnO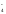 :
:
окисленная форма восстановленная форма
кислая среда Mn2+б/ц или слабо-розовая
рн
7 окраска р-ра
+7
нейтральная среда +4
MnO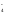 рн
7 MnO2
(бурый осадок)
рн
7 MnO2
(бурый осадок)
+6
щелочная
среда (MnO4)2-
(зелёная окраска
рн 7 раствора)
Перманганат–ион окислительные свойства в большей степени проявляет в кислой среде (большее понижение степени окисления).
Обычно для создания в растворе кислой среды используют серную кислоту. Азотную и соляную (хлороводородную) кислоты применяют редко: первая сама является окислителем, вторая способна окисляться. Для создания щелочной среды применяют растворы гидроксида калия или натрия.
Рассмотрим примеры влияния среды на течение реакции с участием пероксида водорода. Пероксид водорода в зависимости от среды восстанавливается согласно схеме:
кислая среда pн 7
H2O2
+ 2H+
+ 2e-
= H2O
H2O2
нейтральная
среда
щелочная среда H2O2 + 2e- = 2OH-
Здесь H2O2 выступает как окислитель. Например:
2FeSO4
+ H2O2
+ H2SO4
= Fe2(SO4)3
+ 2 H2O
2
Fe2+
- e-
= Fe3+
2
1
H2O2
+ 2H+
+ 2e = 2 H2O
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2 H2O
Однако, с очень сильным окислителем, таким, как KMnO4, пероксид водорода взаимодействует как восстановитель:
H2O2 - 2e- = O2 + 2H+
Например:
5 H2O2 + 2 KMnO4 + 3H2SO4 = 5 O2 + 2 MnSO4 + K2 SO4 + 8H2O
5
H2O2
- 2e-
= O2
+ 2H+
10
2
MnO-4
+ 8H+
+ 5e = Mn2+
+ 4H2O

5 H2O2 + 2 MnO-4 + 6H+ = 5 O2 + 2 Mn2+ + 8H2O
Хром в своих соединениях имеет устойчивые с.о. (+6) и (+3). В первом случае соединения хрома (хромат-, дихромат-ионы) проявляют свойства окислителей, во втором – восстановителей. Хромат и дихромат-ионы – сильные окислители, восстанавливаются до соединений Cr3+:
окисленная форма восстановленная форма
