
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
2.6. Электронные конфигурации (формулы) элементов
Запись распределения электронов в атоме по уровням, подуровням и орбиталям получила название электронной конфигурации (формулы) элемента. Обычно электронная формула приводится для основного состояния атома. В случае, если один или несколько электронов находятся в возбужденном состоянии, то и электронная формула будет характеризовать возбужденное состояние атома. При записи электронной формулы указывают цифрами номер энергетического уровня, равный главному квантовому числу (n), буквами показывают подуровни или тип орбиталей (s, p, d, или f), а верхний индекс буквенных обозначений подуровней обозначает число электронов в данном подуровне.
Например, электронная конфигурация водорода 1H-1s1, лития -
3Li – 1s2 2s1, титана 22Ti – 1s22s22p6 3s23p64s23d2.
Часто структуру электронных оболочек изображают с помощью квантовых ячеек – это так называемые электронографические формулы или схемы. Каждая такая ячейка обозначается клеткой: клетка – орбиталь, стрелка – электрон, направление стрелки – направление спина, свободная клетка – свободная орбиталь. Например:
4Be – 1s22s2;

4Be – электронографическая формула
2p
2s
1s
или в строчку
4Be



1s 2s 2p
s
или
n=1 p 
n=2
Во избежание громоздких записей обычно графические формулы пишут для подуровней с валентными электронами. Например:
17Cl – 1s2 2s2 2p6 3s2 3p5; p – элемент1,
17Cl
… -валентные электроны;

3s 3p
22Ti – 1s22s22p63s23p64s23d2; d – элемент,
22Ti
… - валентные электроны.

4s3d
2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:
принцип наименьшей энергии;
правило Клечковского;
принцип запрета Паули;
правило Гунда.
Принцип наименьшей энергии: максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости.
В
многоэлектронных атомах электроны
испытывают не только притяжение ядер,
но и отталкивание электронов, находящихся
ближе к ядру и экранирующих ядро от
более далеко расположенных электронов.
Поэтому последовательность возрастания
энергии орбиталей усложняется.
Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l), а при равных значениях суммы (n+l) – в порядке возрастания n.
Соответственно этому правилу подуровни выстраиваются в следующий ряд (рис. 2.4.): 1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d.
Например:
|
Подуровни |
3d |
4s |
4p |
|
n |
3 |
4 |
4 |
|
l |
2 |
0 |
1 |
|
n+l |
5 |
4 |
5 |
Порядок заполнения: 4s, 3d, 4p.
Исключение составляют d и f – элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый провал электронов, например: Cu, Ag, Cr, Mo, Pd, Pt (это явление будет рассмотрено позднее).
Принцип запрета Паули гласит: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел.
Согласно
этому принципу, на одной орбитали,
характеризуемой определенными значениями
трех квантовых чисел n,
l
и ml,
могут находиться только два электрона,
отличающихся значением спинового
квантового числа ms,
а именно ms=+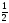 иms=
–
иms=
–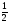 ,
т.е. спины которых противоположно
направлены.Это можно символически
представить следующей схемой .
,
т.е. спины которых противоположно
направлены.Это можно символически
представить следующей схемой .
Заполнение
и не допускается.

Принцип запрета Паули определяет электронную емкость энергетических уровней и подуровней. На s – подуровне (одна орбиталь) может быть лишь два электрона, на p – подуровне (три орбитали) – шесть, на d подуровне (пять орбиталей) – десять, на f – подуровне (семь орбиталей) – четырнадцать электронов. Вообще, максимальное число электронов на подуровне с орбитальным квантовым числом l равно 2(2l+1). Поскольку число орбиталей данного энергетического уровня равно n2, емкость энергетического уровня составляет 2n2 электронов, где n – соответствующее значение главного квантового числа.
Правило Гунда: устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально.
Рассмотрим распределение электронов по энергетическим ячейкам в атоме углерода, электронная конфигурация которого 1s22s22p2. Возможны три варианта:
а)
б)
в) 








1s2s2p1s2s2p1s2s2p
∑ms=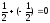 ∑ms
=+
∑ms
=+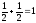 ∑ms=0
∑ms=0
Во всех вариантах спиновое число 1s2 и 2s2 – электронов равно 0 (спины электронов антипараллельны в каждой энергетической ячейке). Суммарное спиновое число p – электронов в вариантах a), в) равно нулю (∑ms =0), в варианте (б) ∑ms=1. В соответствии с правилом Гунда реализуется только вариант (б).
Другими словами: заполнение орбиталей одного подуровня в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данном подуровне, заполняются орбитали вторыми электронами с противоположными спинами.
