
133851261-119352752-Tehnica-farmaceutica
.pdf
9Procentual în unităţi de masă(g/g sau g/volum) sau unităţi de volum(volum/volum).
Farmacopeea Română ediţia a X a înscrie următorii termeni aproximativi
pentru exprimarea solubilităţii substanţelor medicamentoase:
Expresii folosite |
Solubilitate |
|
|
Foarte uşor solubil |
cel mult 1 ml |
|
|
Uşor solubil |
de la 1 ml |
→ |
10 ml |
Solubil |
de la 10 ml |
→ |
30 ml |
Puţin solubil |
de la 30 ml |
→ |
100 ml |
Foarte puţin solubil |
de la 100 ml |
→ |
500 ml |
Greu solubil |
de la 500 ml |
→ |
1000 ml |
Foarte greu solubil |
de la 1000 ml → |
10.000 ml |
|
Practic insolubil |
mai mult de 10.000 ml |
||
Termodinamica solubilităţii. Solubilizarea unei substanţe implică desfacerea legăturilor dintre moleculele sau ionii solutului cu apariţia căldurii de dizolvare H’, deci procesul de distrugere a legăturilor din structura solutului este un proces ce are loc cu eliberare sau consum de căldură. Solubilizarea poate fi un proces endoterm sau exoterm. Căldura sub care are loc procesul de solubilizare influenţează entalpia liberă ( G) a procesului care este determinată de entropia( S) a acestui proces care are loc la temperatura T, conform formulei:
G = |
H’ - T S |
|
Astfel, când |
H’ = 0 procesul de dizolvare nu este influenţat de temperatură şi |
|
se obţine o soluţie ideală; |
|
|
H’ |
> 0 |
procesul de dizolvare este influenţat de variaţii |
|
|
ale temperaturii şi în aceste condiţii se obţin |
H’ < 0 |
soluţiile reale |
|
Procesul de dizolvare are loc prin interacţiuni de tipul:
9Solut – solut de tipul ion – ion, dipol-dipol, dipol indusdipol indus;
9Solut – solvent când se formează legături de tipul ion – dipol, dipol – dipol, dipol – dipol indus, dipol indus – dipol;
9Solvent – solvent de tipul dipol – dipol, legături de hidrogen, dipol indus – dipol indus.
Factorii care influenţează dizolvarea
Viteza cu care are loc dizolvarea poate fi definită prin ecuaţia:
dc/dt = k S ( cs – ct )
51
unde: dc/dt reprezintă viteza de dizolvare;
S = suprafaţa totală a solidului nedizolvat;
cs = concentraţia soluţiei la saturaţie(solubilitatea) la o temperatură dată; ct = concentraţia soluţiei la timpul t ;
k = constanta vitezei de dizolvare a cărei valoare depinde de o serie de factori:
I.Mărimea suprafeţei de contact solut – solvent care se poate realiza prin aducerea solidului în stare de pulbere foarte fină;
II.Mărirea difuziunii particulelor fie prin agitarea amestecului solut – solvent, fie prin micşorarea vâscozităţii mediului de dizolvare în cazul când solventul are o densitate crescută.
III.Temperatura prin creşterea valorilor acesteia. Pentru majoritatea substanţelor farmaceutice dizolvarea este un proces endoterm ca urmare creşterea temperaturii va favoriza dizolvarea, crescând viteza procesului. Excepţie fac substanţele gazoase şi unele substanţe solide cum sunt: hidroxidul de sodiu, citratul de sodiu, glicerofosfatul de calciu, metilceluloza, carboximetilceluloza.
IV. Asocierea cu alte substanţe poate mări sau micşora viteza de dizolvare a unei substanţe. În general se folosesc doar substanţele care pot accelera viteza de dizolvare în cazul unor substanţe medicamentoase insolubile.
V.Prezenţa electroliţilor este un alt factor care poate influenţa dizolvarea substanţelor farmaceutice. În general, adăugarea unei sări ce are ion comun cu substanţa greu solubilă va determina reducerea solubilităţii acestuia(efectul ionului comun), excepţie este situaţia în care ionul comun determină formarea unui complex cu substanţa.
De asemenea, prezenţa electroliţilor foarte solubili, cu ioni ce au afinitate faţă
de apă determină micşorarea solubilităţii substanţelor prin competiţie pentru moleculele de solvent şi ruperea legăturilor intermoleculare dintre substanţa de dizolvat şi apă.
VI. Cosolvenţii, substanţele hidrotrope, substanţele tensioactive pot favoriza procesul de dizolvare în cazul unor substanţe cu solubilitate scăzută.
VII. pH-ul se poate modifica prin adaus de acizi sau baze în soluţii ceea ce va determina modificarea coeficientului de solubilitate al substanţelor cu solubilitate redusă în solventul respectiv.
8.4.Aducerea în soluţie a substanţelor medicamentoase greu solubile sau insolubile
Solubilizarea reprezintă, după unii autori, procesul prin care există posibilitatea de a trece în soluţie substanţe greu solubile sau insolubile în apă sub formă de soluţii prin adausul de una sau mai multe substanţe ajutătoare aplicându-se diferite metode:
52
Formarea de săruri solubile în apă
Este o metodă care se aplică în cazul substanţelor medicamentoase cu caracter acid (acidul acetilsalicilic, acizii barbiturici etc.) sau alcalin (alcaloizii) care se pot transforma în săruri ce formează soluţii moleculare în apă. Această metodă este aplicată în farmacie ori de câte ori este posibilă înlocuirea substanţei cu derivatul său solubil iar efectul terapeutic nu este modificat.
Introducerea de grupări hidrofile în molecule prin carboxilare, aminare, sulfonare etc., folosind astfel o metodă chimică pentru mărirea solubilităţii dar care are o aplicabilitate redusă dovedindu-se că introducerea unor grupări funcţionale într- o moleculă poate modifica efectul terapeutic.
Formarea de complecşi este o metodă care are la bază formarea de legături de hidrogen sau forţe dipol-dipol la asocierea a două substanţe astfel se realizează complecşi moleculari numiţi şi complecşi de adiţie, ei având posibilitatea de a facilita prepararea unor soluţii suficient de concentrate ale unor substanţe medicamentoase greu solubile.
Un exemplu, îl constituie solubilizarea unor substanţe organice prin formarea de complecşi - de exemplu, asocierea cofeinei cu benzoat de sodiu, a teofilinei cu etilendiamină, teobromina cu salicilat de sodiu. Astfel substanţele cu care sunt asociate substanţele active insolubile, vor facilita solubilizarea celor din urmă. În cazul acestor asocieri se va avea în vedere unele aspecte legate de absorbţia, distribuţia şi eliminarea substanţelor care sunt influenţate de formarea complecşilor. La ora actuală în tehnologia farmaceutică industrială se utilizează nişte oligozaharide ciclice, numite ciclodextrine, alcătuite din 7-8 unităţi de glucoză, care în funcţie de structura lor inelară sunt numite α,β,γ - ciclodextrine şi care în golul inelului pot include molecule de substanţe medicamentoase insolubile formând complecşi de incluziune cu afinitate mare faţă de apă. Astfel sunt solubilizate unele glicozide cardiotonice, vitamine liposolubile, hormoni, etc.
Un alt exemplu de solubilizare cu formare de complecşi este solubilizarea iodului în apă sau alcool cu ajutorul iodurii de potasiu când se formează complexul iod-iodurat, sau cu ajutorul polivinilpirolidonei în soluţie de concentraţie 10 – 15%.
Hidrotropia. O serie de substanţe cu grupări polare în structură pot mări solubilitatea în apă a unor substanţe medicamentoase proces numit “hidrotropie”.
Procesul se bazează pe activarea punţilor de hidrogen, formarea de complecşi sau scăderea tensiunii interfaciale şi astfel este crescută solubilizarea unor substanţe active terapeutic. Ca substanţe hidrotrope se folosesc alcoolii: etanol, glicerină, propilenglicol; esterii: mono şi diacetatul de glicol; eterii: dietilenglicol; sărurile acizilor organici: benzoat de sodiu, acetat de sodiu, salicilat de sodiu; acizii hidroxi-alifatici: acidul citric, acidul tartric; acizii aromatici: acidul paraaminobenzoic.
Solubilizarea micelară. Mc Bain şi Hutchinson au utilizat termenul de solubilizare micelară în cazul aducerii în soluţie a unor substanţe medicamentoase greu solubile cu ajutorul substanţelor tensioactive.
53
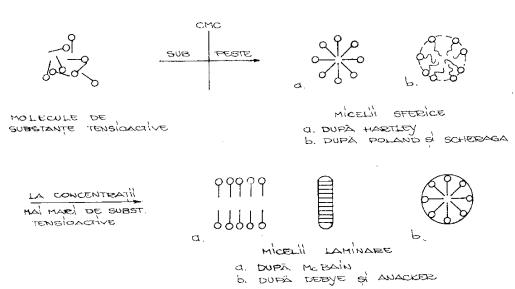
Solubilizarea micelară se bazează pe fenomene de suprafaţă, respectiv formarea de legături care să determine transferarea capacităţii de solubilizare a unei substanţe greu solubile sau insolubile. Soluţiile obţinute trebuie să fie clare sau slab opalescente fără să se modifice structura chimică a substanţei medicamentoase.
Tensidele din punct de vedere chimic sunt substanţe amfifile, având în structura lor o parte polară şi una nepolară ceea ce va determina balanţa HLB(hidrofil-lipofila) a moleculei. Punctul de echilibru al balanţei HLB este stabilit la valoarea 10. Pe măsură ce valoarea HLB creşte se măreşte şi hidrofilia unei molecule bipolare. Pentru că substanţele tensioactive să poată avea efect solubilizant trebuie ca valoarea HLB să fie cuprinsă între 15 –18.
Chimic, tensidele pot fi clasificate în trei categorii:
-tensioactivi anionici(săpunuri sau amfotere) – laurilsulfat de sodiu, dodecilsulfat de sodiu, dioctilsulfosuccinat de sodiu;
-tensioactivi cationicisărurile cuaternare de amoniu mai puţin folosite;
-tensioactivii neionici de tipul polisorbaţilor - eteri polioxietilenici ai esterilor anhidridei sorbitanului cu acizi graşi superiori. Farmacopeea Română ediţia X a înscrie un tensid, respectiv Polisorbatum 80 (tween 80). Au capacitatea de a forma agregate moleculare numite micele. Concentraţia de tensioactiv la care se realizează solubilizarea nu poate fi stabilită prin calcul, aceasta variind între 0,2 – 10%. Se recomandă utilizarea lor în concentraţii cât mai reduse, apropiate de valoarea concentraţia micelară critică având în vedere că pot irita tegumentele şi mucoasele cu care vin în contact. Nu pot fi folosiţi în concentraţii mari în soluţii de uz intern deoarece au un gust neplăcut. Micelele se formează în soluţie peste o anumită concentraţie şi aceasta se numeşte concentraţie micelară critică (c.m.c.) care este diferită la fiecare tensid în parte. De la această concentraţie se modifică toate proprietăţile soluţiei, respectiv conductibilitatea, presiunea osmotică, indicele de refracţie, scade punctul de congelare, tensiunea superficială, creşte vâscozitatea. Aceste micele au forme diferite – laminare sau cilindrice.
Fig.nr.5. Formarea şi structura micelelor
54
Capacitatea solubilizantă a tensidelor diferă şi este influenţată de structura acestora, de natura solubilizantului(structură, polaritate), temperatură precum şi prezenţa electroliţilor şi neelectroliţilor. Pentru a îmbunătăţi capacitatea solubilizantă a tensidelor se pot folosi cosolubilizanţii cum sunt alcooliiglicerol, sorbitol, alte zaharuri.Efectul creşte odată cu creşterea numărului grupărilor hidroxil din moleculă, alcoolii incorporându-se în stratul palisadic al micelei şi astfel le potenţează activitatea.
Cu ajutorul tensidelor se reuşeşte încorporarea în apă a unor uleiuri volatile, antiseptice: mentol, camfor, terpinhidrat. Asociate cu anestezice şi antibiotice pot diminua acţiunea lor terapeutică.
8.5. Tehnologia preparării soluţiilor
Pentru obţinerea soluţiilor medicamentoase tehnologia de preparare este simplă, atât în farmacie cât şi în industrie.
În prima etapă se aleg vasele de capacitate potrivită, componentele şi vehiculul.
În etapa a doua în vasul ales pentru preparare se aduce o parte din solvent, aproximativ 30% din cantitatea prescrisă, se adaugă substanţele şi se amestecă prin agitare iar dacă este cazul se încălzeşte amestecul pentru a favoriza dizolvarea. După ce toate componentele s-au dizolvat se completează cu solvent la masa totală. Dacă este cazul soluţia se filtrează pentru a îndepărta particulele insolubile aflate în suspensie.
În cazul când substanţele medicamentoase sunt solubile în solvent tehnica de preparare este simplă. Sunt cazuri în care pentru a grăbi procesul de dizolvare se agită amestecul. Agitarea se face cu scopul de a grăbi procesul de dizolvare, pentru că în apropierea solidului concentraţia soluţiei ajunge la saturaţie rapid şi restul soluţiei ar rămâne nesaturată. Prin agitare se înlocuiesc straturile de soluţie saturată din apropierea solidului cu alte straturi de solvent sau soluţie nesaturată.
Pentru a realiza agitarea amestecului se pot folosi mai multe sisteme de agitare (fig.nr.7):
9agitarea manuală, cu ajutorul unei baghete de sticlă sau metal;
9agitatoare cu elice, electromagnetice, cu palete, cu turbine, când se recomandă ca vasul de dizolvare să fie bine închis pentru că exista pericolul pierderii de componente şi pierderea lor în urma volatilizării, datorită agitării;
9agitatoare cu ultrasunete cu care realizăm o agitare uniformă în toată masa de solvent.
55

Fig.nr.6. Sisteme de agitare
Un alt factor care poate grăbi aducerea unor substanţe în soluţie, este temperatura.
În farmacie vasele în care se realizează dizolvarea se încălzesc la flacără, pe o sită de azbest sau pe baie de apă, în funcţie de sensibilitatea substanţelor medicamentoase la creşterea temperaturii.
În industrie se folosesc pentru încălzire vase de capacitate mare, prevăzute cu manta de încălzire cu vapori de apă sub presiune. Vaporii de apă pot circula prin pereţii dubli ai vasului sau printr-un sistem de tuburi introduse în vasul de amestecare.
În cazul în care dizolvarea substanţei se face cu eliberare de căldură se folosesc instalaţii frigorifice pentru a răci amestecul.
Pentru substanţele uşor oxidabile se recomandă barbotarea unui gaz inert în soluţie (azot, dioxid de carbon).
Soluţiile cu densitate mai mare se aduc peste soluţiile cu densitate mai mică. Soluţiile de substanţe colorate şi substanţele volatile se aduc la sfârşit în
soluţie, pentru a evita pierderile.
8.6. Filtrarea soluţiilor medicamentoase
Filtrarea este operaţia prin care un amestec de particule solide cu un lichid este trecut printr-un material poros în care sunt reţinute particulele solide şi fluidul rămâne limpede.
56

Conform Farmacopeei Române ediţia X a filtrarea este o operaţie recomandată astfel încât soluţiile să rămână limpezi.
Reţinerea particulelor solide se realizează prin două mecanisme:
9Adsorbţie, ce este un proces fizic care constă în reţinerea particulelor dintr – o soluţie mai mici decât diametrul porilor materialului filtrant prin stabilirea unor forţe electrostatice;
9Cernere, proces mecanic de reţinere a unor particule mai mari decât porii
materialului filtrant.
Filtrarea este eficace dacă sunt reţinute toate particulele în suspensie,
dar moleculele substanţei solubile trec cantitativ în soluţia filtrată, ce vor fi adsorbite pe suprafaţa filtrului.
Debitul cu care are loc filtrarea unei soluţii este stabilit cu ajutorul formulei lui Poisseuille:
dP r4
V = N
8π η L
unde V = debitul(ml/min);
N = numărul de pori pe suprafaţa filtrantă;
dP = diferenţa dintre presiunea dintre cele două părţi ale filtrului; r = raza medie a porilor;
η = vâscozitatea lichidului; L = grosimea filtrului.
Se observă că debitul filtrării creşte cu diametrul, cu numărul porilor şi suprafaţa filtrului precum şi cu diferenţa de presiune dintre cele două feţe ale filtrului
şi scade cu creşterea grosimii filtrului şi cu mărirea vâscozităţii lichidului. Materialele din care se obţin filtrele sunt:
9Celuloza;
9Material plasticpoliamide, poliesteri poliuretani;
9Organice - esteri de celuloză cu pori foarte fini, fragile, necesită un suport rigid şi sunt folosite în special pentru filtrarea soluţiilor sterile şi respectiv realizarea filtrării sterilizante;
9Sticla filtrantă – prezintă o reţea poroasă, rigidă;
9Materiale adsorbante aglomerate – folosite în asocierea cu fibrele de celuloză.
9Pudre filtrante – care înlocuiesc filtrele flexibile sau rigide, ele reţinând impurităţile prin adsorbţie. Se folosesc caolinul, cărbunele, pulpa de hârtie, pământ de infuzori.
La filtrele din diferite materiale poate avea loc colmatarea, adică depunerea particulelor insolubile în porii filtrului când debitul filtrării este mult redus.
57

Sistemele filtrante pot avea forme diferite: membrane, foi netede sau plisate, plăci, cartuşe, bujiuri, manşete.
Filtrarea se poate realiza prin mai multe metode, respectiv:
9Filtrare hidrostatică ce are loc la presiune normală, reprezentând filtrarea obişnuită. Se folosesc pâlnii conice pe care se aşează materialul filtrant.
9Filtrarea sub presiune(la suprapresiune) când viteza de filtrare este acceleratp prin aducerea soluţiei de filtrat sub presiune cu ajutorul aerului sau a unui gaz inert comprimat. Se folosesc filtrele alcătuite din două plăci suprapuse care reprezintă suportul pentru materialul filtrant.
9Filtrarea la presiune redusă se realizează prin aspirarea soluţiei sau la vid. Se folosesc pâlnii de porţelan plate pe care se fixează materialul filtrant, pâlniile Buchner, filtre Seitz.
8.7. Condiţionarea soluţiilor medicamentoase
Soluţiile medicamentoase se condiţionează în flacoane de sticlă, material plastic, prevăzute cu sistem de închidere prin înşurubare.
Sticla folosită trebuie să fie colorată - brun sau incoloră, iar materialul plastic să fie rigid sau flexibil.
Soluţiile medicamentoase care se administrează sub formă de picături se condiţionează în flacoane cu capacitatea de cel mult 50 ml prevăzute cu sistem de picurare.
Fig.nr.8. Modele pentru ambalaje
În industrie flacoanele sunt ambalate grupate câte 20 – 50 bucăţi, ambalajul fiind de carton şi etichetat corespunzător cu preparatul farmaceutic condiţionat în flacoanele existente.
Conform Farmacopeiei Române ediţia X a soluţiile medicamentoase se păstrează în flacoane bine închise.
În timpul conservării soluţiile trebuie să-şi păstreze caractersiticle organoleptice, pH-ul, să fie ferite de acţiunea factorilor exteriori (lumină, aer, căldură).
58
Capitolul IX
SOLUŢII MEDICAMENTOASE DE UZ INTERN
Reprezintă grupul soluţiilor care se administrează oral (per os) cunoscute sub diferite denumiri: siropuri, ape aromatice, poţiuni, elixire, soluţii şi picături buvabile, limonade.
9.1. Siropurile
Sunt înscrise în Farmacopeea Română ediţia X a în monografia Sirupi fiind definite ca preparate farmaceutice lichide cu un conţinut ridicat în zahăr, de consistenţă vâscoasă, destinate a fi administrate intern.
9.1.1.Generalităţi
Farmacopeea Română ediţia X a înscrie pe lângă monografia de generalităţi a siropurilor încă 4 monografii pentru siropuri: Sirupus simplex (conţine 64% zahăr), Sirupi Balsami Tolutani(4,5% balsam de Tolu), Sirupus Belladonnae (5% tinctură de mătrăgună), Sirupus codeini (0,2% codeină).
Siropurile au ca şi solvent apa sau soluţii medicamentoase cu o concentraţie în zahăr care reprezintă cca 2/3 din greutatea totală a soluţiei. Concentraţia mare de zahăr are drept scop mascarea gustului dezagreabil al unor substanţe active, pentru creşterea vâscozităţii mediului de dispersie sau cu scopul de a asigura conservarea preparatelor farmaceutice, ştiut fiind că o concentraţie mare de zahăr nu va permite dezvoltarea microorganismelor.
Industrial sunt considerate siropuri preparatele care au cel puţin 40%(g/g) conţinut în zahăr.
Siropurile înscrise în Farmacopeea Româna ediţia X a nu se eliberează în farmacie ca atare ci se folosesc la obţinerea unor soluţii de uz intern pe baza reţetelor magistrale.
În grupul siropurilor medicamentoase intră conform definiţiei acele preparate care conţin zahăr, dar noţiunea s-a extins şi în cazul soluţiilor pentru bolnavii de diabet la care zahărul se înlocuieşte cu edulcoranţi de sinteză: zaharină sodică, ciclamat sodic şi aspartam sodic.
În industria farmaceutică se condiţionează sub formă de granule, pulberi sau concentrate, preparate care servesc pentru obţinerea siropurilor “extempore”. Sunt
59
de fapt preparate care se dizolvă sau se diluează cu apă distilată sau soluţii extractive obţinându – se astfel preparatul ce urmează a fi administrat. Astfel, se condiţionează antibioticele de uz pediatric, ştiind că sunt substanţe cu o labilitate chimică a moleculei.
Aceste formulări au fost introduse în terapie datorită avantajelor pe care le prezintă:
-au gust dulce, aromat, miros plăcut calităţi care le fac să fie uşor acceptate de către copii;
-posibilitatea asocierii multor substanţe medicamentoase;
-conservarea este asigurată prin conţinutul mare în zahăr;
-prezintă o biodisponibilitate superioară faţă de formele farmaceutice solide;
-au valoare nutritivă crescută.
Dintre dezavantaje menţionăm că acestea sunt date de grupul din care fac parte, respectiv soluţii deci prezintă o stabilitate redusă pentru unele substanţe medicamentoase având în vedere că sunt medii apoase, iar volumul şi greutatea mare le fac greu de manipulat şi depozitat.
9.1.2. Clasificarea siropurilor
O clasificare a siropurilor se realizează după mai multe criterii: a). după conţinutul lor:
- care nu conţin substanţe medicamentoase - siropul simplu;
-care conţin o singură substanţă medicamentoasă
-care conţin două sau mai multe substanţe active; b). după modul de preparare
-siropuri obţinute prin dizolvarea zahărului la cald sau la rece în apă sau soluţii extractive;
-siropuri obţinute prin amestecarea siropului simplu cu diverse soluţii medicamentoase;
c). după rolul lor în formularea preparatului farmaceutic:
-siropuri medicamentoase;
-siropuri aromatizante, folosite ca şi corectori de gust şi miros; d). după modul de formulare:
-oficinale care sunt înscrise în Farmacopeea Română ediţia a X a;
-industriale.
e). după acţiunea terapeutică:
-expectorante;
-sedative;
-purgative;
-tonice – vitaminizante;
-antiparazitare etc.
60
