
- •Глава 3. Диагностика и лечение местной и генерализованной хирургической инфекции к.В. Кононенко
- •3.1. Абсцесс мягких тканей
- •Хирургическая тактика
- •Реабилитация
- •3.2. Гематогенный и посттравматический остеомиелиты
- •Хирургическая тактика
- •Реабилитация больных
- •Травматический остеомиелит
- •Реабилитация
- •Хронический остеомиелит
- •Хирургическая тактика
- •Реабилитация
- •3.3. Гидраденит
- •Реабилитация
- •3.4. Лимфаденит
- •Прогноз
- •Реабилитация
- •3.5. Мастит
- •Реабилитация
- •3.6. Панариций
- •Реабилитация
- •3.7. Флегмона мягких тканей
- •Хирургическая тактика
- •Реабилитация
- •3.8. Фурункул
- •Реабилитация
- •3.9. Карбункул
- •Хирургическая тактика
- •Реабилитация
- •3.10. Хирургический сепсис
- •Реабилитация
Реабилитация
При сопутствующем сахарном диабете благоприятное влияние на течение гнойно-некротического процесса оказывают корригирующая диета, инсулинотерапия.
3.10. Хирургический сепсис
Проблема диагностики и лечения сепсиса остается на протяжении многих десятилетий одной из самых сложных и наиболее актуальных задач медицинской науки.
Интерес к сепсису обусловлен не только возрастающей его частотой во всем мире, не имеющими тенденции к снижению цифрами летальности, чрезвычайно высокими затратами на стационарное и реабилитационное лечение, но и тем, что сепсис занимает все большее место в структуре заболеваний стационара любого клинического профиля как внутрибольничная инфекция.
Частота развития сепсиса в различных стационарах существенно разнится и зависит от профиля лечебного учреждения.
Общепринятым на сегодня является факт, что развитие синдрома системного ответа на воспаление (инфекцию) не является специфичным только для сепсиса.
Подобная реакция наблюдается и при целом ряде других заболеваний и повреждений. И.А. Ерюхин и соавт. (1998, 2000) считают, что политравма осложняется сепсисом в 30%, а лейкозы и злокачественные лимфомы - в 24% случаев.
Факторами риска развития сепсиса, по мнению В.Б. Белобородова (2000), являются:
• предрасполагающие состояния: нейтропения, онкологическая патология, диспротеинемия, цирроз печени, сахарный диабет, ВИЧ-инфекция и тяжелые хронические заболевания;
• операции или инвазивные процедуры, катетеризации;
• применение ряда препаратов: иммуносупрессоров, антибиотиков широкого спектра действия;
• возраст: мужчины старше 40 лет и женщины в возрасте 20-45 лет;
• предрасполагающие состояния: роды, септические аборты, травмы, обширные ожоги, язвенные поражения желудочно-кишечного тракта.
В.Б. Белобородов (2000) выделяет также факторы, способствующие повышению заболеваемости сепсисом. К ним относят:
• агрессивную химиотерапию и лучевую терапию онкологических заболеваний;
• возрастающее применение кортикостероидных и иммуносупрессивных препаратов у пациентов с небактериальными воспалительными заболеваниями и трансплантацией органов;
• динамику демографических показателей: увеличение продолжительности периода высокого риска возникновения сепсиса - выхаживание новорожденных с высокой степенью недоношенности, увеличение продолжительности жизни и количества пожилых лиц, онкологических больных и пациентов с нарушенной функцией жизненных органов, сахарным диабетом и гранулоцитопенией;
• развитие медицины: расширенное использование инвазивных устройств - хирургических эндопротезов, оборудования для дыхательной и ингаляционной терапии, внутрисосудистых и мочевых катетеров, парентерального питания;
• бессистемное использование антимикробных препаратов, которое создает условия для размножения, колонизации и развития инфекции более агрессивными и резистентными к антибиотикам микроорганизмами.
В стационарах хирургического профиля частота развития сепсиса составляет около 10%, в отделениях реанимации и интенсивной терапии она возрастает до 18%. По данным С.В. Яковлева (2004), число больных сепсисом с 1974 по 2003 гг. в США увеличилось более чем вдвое - с 300 до 700 тыс.
Экономические затраты на стационарное лечение больного сепсисом составляют от 40 тыс. до 81 тыс. $, а стоимость реабилитационного лечения доходит до 150 тыс. $.
По мнению ряда авторов, летальность больных сепсисом колеблется от 26,6 до 50% в хирургическом стационаре и достигает 80% в отделениях реанимации и интенсивной терапии.
Своевременная диагностика сепсиса имеет решающее значение. Так, в США диагноз «Сепсис» унифицирован и регистрируется во всех случаях, если у больного с установленным очагом инфекции (при наличии документированной бактериемии или без нее) одновременно имеются два или более признаков системной воспалительной реакции.
Таблица 3-1. Определения понятия «сепсис», наиболее часто встречающиеся в отечественной литературе

Слово «sepsis» греческого происхождения, означает гниение, разложение, ассоциируется с болезнью и смертью, впервые упоминается в IXX песне «Илиады» Гомера, создание которой относится к VIII-VII векам до н.э. Сам термин «sepsis» впервые предложен Аристотелем в IV веке до н.э.
В отечественной и зарубежной литературе встречаются несколько определений понятия «сепсис», несущих различную смысловую нагрузку. Некоторые наиболее часто встречающиеся в отечественной литературе определения понятия «сепсис» представлены ниже (табл. 3-1).
Разночтения в понимании целого ряда определений и понятий, невозможность сравнения проводимых исследований по проблеме сепсиса, постоянная путаница в терминах привели к необходимости создания единой стандартизованной терминологии.
КЛАССИФИКАЦИЯ
Этому вопросу были посвящены международная конференция хирургов в Фулертоне (1986) и американская конференция «согласия» колледжа торакальных хирургов и врачей-интенсивистов в Чикаго (1991) под председательством R.G. Bone. Именно эта конференция стала своеобразным «рубежом» в познании сущности сепсиса как общемедицинской проблемы.
Благодаря координации усилий по изучению сепсиса путем создания межнациональных рабочих групп, организующих проведение многоцентровых исследований, в настоящее время в США и Европе используется классификация, принятая на Чикагской конференции «согласия».
Рекомендации РАСХИ по интенсивной терапии сепсиса (Калуга, Москва, 2004) утвердили данную классификацию как рабочую классификацию сепсиса. Единая стандартизованная терминология (рабочая классификация сепсиса) приведена в табл. 3-2.
Таблица 3-2. Современная рабочая классификация сепсиса
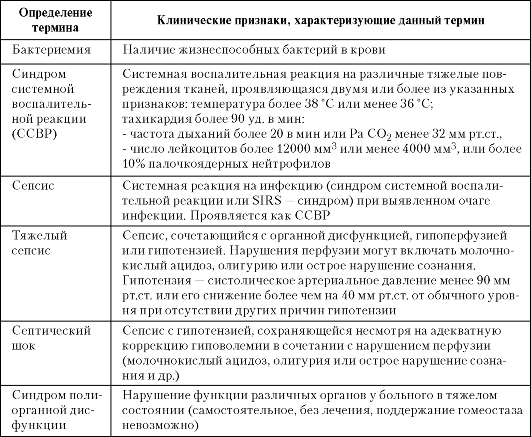
Таким образом, до 2004 г. имелись существенные разночтения в понимании определения понятия «сепсис» - от «определяемой в крови бактериемии» и «неадекватной гиперергической реакции» до «инфекционного заболевания» и «общей гнойной инфекции».
Введение единой терминологии определения различных клинических состояний, связанных с сепсисом, способствовало выработке единого языка общения врачей-клиницистов и более четкой регистрации частоты развития сепсиса.
Кроме приведенной выше рабочей классификации сепсиса существуют и несколько классификаций только хирургического сепсиса. Сводная классификация хирургического сепсиса (А.М. Светухин и соавт., 1995, В.Л. Белянин и М.Г. Рудакова, 2004) приведена ниже.
Классификация хирургического сепсиса
По наличию первичного очага:
• первичный или криптогенный (без установленного источника сепсиса);
• вторичный (при наличии источника сепсиса).
По виду микроба-возбудителя:
• аэробный [Грам (+) и Грам (-)];
• анаэробный (клостридиальный и неклостридиальный);
• смешанный (аэробно-анаэробный).
По клиническому течению:
• молниеносный - острейший (до 1 суток);
• острый (до 14 суток);
• подострый (от 2 до 12 недель);
• хронический-рецидивирующий (более 3 месяцев).
По локализации первичного очага:
• хирургический;
• одонтогенный;
• гинекологический;
• урологический;
• отогенный.

Рис. 3-7. Классификация хирургического сепсиса
Эта классификация незаменима для практической медицины: она подразделяет сепсис по виду возбудителя, что является крайне важным при определении тактики проведения патогенетической антибиотикотерапии.
Классификация хирургического сепсиса по локализации первичного очага предложена В.С. Савельевым и Б.Р. Гельфандом (2000) (рис. 3-7).
Значительную роль в понимании сущности сепсиса сыграли исследования ряда отечественных и зарубежных ученых, предложивших несколько теорий развития сепсиса.
Еще Н.И. Пирогов (1865) высказывал гениальное предположение об обязательном участии в развитии септического процесса определенных активных факторов, при проникновении которых может наступить септицемия. «...При дальнейшем прогрессе науки нам придется только вникнуть в свойство неизвестного деятеля...» В 1914 г. H. Schottmuller предложил микробную теорию развития сепсиса. И.В. Давыдовский (1928, 1933-1961) в ряде своих работ выдвинул макробиологическую теорию возникновения сепсиса. Г.Н. Сперанский (1937) и А.В. Вишневский (1950) считали, что в основе развития сепсиса лежит нейротрофическая теория. А.П. Авцын (1944), Н.И. Блинов (1952) и В.С. Савельев (1976) доказали, что причиной развития сепсиса служат выделяющиеся при его развитии токсины (токсическая теория). Наконец, R.G. Bone (1992, 1996) выдвинул цитокиновую теорию возникновения сепсиса.
Таблица 3-3. Предполагаемые медиаторы сепсиса

В работах С.П. Глянцева (1998), R.G. Bone (1991, 1992), B. Henderson et al. (1996) и R.G. Holzheimer (1998) убедительно показано, что сепсис является результатом высвобождения целого ряда цитокинов - медиаторов повреждения эндотелия.
По данным Л.В. Ковальчука и Н.Н. Малиновского (1997), медиаторы сепсиса и их физиологическое воздействие на организм больного приведены в табл. 3-3.
Развитие системной реакции на воспаление или SIRS-синдрома является неспецифическим ответом макроорганизма на внедрение любого вида инфекции (бактериальной, вирусной или грибковой).
Бактериологическая характеристика хирургического сепсиса представлена практически всеми существующими патогенными и условнопатогенными бактериями - это стафилококки, стрептококки, кишечная палочка, грибы рода Candida, синегнойная палочка, протейные бактерии, анаэробная клостридиальная и неклостридиальная микрофлора.
ЭТИОЛОГИЯ
До настоящего времени стафилококки (Staphylococcus aureus, Staphylococcus saprophiticus иStaphylococcus epidermidis) остаются основными возбудителями сепсиса. Удельный вес стафилококков в развитии сепсиса составляет 39-45%. Стафилококки в 47,6% наблюдений являются причинной флорой развития сепсиса в монокультуре и у 10,7% больных в ассоциации с другими условно-патогенными микроорганизмами. Среди стафилококков в 30,1% случаев при сепсисе из первичного очага высеваются стафилококки, принадлежащие видуStaphylococcus aureus.
Значительно реже возбудителями сепсиса являются стрептококки. Из них наибольшее значение имеют Streptococcus pyogenes иStreptococcus viridans.
В развитии сепсиса большое значение имеют и бактерии семейства Enterobacteriaceae, которые достаточно часто встречаются в симбиозе с вышеописанными возбудителями. Известно, чтоЕ. coli играет важную роль в жизнедеятельности организма. Однако попадание условно-патогенной кишечной палочки за пределы кишечника и инфицирование брюшной полости может быть причиной развития сепсиса.
Широкое применение антибиотиков привело к увеличению за последнее время случаев кандидозной инфекции и кандидозного сепсиса, возбудителями которого являются Candida albicans иCandida tropicalis. Генерализация процесса обусловлена выделением грибами токсических субстанций. Грибы видаCаndida нечувствительны ко многим широко используемым препаратам.
Сепсис, вызванный синегнойной палочкой, обычно развивается по типу молниеносного, с выраженной шоковой реакцией. С учетом незначительной чувствительности синегнойной палочки к антибактериальным препаратам лечение синегнойного сепсиса чрезвычайно затруднено. В то же время этот возбудитель играет важную роль и в развитии госпитальной инфекции.
Специфичную группу микроорганизмов, вызывающих сепсис, представляют клостридиальные и некостридиальные анаэробы. Считается, что около 65-80% хирургической инфекции несет в себе анаэробный компонент.
Клинически значимыми возбудителями клостридиальной анаэробной инфекции являются Clostridium perfringens, Clostridium oedematiens, Clostridium septicum иClostridium histoliticum. Все они способны образовывать большие количества экзотоксина, оказывающего мио- и нейротропное действие.
Не вызывает сомнения целесообразность включения в понятие «анаэробная инфекция» и инфекции, вызываемой группой возбудителей, не относящихся к клостридиям и являющихся неспорообразующими анаэробами семейства Bacteroides. Наиболее частыми возбудителями инфекции из патогенных анаэробов являются бактероиды и фузобактерии. Инфекция с участием бесспоровых облигатных анаэробов всегда протекает достаточно тяжело и требует интенсивных и адекватных методов лечения. По мнению A.M. Светухина (1989), эта же особенность относится и к сепсису, развившемуся с участием неклостридиальной анаэробной флоры.
Полимикробная ассоциация анаэробов - одна из основных этиологических особенностей газовой инфекции. Однако в каждом случае определенный вид микроорганизма является преобладающим и накладывает отпечаток на клинические проявления заболевания.
Раннее распознавание сепсиса имеет первостепенное значение, и роль этого факта трудно переоценить. Трудности диагностики обусловлены тем, что ни жалобы больного, ни клинические признаки сепсиса в отдельности не являются специфическими. Высевание микроорганизмов из крови при наличии входных ворот или первичного очага является подтверждением диагноза. По данным В.К. Гостищева и соавт. (1993), проводивших большие «многоцентровые» исследования, частота «положительных» посевов крови при сепсисе составляет от 30-50% до 80%.
В клинической картине сепсиса выделяют часто встречающиеся симптомы: лихорадку, ознобы, миалгии, повышенный лейкоцитоз, эозинопению и менее часто встречающиеся проявления - ступор, кома, кровотечения из верхних отделов пищеварительного тракта, лейкопения, тромбоцитопения, гипотермия. При сепсисе наблюдаются местные (локальные) признаки инфекции (изменения в первичном очаге), системные (типичные) проявления инфекции и атипичные неспецифические проявления инфекционного процесса, связанные с измененной реактивностью организма больного на фоне тяжелой сопутствующей патологии.
КЛИНИЧЕСКАЯ КАРТИНА
Главной особенностью сепсиса является наличие первичного и вторичных пиемических гнойных очагов. При явном гнойном очаге и соответствующей клинической картине диагноз сепсиса поставить сравнительно легко.
Если видимых гнойных очагов нет, а имеются системные проявления инфекции, может возникнуть предположение о первичном или «криптогенном» сепсисе (А.М. Светухин и соавт., 1995). Причинами развития «криптогенного» сепсиса у больных хирургического стационара могут быть не только часто встречающиеся в практике отделения гнойной хирургии воспалительные заболевания мягких тканей (нагноение послеоперационной раны, постинъекционные абсцессы и флегмоны), но и пневмония, плеврит, эмпиема плевры, эндопластит, пиелонефрит, абсцессы печени, селезенки, забрюшинные флегмоны, септический тромбофлебит подключичной вены («катетер - ассоциированный» сепсис), лекарственная болезнь, септический эндокардит и т.д.
Лабораторные критерии сепсиса (как и клинические) также не имеют патогномоничных признаков, хотя порой являются ценным дополнением клинической картины.
ЛЕЧЕНИЕ
При подозрении на сепсис показана экстренная госпитализация в хирургическое отделение. Лечение больных сепсисом и септическим шоком проводится в отделениях реанимации и интенсивной терапии или при отсутствии последних в специализированных палатах интенсивной терапии профильных отделений (Б.Р. Гельфанд и соавт., 1999, 2000, D.S. Malcolm et al., 1990, J. Salvo et al., 1995, P. Haraldsen et al., 1998).
Согласно методическим рекомендациям Российской ассоциации специалистов по хирургической инфекции (РАСХИ) по интенсивной терапии сепсиса (Калуга, Москва, 2004) она подразделяется на приоритетную (радикальная санация первичного очага сепсиса, антибактериальная терапия, мероприятия, направленные на восстановление тканевой перфузии, искусственная нутритивная поддержка, селективная деконтаминация кишечника) и дополнительную, куда включают заместительную иммунотерапию (иммуноглобулины А, М, G или пентаглобин), дискретный плазмаферез при развитии полиорганной недостаточности и назначение препаратов, направленных на коррекцию гемокоагуляции.
«Краеугольным камнем» лечения сепсиса является хирургическая санация первичного и вторичных гнойных очагов в условиях хирургического стационара.
В основе санации первичного и вторичных очагов сепсиса лежит активная хирургическая тактика, суть которой подробно описана выше.
Не менее важна роль адекватной антибактериальной терапии.
Общим правилом антибактериальной терапии сепсиса считается использование «ступенчатой» антибактериальной терапии - вначале «стартовой» до получения результатов бактериологического анализа крови, затем этиотропной или патогенетической и поддерживающей (назначение антибактериальных препаратов в таблетированной форме).
Рекомендации РАСХИ (Калуга, Москва, 2004) по антибактериальной терапии сепсиса с неустановленным первичным очагом приведены в табл. 3-4.
Таблица 3-4. Рекомендации РАСХИ по антибактериальной терапии сепсиса с неустановленным первичным очагом
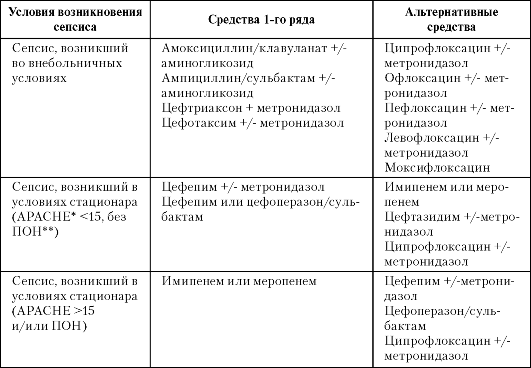
Примечание. APACHE* - Acute Physiology And Chronic Health Evaluation - шкала оценки острых и хронических функциональных нарушений. ПОН** - полиорганная недостаточность.
Интенсивная терапия при сепсисе направлена на устранение возникающей органной дисфункции и проводится безотлагательно.
Ее целями являются достижение следующих показателей: ЦВД - 8-12 мм рт.ст.; АД ср > 65 мм рт.ст.; диурез > 0,5 мл/кг/час и насыщение кислородом (сатурация) смешанной венозной крови > 70%. В случае если не удается добиться сатурации смешанной венозной крови > 70% при ЦВД 8-12 мм рт.ст., следует начинать трансфузию эритроцитарной массы до достижения уровня гематокрита >30% и/или инфузию допамина/добутамина.
Респираторная поддержка включает в себя повышение содержания кислорода во вдыхаемом воздухе и использование ИВЛ для поддержания постоянного положительного давления в конце выдоха (ППДКВ) в течение всего дыхательного цикла (Б.Р. Гельфанд и соавт., 2000, 2002). Начало снижения параметров респираторной поддержки возможно при регрессе патологического процесса в легких (острого респираторного дистресс-синдрома взрослых (ОРДС)или пневмонии) и устранения септического очага, поддерживающего системную воспалительную реакцию. «Отучение» от вентилятора необходимо проводить строго по протоколу.
Адренергические препараты при сепсисе используют для улучшения тканевого перфузионного давления, повышения сократимости миокарда и коррекции нарушений микроциркуляции (Б.Р. Гельфанд и соавт., 2000, 2002, W.A. Lynn et al., 1995).
Особое значение при развитии сепсиса следует уделять проблеме полноценного питания больных сепсисом. При сепсисе происходит сдвиг обмена веществ с усилением катаболических процессов, что сопровождается стойким снижением или полным отсутствием аппетита, быстрой потерей массы тела и неизбежным развитием истощения (И.Л. Лейдерманн и соавт., 2002).
Метод деконтаминации желудочно-кишечного тракта с использованием антибактериальных препаратов селективного спектра действия в хирургии применяют сравнительно недавно последние 25-30 лет.
«Механизм действия» СДК заключается в устранении энтерогенного источника инфицирования и/или реинфицировании больных при минимальном воздействии на собственную колонизационную резистентность организма, представленную непатогенными анаэробами.
В этой связи препаратами выбора являются тобрамицин (гентамицин) - 320 мг/сут, полимиксин Е (колистин) или М - 400 мг/сут, амфотерицин В - 2000 мг/сут (Б.Р. Гельфанд и соавт., 2000).
Таким образом, использование комплекса приоритетных методов лечения дает возможность коррегировать возникшие тяжелые, характерные для сепсиса и полиорганной недостаточности нарушения гомеостаза и предотвратить развитие нозокомиальной инфекции.
Профилактика образования стресс-язв желудочно-кишечного тракта основывается на профилактическом применении блокаторов H2-рецептов и ингибиторов протонной помпы, которые снижают риск осложнений.
Профилактика тромбоза глубоких вен существенно влияет на результаты лечения больных сепсисом. С этой целью могут использоваться как нефракционированный гепарин, так и препараты низкомолекулярного гепарина (НМГ). При этом эффективность и безопасность НМГ выше, чем нефракционированного гепарина.

Рис. 3-8. Классификация ятрогенного сепсиса
Особого внимания заслуживает сепсис, возникающий у больных как следствие инфекционных осложнений и выполняемых диагностических или лечебных процедур - так называемый ятрогенный сепсис.
Частота развития ятрогенного сепсиса составляет (В.С. Савельев и соавт., 2000, 2003) около 20%, его характеризуют тяжелое клиническое течение и опасный прогноз.
По классификации академика В.С. Савельева и соавт. (2000), в клинической практике выделяют виды ятрогенного сепсиса, приведенные на рис. 3-8.
Причинами развития контактного и манипуляционного ятрогенного сепсиса являются нарушение санитарногигиенического и противоэпидемического режима в отделениях анестезиологии, реанимации и и интенсивной терапии (ОРИТ) и перевязочной хирургического отделения.
В ОРИТ следует строго соблюдать принцип «одна сестра - один больной»; в перевязочной хирургического отделения необходимо использовать одноразовый инструментарий, медперсонал должен тщательно мыть руки после каждой процедуры, выполненной пациенту, и работать в перчатках.
Под ангиогенным ятрогенным сепсисом следует понимать развитие системной воспалительной реакции на инфицированные тромботические массы (первичный очаг), которые формируются в мелких артериолах и венулах при миграции («отрыве») участка тромба при варикозной болезни поверхностных вен, инфицировании микротромбов при атеросклерозе, неспецифическом аорто-артериите и сахарном диабете. Причиной инфицирования часто являются малоинвазивные и инвазивные медицинские манипуляции - пункции артерий и вен для введения лекарственных средств и выполнение диагностических исследований - артериография, венография и т.д.
Особо следует остановиться на развитии ангиогенного сепсиса после внутривенного введения наркотических средств, который, к большому сожалению, не является редкостью в последнее время. В этих случаях имеет место «классический» вариант сепсиса, по определению древних греков и Аристотеля, истинное «гнилокровие».
Этиологическим фактором возникновения хирургического ятрогенного сепсиса (С.В. Яковлев и соавт., 2003) наиболее часто является грамположительная кокковая флора, резистентная к большинству используемых антибиотиков. При этом большая часть этого вида сепсиса вызывается ассоциацией микроорганизмов. Выявление одного вида возбудителя может быть связано либо с явным преобладанием его в ассоциации или с несовершенством методов бактериологической диагностики. При этом следует помнить о присутствии в выделяемой микрофлоре анаэробных микроорганизмов, не всегда определяемых в бактериологических лабораториях многих стационаров.
Основной причиной возникновения катетер-ассоциированного ятрогенного сепсиса является пункция и катетеризация периферической или центральной вены и установка в них катетера.
Входными воротами или первичным очагом катетер-ассоциированного сепсиса могут служить недостаточно обработанная инфицированная кожа (операционное поле); раневой (катетерный) канал, по которому введен катетер и сам установленный в периферическую или центральную вену катетер.
Лечение ятрогенного сепсиса - задача особой сложности, поскольку причиной его развития являются, как правило, антитибиотикорезистентные штаммы микроорганизмов, определяющиеся в данном отделении. Лечение больных ятрогенным сепсисом следует проводить в отделениях реанимации и интенсивной терапии.
Основные методы интенсивной терапии ятрогенного сепсиса существенно не отличаются от описанных выше. Особенностью при подборе антибактериальной терапии является обязательное использование данных мониторинга за изменением микрофлоры в ОРИТ. Предпочтение следует отдавать моноантибактериальной «широкозахватной» терапии сепсиса с учетом данных микробиологического мониторинга.
Профилактика развития катетер-ассоциированного сепсиса заключается в соблюдении асептики при установке катетера (работа только в стерильных перчатках и одноразовыми инструментами):
• ежедневной обработке кожи вокруг катетера;
• использовании прозрачных стерильных пленок с нанесенными на них антисептиками для фиксации катетера, замене катетера через 5-7 суток;
• при появлении малейших признаков нагноения: гиперемии кожи, болезненности при пальпации в области катетера необходимы тщательный осмотр места установки катетера и по показаниям - толстоигольная пункция формирующейся паравазальной флегмоны (возможного очага) и/или сонографическое исследование этой области с последующей санацией гнойного очага.
По данным В.С. Савельева и соавт. (2000), в экономически развитых странах (США, Канада, Япония, Франция, Германия, Израиль и ряд других) летальность при ятрогенном сепсисе за последние 30 лет снизилась с 60% до 40%.
Сроки нетрудоспособности при данной патологии чрезвычайно вариабельны, 40-50% больных стойко утрачивают трудоспособность и переходят на инвалидность. У большинства пациентов временная нетрудоспособность колеблется от 18 до 20 недель.
