
- •Введение
- •Содержание разделов дисциплины
- •Тема 2.2 Термодинамика
- •Тема 2.3 Реальные газы
- •Тема 2.4 Свойства жидкостей и твердых тел
- •Раздел 3. Электричество и магнетизм
- •Тема 3.1 Элементы электростатики
- •Тема 3.2 Постоянный электрический ток
- •Задания для самостоятельной работы студентов и методические указания по их выполнению
- •Основные формулы
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Основные формулы
- •Примеры решения задач
- •Способ 2
- •Задачи для самостоятельного решения
- •Элементы электростатики Основные формулы
- •Примеры решения задач
- •Задачи для самостоятельного решения Взаимодействие точечных зарядов. Закон Кулона
- •Напряженность электрического поля
- •Потенциал поля точечных зарядов. Работа по перемещению зарядов в поле
- •Движение заряженных частиц в электрическом поле
- •Электрическая емкость. Конденсаторы
- •Энергия электрического поля
- •Постоянный электрический ток Основные формулы
- •Сила тока I
- •Сопротивление однородного проводника r
- •Сопротивление соединения проводников:
- •Закон Ома
- •Примеры решения задач
- •Задачи для самостоятельного решения Закон Ома для участка цепи
- •Закон Ома для всей цепи
- •Правила Кирхгофа
- •Работа и мощность тока
- •Электромагнетизм Основные формулы
- •Принцип суперпозиции (наложения) магнитных полей
- •Закон Био-Савара-Лапласа
- •Закон электромагнитной индукции
- •Индуктивность контура с током
- •Объемная плотность энергии магнитного поля
- •Примеры решения задач
- •Механические колебания и волны Основные формулы
- •Примеры решения задач
- •Задачи для самостоятельного решения Кинематика гармонических колебаний
- •Волны в упругой среде
- •Электромагнитные колебания и волны Основные формулы
- •Формула Томсона
- •Связь длины электромагнитной волны с периодом т и частотой колебаний
- •Скорость электромагнитной волны в среде с диэлектрической проницаемостью и магнитной проницаемостью
- •Задачи для самостоятельного решения
- •Геометрическая оптика и фотометрия Основные формулы
- •Примеры решения задач
- •Задачи для самостоятельного решения Геометрическая оптика
- •Фотометрия
- •Тепловое излучение, квантовые свойства света Основные формулы
- •Закон Кирхгофа
- •Примеры решения задач
- •Задачи для самостоятельного решения Закон Стефана-Больцмана. Закон Вина
- •Фотоэлектрический эффект
- •Строение атома Резерфорда – Бора Основные формулы
- •Задачи для самостоятельного решения
- •Строение ядра атома Основные формулы
- •Задачи для самостоятельного решения
- •Основные единицы физических величин си
- •Множители и приставки для образования десятичных кратных и дольных единиц
- •Основные физические постоянные
- •Литература
- •Содержание
Способ 2
Применяя уравнение Клапейрона - Менделеева, получим те же результаты.
![]()
откуда
![]() ,
,
![]() .
.
Вычисляя, получим
![]()
![]()
Проверка размерностей:
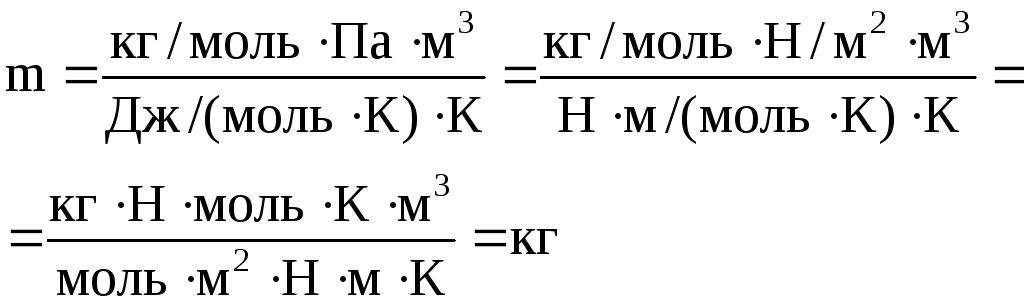
Ответ:
![]() ,
,
![]() .
.
Пример
4. В баллоне содержится кислород массой
![]() г
и аргон массой
г
и аргон массой
![]() г.
Давление смеси
г.
Давление смеси
![]() МПа,
температура
МПа,
температура
![]() К.
Определить емкость
К.
Определить емкость
![]() баллона.
баллона.
|
Дано: |
Решение: |
|
Для кислорода:
для аргона
|
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Поэтому, выражая каждое из парциальных давлений из уравнения Менделеева – Клапейрона, получим
Откуда емкость баллона: |
|
|
![]()
Вычисляя, получим:
![]() .
.
Проверка размерностей:
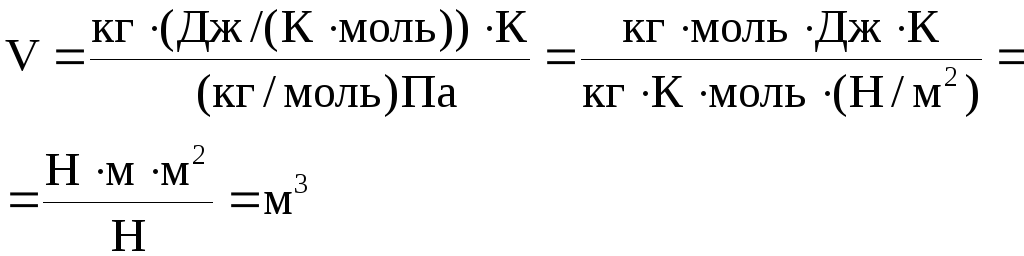 .
.
Ответ:
![]() .
.
Пример 5. В баллоне емкостью 10 л находится гелий под давлением 1 МПа при температуре 300 К. После того как из баллона было взято 10 г гелия, температура в баллоне понизилась до 290 К. Определить давление газа, оставшегося в баллоне.
|
Дано: |
Решение: |
|
|
Очевидно, что после того, как из баллона было взято 10 г газа, оставшаяся масса газа занимает тот же объем 10 л.
Поэтому
Для конечного состояния запишем уравнение Менделеева - Клапейрона |
|
|
![]() ,
,
из
которого выразим неизвестное
![]() :
:
![]()
Найдем
массу
![]() (также из уравнения Менделеева - Клапейрона
для начального состояния)
(также из уравнения Менделеева - Клапейрона
для начального состояния)
![]() и подставим в выражение для
и подставим в выражение для
![]() .
Получим:
.
Получим:![]()
После
преобразований имеем:
![]()
![]()
Проверка размерностей:
![]()
![]()
Ответ:
![]()
Пример 6. В резервуаре объемом 1,2 м3 находится смесь 10 кг азота и 4 кг водорода при температуре 300 К. Определить давление и молярную массу смеси газов.
|
Дано: |
Решение: |
|
|
По закону Дальтона
где
|
|
|
Молярная масса смеси газов определяется следующей формулой
![]()
где
![]() - количество молей азота,
- количество молей азота,
![]() - водорода.
- водорода.
Вычислим
![]() и
и
![]() .
.
![]() ,
,
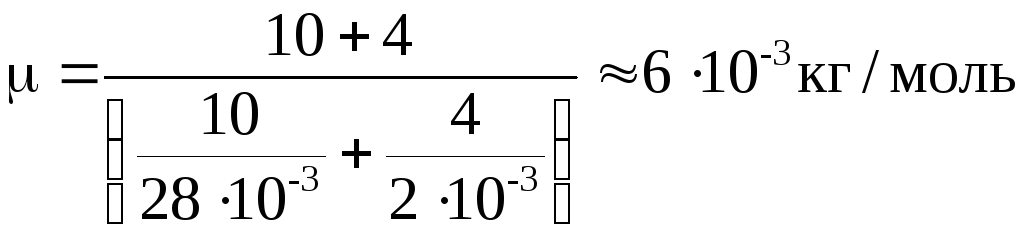 ,
,
Проверка размерностей:
![]()
![]()
![]() .
.
Ответ:
![]() ;
;
![]()
Пример 7. Для газа, давление которого 750 мм рт. ст.и температура 27оС, определить концентрацию молекул и среднюю кинетическую энергию поступательного движения одной молекулы.
|
Дано: |
Решение: |
|
|
Средняя кинетическая энергия движения одной молекулы:
Для
поступательного движения
|
|
|
Концентрацию
молекул
![]() найдем из уравнения
найдем из уравнения
![]() .
.
![]()
Произведем вычисления:
![]()
![]()
Проверка размерностей:
![]() ;
;
![]()
Ответ:
![]() ;
;
![]() .
.
Пример 8. Найти средние кинетические энергии поступательного и вращательного движения молекул, содержащихся в 2 кг водорода при температуре 400 К.
|
Дано: |
Решение: |
|
|
Средняя кинетическая энергия движения молекулы:
где
|
|
|
Молекула
водорода двухатомная. Число степеней
свободы молекулы водорода равно 5.
Поступательному движению соответствует
три степени свободы
![]() ,
вращательному – две
,
вращательному – две
![]() .
Тогда средняя кинетическая энергии
одной молекулы будет:
.
Тогда средняя кинетическая энергии
одной молекулы будет:
а)
для поступательного движения -
![]() ;
;
б)
для вращательного движения -
![]() .
.
Для
нахождения кинетической энергии
поступательного и вращательного движения
всех молекул необходимо найти число
молекул
![]() в газе массой
в газе массой
![]() .
.
![]() ,
,
где
![]() - число молей,
- число молей,
![]() - постоянная Авогадро. Тогда средняя
кинетическая энергия движения молекул
водорода будет:
- постоянная Авогадро. Тогда средняя
кинетическая энергия движения молекул
водорода будет:
- для поступательного движения –
![]() ;
;
-
для вращательного движения –
![]() ,
,
где
![]() - молярная газовая постоянная.
- молярная газовая постоянная.
Вычисления:
![]() ,
,
![]() .
.
Проверка размерностей:
![]() .
.
Ответ:
![]() ;
;
![]() .
.
Пример 9. Газ, занимавший объем 20 л при нормальных условиях, был изобарически нагрет до 80оС. Определить работу расширения газа.
|
Дано: |
Решение: |
|
Нормальные условия:
|
Работа
расширения газа при изобарическом
процессе определяется по формуле:
Число
молей
|
|
|
![]() ,
откуда
,
откуда
![]() .
Тогда:
.
Тогда:
![]()
![]() .
.
Проверка размерностей:
![]()
Ответ:
![]() .
.
Пример 10. Азот массой 2 кг охлаждают при постоянном давлении от 400 К до 300 К. Определить изменение внутренней энергии, внешнюю работу и количество выделенной теплоты.
|
Дано: |
Решение: |
|
|
При
изобарическом процессе при сообщении
газу массой
при
этом количество теплоты
|
|
|
![]() .
.
Здесь
![]() - молярная теплоемкость при постоянном
объеме,
- молярная теплоемкость при постоянном
объеме,
![]() - молярная теплоемкость при постоянном
давлении, причем
- молярная теплоемкость при постоянном
давлении, причем
![]() ,
,
![]() ,
,
где
![]() - число степеней свободы молекул. Для
двухатомных молекул газов
- число степеней свободы молекул. Для
двухатомных молекул газов
![]() .
Поэтому
.
Поэтому
![]() ,(*)
,(*)
![]() .(**)
.(**)
Работа
газа при изменении объема от
![]() до
до
![]() при изобарическом процессе равна
при изобарическом процессе равна
![]() .
.
Выражение
для
![]() найдем, используя уравнение
Менделеева-Клапейрона для начального
и конечного состояний:
найдем, используя уравнение
Менделеева-Клапейрона для начального
и конечного состояний:
![]() ;
;
![]() .
.
Отсюда следует, что
![]() ,
,
а выражение для работы имеет вид:
![]() (***)
(***)
Вычислим
значения
![]() ,
,
![]() ,
,
![]() ,
см. выражения (*), (**), (***).
,
см. выражения (*), (**), (***).
![]()
![]()
![]()
Несложно
заметить, что одна из трех физических
величин
![]() ,
,
![]() ,
,
![]() могла быть найдена по найденным значениям
двух других с использованием первого
начала термодинамики, т.е. с использованием
выражения
могла быть найдена по найденным значениям
двух других с использованием первого
начала термодинамики, т.е. с использованием
выражения
![]() .
.
Ответ:
![]() ,
,
![]() ,
,
![]() .
.
Пример
11. Определить удельные теплоемкости
![]() и
и
![]() для смеси 1 кг азота и 1 кг гелия.
для смеси 1 кг азота и 1 кг гелия.
|
Дано: |
Решение: |
|
|
Удельной теплоемкостью газа называется величина, равная количеству теплоты, которое нужно сообщить единице массы тела, чтобы повысить его температуру на 1 градус.
Величина
теплоемкости зависит от условий, при
которых происходит нагревание: при
постоянном объеме (теплоемкость
|
|
|
А)
Нагревание при постоянном объеме.
Количество теплоты равно
![]() .
Отсюда
.
Отсюда
![]() ,
,
причем
![]() ,
т.е. все сообщаемое количество теплоты
идет на изменение внутренней энергии
системы, а работа по расширению газа
равна нулю (
,
т.е. все сообщаемое количество теплоты
идет на изменение внутренней энергии
системы, а работа по расширению газа
равна нулю (![]() ).
Изменение внутренней энергии смеси
газов определяется формулой:
).
Изменение внутренней энергии смеси
газов определяется формулой:
![]() .
.
Здесь
![]() ,
,
![]() - число степеней свободы первого и
второго газов. Окончательно получим:
- число степеней свободы первого и
второго газов. Окончательно получим:
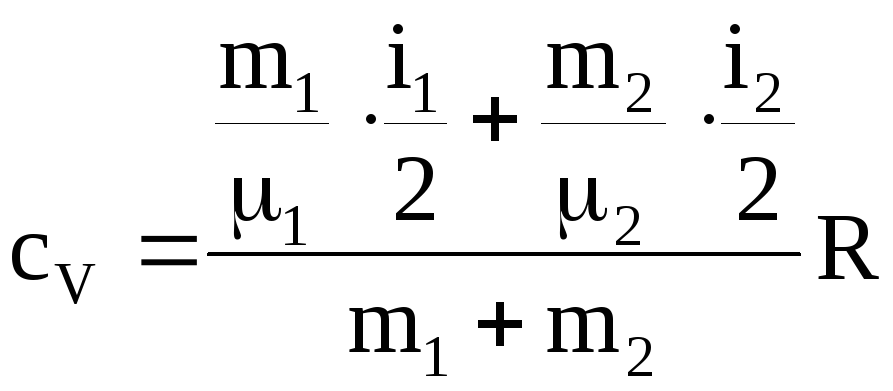 .
.
Б)
Нагревание при постоянном давлении.
Количество теплоты равно
![]() .
Отсюда
.
Отсюда
![]()
причем
![]() ,
т.е сообщаемое газу количество теплоты
идет не только на изменение внутренней
энергии, но и на работу по расширению
газа. При изобарическом расширении
работа для каждого из двух газов равна:
,
т.е сообщаемое газу количество теплоты
идет не только на изменение внутренней
энергии, но и на работу по расширению
газа. При изобарическом расширении
работа для каждого из двух газов равна:
![]() ,
,
![]() ,
,
![]()
Поэтому:
![]()
Выражение
для
![]() будет иметь вид:
будет иметь вид:
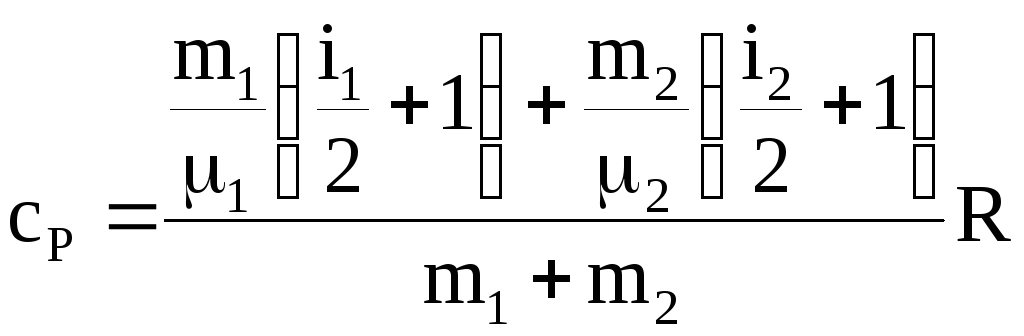
Вычислим
для условий задачи значения
![]() и
и
![]() :
:

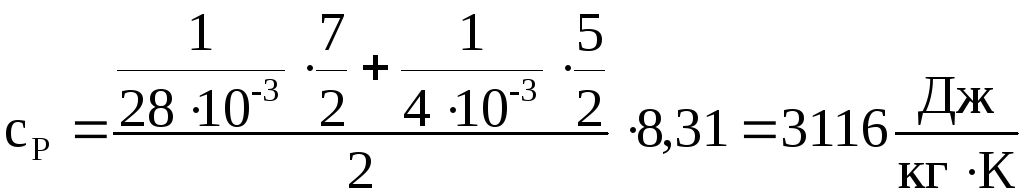
Проверка размерностей:
Ответ:
![]() ,
,
![]() .
.
Пример 12. Аргон при давлении 0,8 атм. изменил объем с 1л до 2 л. Найти изменении внутренней энергии для двух случаев: а) расширение было изобарическим; б) расширение было адиабатическим.
|
Дано: |
Решение: |
|
|
Согласно
первому началу термодинамики переданное
системе количество теплоты
|
|
|
А) Изобарическое расширение. Для изменения внутренней энергии можно записать
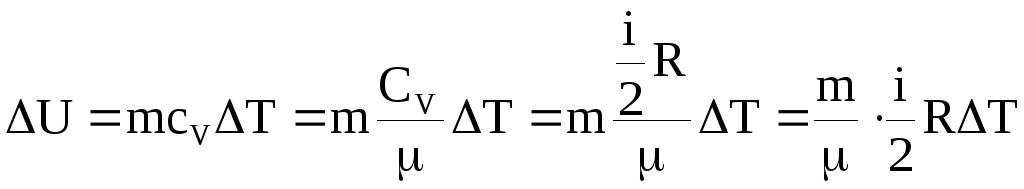 ,
,
где
![]() -удельная,
-удельная,
![]() - молярная теплоемкости,
- молярная теплоемкости,
![]() - число степеней свободы. В выражение
для
- число степеней свободы. В выражение
для
![]() входят неизвестные
входят неизвестные
![]() и
и
![]() ,
которые могут быть найдены из уравнений
Менделеева - Клапейрона для начального
и конечного состояний с учетом того,
что
,
которые могут быть найдены из уравнений
Менделеева - Клапейрона для начального
и конечного состояний с учетом того,
что
![]() :
:
![]() ;
;
![]() .
.
отсюда
![]() или
или
![]() .
Потому
.
Потому
![]()
Подставив
выражение для
![]() в формулу для
в формулу для
![]() ,
окончательно получим:
,
окончательно получим:
![]() .
.
Вычислим
![]() для изобарического процесса.
для изобарического процесса.
![]()
Б) Адиабатическое расширение.
При
адиабатическом расширении теплообмена
с внешне средой не происходит, поэтому
![]() .
Уравнение (*) имеет вид:
.
Уравнение (*) имеет вид:
![]() или
или
![]()
Последнее уравнение говорит о том, работа расширения газа при адиабатическом процессе может быть произведена только за счет убыли внутренней энергии газа. Формула для работы адиабатического процесса имеет вид:
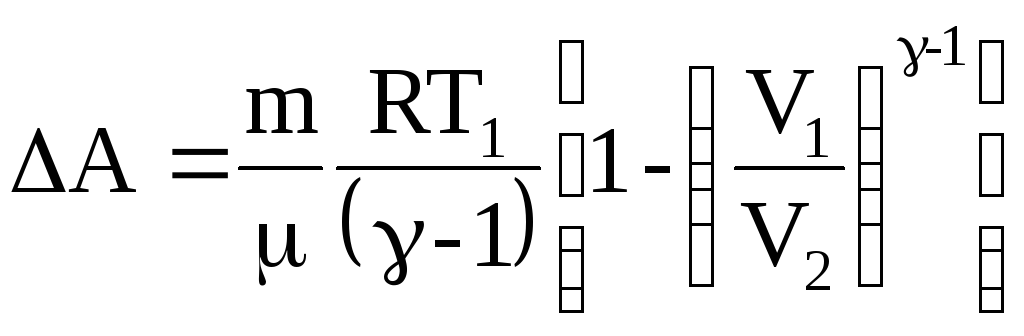
Здесь
![]() - показатель степени адиабаты. Поскольку
- показатель степени адиабаты. Поскольку
![]() ,
то
,
то
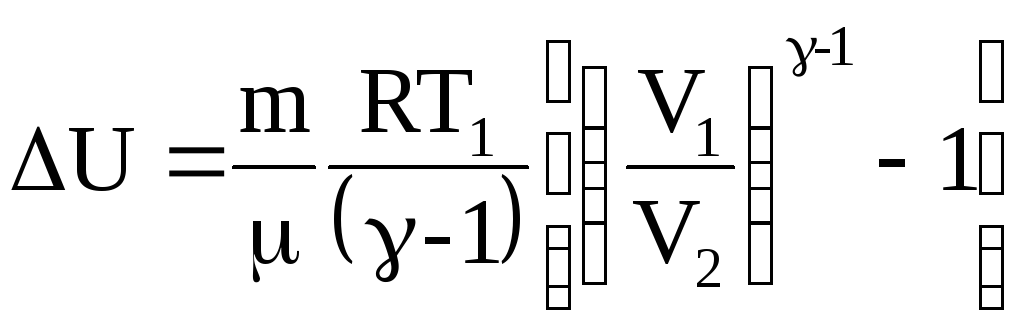 .
.
Поскольку
![]() (уравнение Менделеева – Клапейрона),
то получим
(уравнение Менделеева – Клапейрона),
то получим
![]() ,
выраженное через заданные в условии
параметры:
,
выраженное через заданные в условии
параметры:
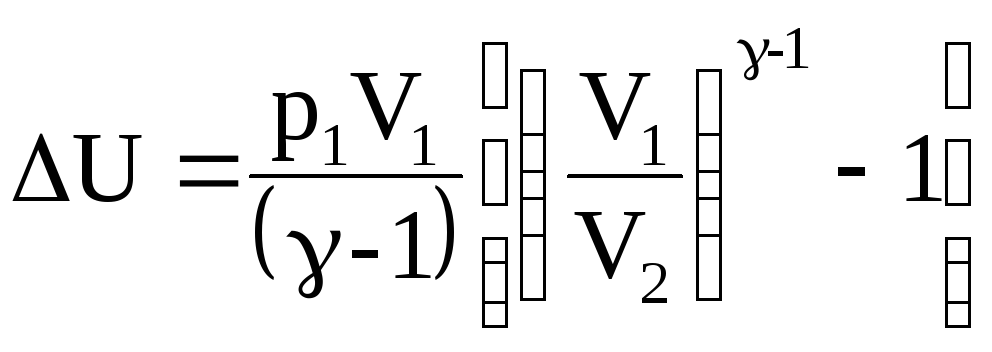
Вычислим
![]() для адиабатического процесса.
для адиабатического процесса.
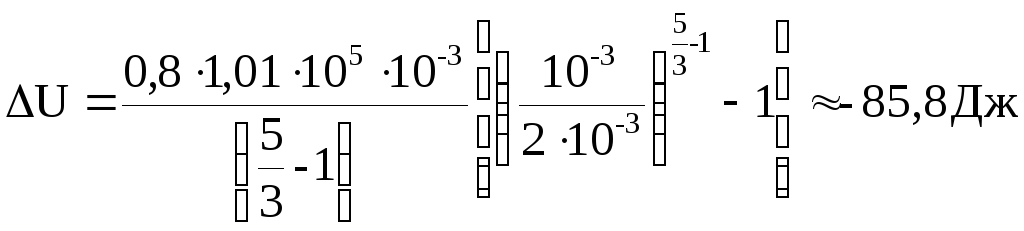
Ответ:
а)
![]() ;
б)
;
б)
![]() .
.
Пример 13. В цилиндре под поршнем находится водород массой 0,02 кг при температуре 27оС. Сначала водород расширился адиабатически, при этом объем увеличился в 5 раз, затем был сжат изотермически, при этом объем уменьшился в 5 раз. Найти: а) температуру в конце адиабатического расширения; б) полную работу, совершенную газом.
|
Дано: |
Решение: |
|
|
а)
При адиабатическом процессе температура
и объем связаны соотношением
откуда
где
|
|
|
Вычислим
![]() :
:
![]()
б)
Полная работа, совершенная газом
![]() ,
где
,
где
![]() - работа газа при адиабатическом
расширении,
- работа газа при адиабатическом
расширении,
![]() - работа газа при изотермическом сжатии.
Запишем выражения для них:
- работа газа при изотермическом сжатии.
Запишем выражения для них:
![]()
(здесь
учтено, что
![]() ),
),
![]() .
.
Вычислим
![]() ,
,
![]() ,
,
![]() :
:
![]()
![]()
(знак минус указывает, сто при сжатии газа работа совершается над газом внешними силами).
![]()
Проверка размерностей:
![]()
![]()
Ответ:
а)
![]() ;
б)
;
б)
![]() .
.
Пример
14. Идеальная тепловая машина, работающая
по циклу Карно, совершает за цикл работу
![]() .
Температура нагревателя 400 К, температура
холодильника 260 К. Найти: а) кпд машины;
б) количество теплоты, получаемое машиной
от нагревателя за один цикл; в) количество
теплоты, отдаваемое машиной холодильнику
за один цикл.
.
Температура нагревателя 400 К, температура
холодильника 260 К. Найти: а) кпд машины;
б) количество теплоты, получаемое машиной
от нагревателя за один цикл; в) количество
теплоты, отдаваемое машиной холодильнику
за один цикл.
|
Дано: |
Решение: |
|
|
а) КПД цикла Карно
где
Выражение (*) позволяет вычислить кпд: |
|
|
![]()
б) Из выражения (*) имеем, что:
![]() .
.
Вычислим
![]() :
:
![]()
в)
Поскольку
![]() ,
то
,
то
![]() ,
откуда
,
откуда
![]() .
.
![]()
Ответ:
а)
![]() ;
б)
;
б)
![]() ;
;
![]() .
.
Пример 15. В результате изотермического расширения объем кислорода увеличился в 2 раза. Определить изменение энтропии газа.
|
Дано: |
Решение: |
|
|
Изменение энтропии системы определяется по формуле
|
|
|
где
![]() - количество тепла, сообщенное газу,
- количество тепла, сообщенное газу,
![]() - абсолютная температура,
- абсолютная температура,
![]() ,
,
![]() - значения энтропии в начальном и конечном
состояниях системы.
- значения энтропии в начальном и конечном
состояниях системы.
При изотермическом расширении все подводимое количество теплоты идет на работу по расширению, т.е.
![]()
Из
уравнения Менделеева – Клапейрона
следует, что
![]() ,
поэтому
,
поэтому
![]() ,
,
![]() .
.
Интегрируем последнее выражение:
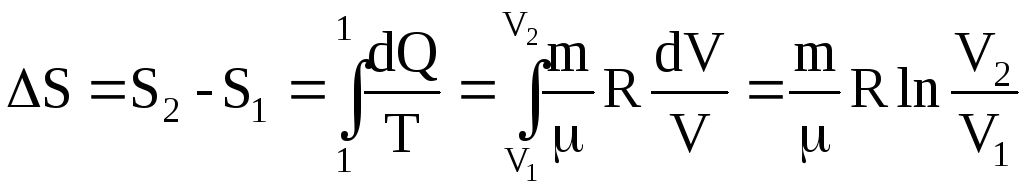 .
.
Таким образом, искомое изменение энтропии:
![]()
![]()
Проверка размерностей:
![]()
Ответ:
![]()
Пример 16. Как изменится энтропия 2 г водорода, занимающего объем 40 л при температуре 270 К, если давление увеличить вдвое при постоянной температуре, а затем повысить температуру до 320 К?
|
Дано: |
Решение: |
|
|
Изменение энтропии системы определяется по формуле
Используя
первое начало термодинамики, найдем
изменение количества теплоты
|
|
|
Здесь
![]() - масса газа,
- масса газа,
![]() - молярная масса газа,
- молярная масса газа,
![]() - молярная теплоемкость при постоянном
объеме,
- молярная теплоемкость при постоянном
объеме,
![]() - изменение температуры газа,
- изменение температуры газа,
![]() - давление газа,
- давление газа,
![]() - изменение объема,
- изменение объема,
![]() - работа расширения газа.
- работа расширения газа.
Подставим
в (*) выражения для
![]() и
и
![]() :
:
для
двухатомного газа
![]() ;
;
из
уравнения Менделеева – Клапейрона
следует, что
![]() .
.
Поэтому:
![]() ;
;
![]() .
.
Для нахождения изменения энтропии интегрируем последнее выражение:
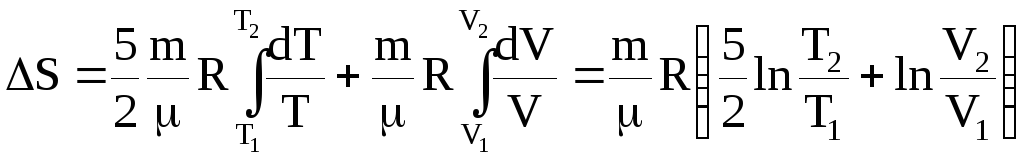
Учитывая,
что для изотермического процесса
![]() и что
и что
![]() ,
получим для нашего случая выражение
для изменения энтропии:
,
получим для нашего случая выражение
для изменения энтропии:
![]() .
.
Произведем вычисление
![]()
Проверка размерностей:
![]()
Ответ:
![]() .
.
Пример 17. Лед массой 2 кг, находящийся при температуре -10оС, нагрели и превратили в пар. Определить изменение энтропии.
|
Дано: |
Решение: |
|
|
Общее изменение энтропии равно сумме изменений энтропии, которые происходят на отдельных этапах:
Этап
1. Нагревание льда от температуры
|
|
|
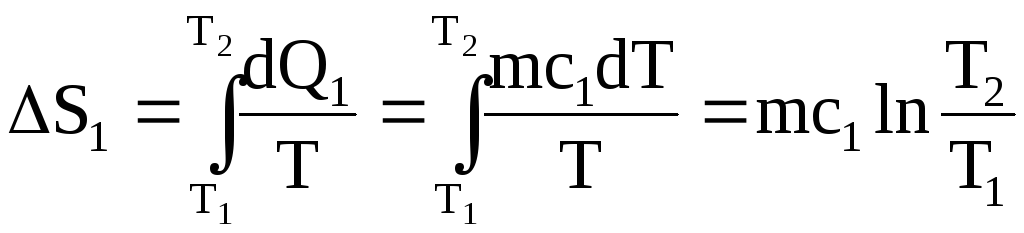 .
.
Этап
2. Плавление льда. В этом случае
![]() .
.
![]() .
.
Этап
3. Нагревание воды от температуры
![]() до
до
![]() .
.
![]() .
.
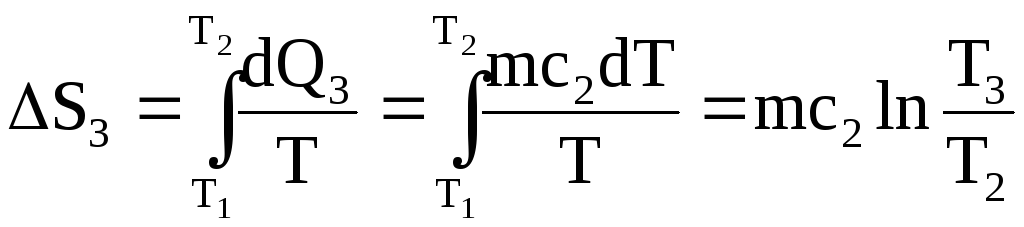 .
.
Этап
4. Испарение воды.
![]() .
.
![]() .
.
Общее изменение энтропии:
![]() .
.
![]()
![]()
Ответ:
![]() .
.

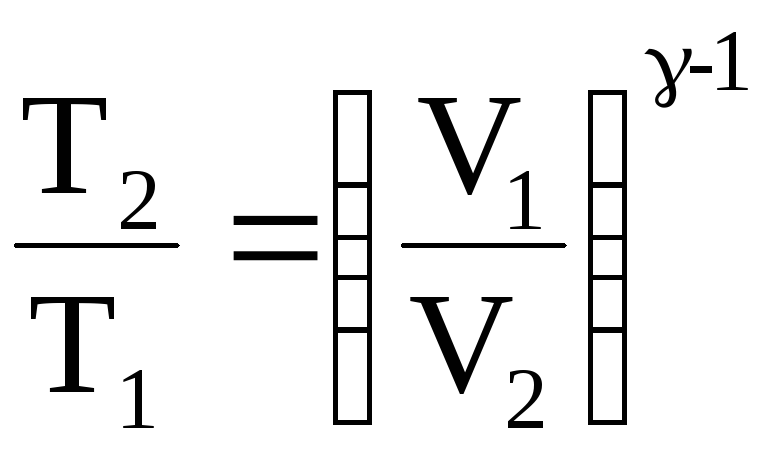 ,
,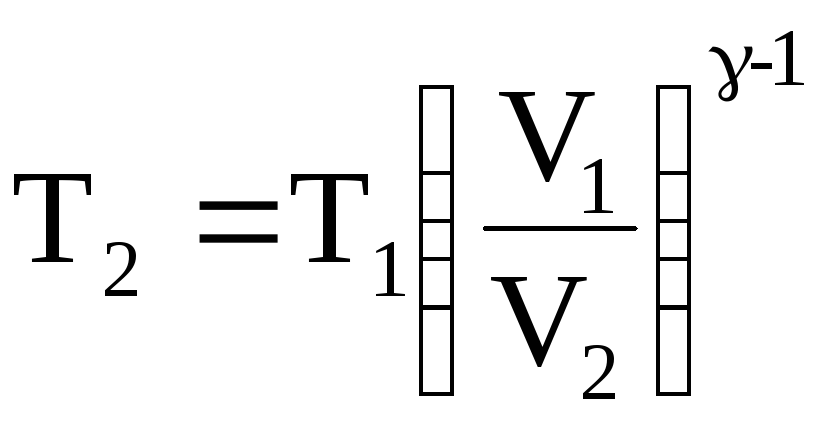 ,
,