
Коррозия лабы
.pdf
По справочным данным, |
ПРFe(OH )2 |
=1,65·10 -15, ПРMg(OH) |
12 |
, |
6,8 10 |
||||
|
|
|
2 |
|
концентрация ионов магния в морской воде равна ~ 0,1 г-ион/л. Подстав-
ляя |
|
эти значения в |
выражение |
защитного потенциала, |
находим |
||||
E |
защ |
0,593B |
(по н.в.э), |
а при концентрации ионов магния |
1 г-экв/л |
||||
|
|
|
|
|
|
|
|
||
|
Fe |
|
|
|
|
|
|
|
|
E |
защ |
0,563 B |
(по н.в.э). Такой метод часто используется для техниче- |
||||||
Fe |
|
||||||||
|
|
|
|
|
|||||
ских расчетов. |
|
|
|
|
|||||
|
|
|
|
Гораздо |
|
сложнее |
определить |
защитный (равновесный) |
потенциал |
железа (стали) в глинистой и песчаной почвах, когда с увеличением влажности величина защитного потенциала смещается в область более отрица-
тельных значений. Так для влажности почвы ~5% |
E |
защ |
= -0,4 B, для влаж- |
||||||||||
Fe |
|||||||||||||
|
|||||||||||||
ности почвы |
~20 % |
E |
защ |
= -0,53B (н.в.э). В среднем для стали в морской |
|||||||||
Fe |
|||||||||||||
воде и в почве защитный потенциал принимается равным |
|
Fe |
= -0,53B |
||||||||||
|
|
|
|
|
|
|
|
|
|
E |
защ |
|
|
|
|
защ |
|
|
|
|
|
|
|
|
|
||
(н.в.э) или |
E |
= -0,85В относительно насыщенного медно-сульфатного |
|||||||||||
Fe |
|||||||||||||
|
|||||||||||||
электрода (МСЭ) сравнения, потенциал которого + 0,32 В относительно
(н.в.э).
Рассмотренные положения по определению защитного потенциала железа (стали) могут быть распространены и на другие металлы, например, цинк.
В некоторых случаях для определения защитного потенциала можно использовать соответствующие уравнения для равновесных потенциалов,
взятых из диаграмм Пурбэ. |
|
|
|||||||
|
Критериями электрохимической защиты могут служить величины |
||||||||
следующих |
параметров: минимальный |
защитный |
потенциал |
||||||
защ |
|
|
|
|
|
|
защ |
|
|
Em in ; максимальный защитный потенциал, |
Em ax ; минимальная защитная |
||||||||
|
|
|
|
j |
защ |
|
|
|
|
плотность |
тока, |
m in ; |
минимальное защитное смещение |
потенциа- |
|||||
|
|||||||||
ла, |
E |
защ |
|
|
|
|
|
|
|
m in . |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
Минимальный защитный потенциал Emзащin – минимальный (по аб-
солютной величине, без учета омической составляющей) катодный потенциал, обеспечивающий требуемую степень защиты от коррозии металлической конструкции, например,трубопровода.
Максимальный защитный потенциал Emзаaщx – максимальный (по аб-
солютнойвеличине, без учета омической составляющей) катодный потенциал, обеспечивающий защиту от коррозии, превышение которого ведет к ускоренному “старению” изоляции инаводороживанию металла конструкции, особенно трубопроводов.
В целях экономии электроэнергии целесообразно заполяризовать всю защищаемую конструкцию лишь до уровня минимального защитного
потенциала Emзащin . Однако законы распределения потенциала в конструк-
91

ции, например трубопроводной сети, таковы, что неизбежна существенная неэквипотенциальность. Минимальный защитный потенциал поддерживают в конструкции, прежде всего, награницах зоны действия электрохимической защиты. Так, вблизи точки дренажа плотность тока защиты всегда больше и, следовательно, больше разность потенциалов металлокон- струкция-земля. Активное выделение водорода начинается при защитном потенциале отрицательнее Езащ = -1,0 В (МСЭ), при больших защитных потенциалах и, следовательно, больших токах поляризации, выделение газообразного водорода увеличивается. Возникая в порах изоляции и в пазухах конструкции, он способен собираться в пузыри и создавать разрушающее давление. Микропузыри, если в них большое давление, могут вызвать дальнейшее разрушение изоляции. Отслоение изоляции – основная опасность, связанная с большими отрицательными потенциалами.
Защитные потенциалы для различных металлов конструкций приведены в таблице 1.
Таблица 1
Защитные потенциалы металла конструкции относительно насыщенного медно-сульфатного электрода сравнения
|
|
|
Значение защитного потенциала, В (МСЭ) |
|
||||
|
|
|
|
|||||
|
Металл конструкции |
|
|
|
|
|
|
|
|
|
|
защ |
|
E |
|
защ |
|
|
|
|
|
|
|
|||
|
|
|
минимальное |
Em in |
максимальное |
m ax |
||
|
|
|
|
|||||
|
|
|
|
|
|
|
||
Сталь |
- 0,85 |
|
- 1,15 |
|
|
|
||
|
|
|
|
|
|
|
||
Свинец |
- 0,70 |
|
- 1,30 |
|
|
|
||
|
|
|
|
|
|
|
||
Алюминий |
- 0,85 |
|
- 1,40 |
|
|
|
||
|
|
|
|
|
|
|
|
|
Исходя из этого по ГОСТ Р 51164-98 на магистральных трубопроводах допускается общий потенциал, с учетом падения напряжения в изоля-
ции, или
E защ = -2,5 В (МСЭ), если трубопроводы имеют битумную изоляцию, m ax
E защ = -3,5 В (МСЭ) –для трубопроводов с полимерной пленочной m ax
изоляцией.
Электрохимическая защита должна обеспечивать в течение всего срока эксплуатации непрерывную по времени катодную поляризацию трубопровода на всем его протяжении (и на всей его поверхности) таким образом, чтобы значения потенциалов на трубопроводе были (по абсолютной величине) не меньше минимального и не больше максимального значений.
Контроль за эффективностью катодной защиты осуществляется из-
92

мерением потенциала металлоконструкции относительно стандартных электродов сравнения.
Также важны и следующие критерии электрохимической защиты.
Минимальная защитная плотность тока
j защ m in
–
гарантирует
надежную защиту данного сооружения в данных коррозионных условиях.
Минимальное защитное смещение потенциала
E защ m in
.
Теоретическое соотношение, позволяющее оценивать степень защиты сооружения в зависимости от величины катодного смещения потенциала, может быть представлено в виде
|
E |
защ |
= 0,059 lg ( j корр / j а), |
|
m in |
||||
|
где j корр - первоначальная плотность тока коррозии без электрохимической защиты (ЭХЗ);
j а - предельно допустимая плотность тока коррозии при включенной защите.
Так, для снижения скорости коррозии в 100 раз, т.е. для выполнения условия j корр / j а = 100, необходимо смесить потенциал сооружения на ве-
личину Emзащin = 0,059 lg100 =0,118 В.
В практике предлагается в качестве минимального защитного смещения потенциала следующие значения:
|
E |
защ |
= 0,1 |
В – для неизолированных сооружений; |
|
m in |
|||||
|
|||||
|
E |
защ |
= 0,3 |
В – для изолированных трубопроводов, |
|
m in |
|||||
|
полагают, что величина омической составляющей на изоляционном покрытии в данном случае не превышает U ом =0,2 В.
Величина самого защитного потенциала металлоконструкции под током электрохимической защиты складывается из стационарного (компромиссного) потенциала Ест, поляризационного смещения потенциала, обеспечивающего требуемое снижение скорости коррозии Епол и омической составляющей смещения потенциала ( U ом)
Езащ = Ест + Епол+ Uом
Омическая составляющая смещения потенциала ( Uом) –это неизбежное и к тому же совершенно бесполезное и даже вредное падение напряжения, вызванное током защиты на некотором сопротивлении, куда входит сопротивление электролита в порах изоляции и участок земли между трубопроводом и измерительным электродом, особенно если вблизи измерительного электрода активно поле внешних токов, например, поле токов анодного заземлителя катодной станции;
Для исключения омической составляющей и выделения поляризационной Епол в практике измерения ведут методом прерывания тока поляризации. При отключении тока омическая составляющая, как того требует
93

закон Ома, мгновенно исчезает, а поляризационная составляющая Епол с момента отключения тока уменьшается медленно, постепенно затухая.
Это объясняется тем, что разряд двойного электрического слоя на границе металл-электролит, по аналогии с разрядом конденсатора, происходит замедленно во времени. Продолжительность разряда зависит от емкости двойного электрического слоя и сопротивления цепи разряда.
Начало процесса разряда двойного слоя пытаются зафиксировать для того, чтобы измерить в этот момент максимальное значение Епол. на защищаемой конструкции.
В практике рядом с конструкцией, например с трубопроводом, устанавливают стальной неизолированный электрод-датчик, который должен быть всегда замкнут на трубопровод. Этот электрод моделирует оголенный участок трубопровода. При этом полагают, что интенсивность катодных процессов поляризации на электроде-датчике и в местах оголения трубопровода – одна и та же, т.е. Епол электрода рав-
на Епол трубопровода.
Измерения ведут по следующей методике. С помощью автоматического прерывателя тока электрод-датчик периодически переключают от трубопровода к вольтметру. Продолжительность коммутации “датчиквольтметр” должна быть в пределах 0,2...0,5 мс, продолжительность коммутации цепи “датчик-трубопровод” – в пределах 5...10 мс.
С помощью стандартного электрода сравнения и вольтметра через каждые 5 с в течение 10 минут фиксируют множество мгновенных значений потенциала электрода-датчика Еi ( i = 1,2,..., n ).
Мгновенные значения Е i различаются между собой из-за инерционности полевых вольтметров и присутствия переменных во времени блуждающих токов.
После обработки результатов измерения получают среднее значение поляризационного защитного потенциала трубопровода, лишенного
омической составляющей Езащ = Ест + Епол.
Весьма легко защитный потенциал конструкции достигается за счет катодной поляризации внешним током. При защите с помощью протекторов нужно учесть некоторые особенности их работы
В основном для защиты стальных сооружений, по чисто практическим соображениям, широко используют протекторы на основе цинка, алюминия и магния, исходя из их отрицательных равновесных потенциалов.
Протекторы на основе цинка чаще используются для защиты от коррозии тех металлических конструкций, где технологические условия требуют наивысшей степени противопожарной безопасности и взрывобез-
94

опасности. Примером востребованности таких сплавов являются газопроводы и трубопроводы для транспортировки горючих жидкостей.
Кроме того, цинковые составы, в результате анодного растворения, не образуют загрязняющих веществ. Поэтому такие сплавы практически безальтернативны, когда нужно защитить трубопровод для транспортировки нефти или металлоконструкции в танкерных судах.
Цинковые протекторы применяют, прежде всего, для защиты оборудования, эксплуатирующегося в морской воде (морских судов, трубопроводов, прибрежных сооружений). Применение их в слабосоленой, пресной воде и грунтах ограничено, вследствие образования на их поверхности слоев гидроксида Zn(OH)2.
Алюминиевые протекторы применяют для защиты сооружений, эксплуатирующихся в проточной морской воде, а также для защиты портовых сооружений и конструкций, располагающихся в прибрежном шельфе.
Магниевые протекторы преимущественно применяют для защиты небольших сооружений в слабо электропроводных средах, где эффективность действия алюминиевых и цинковых протекторов низка, грунтах, пресных или слабосоленых водах. Однако из-за высокой скорости собственного растворения и склонности к образованию на поверхности труднорастворимых соединений, область эксплуатации магниевых протекторов ограничивается средами с pH = 9,5÷10,5.
Чистые металлы в качестве протекторов не получили распространения в связи с их низкой эффективностью, связанной с неравномерностью растворения из-за крупнозернистой дендритной структуры или пассивацией (цинк), формированием плотной поверхностной пленки(алюминий)и высокой скоростью собственной коррозии (магний).
Для придания протекторам требуемых эксплуатационных свойств в их состав вводят легирующие элементы.
Всостав цинковых протекторов вводят Cd (0,025÷0,15%) и А1 (0,1÷0,5%), обеспечивающие более равномерное растворение. Кадмий добавляют для получения продуктов коррозии, которые крошатся под действием собственного веса и самоудаляются. Кремний вводят для удаления железа в виде железокремниевой примеси.
Содержание таких примесей, как Fe, Сu, Рb стараются поддерживать на уровне не более 0,001÷0,005 %.
Всостав алюминиевых протекторов вводят добавки, предотвращающие образование оксидных слоев на их поверхности — Zn (до 8%), Mg(до 5%), а также Cd, In, Gl, Hg, Tl, Mn, Si (от сотых до десятых долей процента), которые позволяют сделать потенциал протектора более отрицательным и способствуют требуемому изменению параметров кристал-
95

лической решетки. Ртуть предотвращает возникновению пассивной пленки на поверхности сплава, но ее высокая токсичность может вызывать загрязнение среды, поэтому предпочтительнее легирование сплава индием.
Магниевые протекторные сплавы в качестве легирующих добавок содержат AI (5÷7%) и Zn (2÷5%); содержание таких примесей, как Fe, Ni, Сu, Pb, Si поддерживают на уровне десятых или сотых долей процента. Алюминий повышает литейные свойства и механические характеристики, хотя при этом потенциал немного снижается. Цинк облагораживает сплав, повышает эффективность работы, уменьшает вредное влияние таких примесей, как медь и никель. Марганец вводят при плавке сплава для осаждения примесей железа. Он позволяет повысить токоотдачу и сделать более отрицательным потенциал протектора.
Химические составы некоторых протекторных сплавов соответственно на магниевой, алюминиевой и цинковой основе приводятся в ПРИЛОЖЕНИИ 1 табл. 4÷6.
Более высокое содержание примесей в сплавах по сравнению с тем, что указано в таблицах, существенно снижает коэффициент полезного использования протектора ( ис), связанного с неоднородностью его растворения и, следовательно, с механическим разрушением, когда уже требуется замена протектора, в то время как он еще не растворился полностью.
За счет неоднородности сплава существенно ускоряется процесс саморастворения протектора и, следовательно, снижается доля его массы, полезно расходуемой непосредственно на защиту трубопровода – коэффициент полезного действия ( пд).
Величина тока саморастворения протектора во многом определяется параметрами процесса выделения водорода, то есть, эффективностью работы катодных участков на поверхности протектора (рис. 1).
При потенциале катодной защиты Ey величина идеального анодного
тока растворения протектора |
I |
пр |
равна отрезку [Eyd]. Часть анодного тока |
|
ан |
||||
|
(электронов) с протектора идет в локальную защищаемую систему (Fe – анод – Ох – катод) и гасит внутренний (локальный) ток системы – появ-
пр |
- |
пр |
=[bd], величина которого меньше тока |
ляется внешний ток I внеш = Iан |
Iкт |
растворения протектора на величину тока саморастворения металла протектора, которая определяется идеальным катодным током Iктпр на протекторе при потенциале Ey, равного длине отреза [Eyb]. Поэтому, чем больше ток саморастворения протектора, тем меньше коэффициент его полезного действия.
пд = ( I - Iктпр ) / =[Eyd]- [Eyb]/ [Eyd] = =[bd] /[Eyd]
Таким образом, если процесс коррозии металла протекает с водо-
96
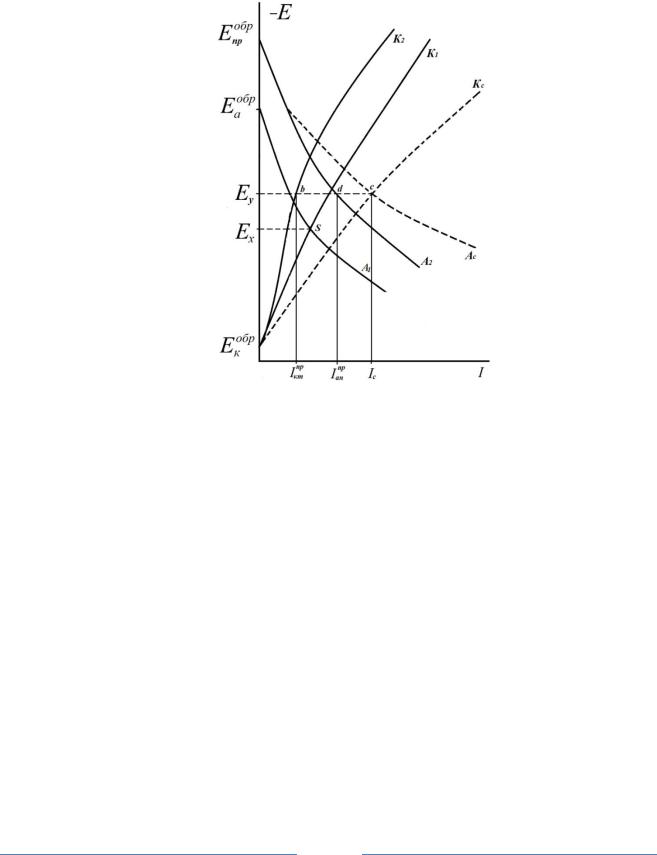
родной (кислородно-водородной деполяризацией), то чем отрицательнее потенциал протектора в данной агрессивной среде (отрицательнее потенциала обратимого водородного электрода) и чем меньше перенапряжение выделения водорода на катодных участках поверхности металла протектора, тем больше ток саморастворения протектора и меньше коэффициент полезного действия.
Рис.1. Коррозионная диаграмма катодной защиты с помощью протектора:
A1 и A2; K1 и K2 – анодные и катодные поляризационные кривые для защищаемого металла (1) и протектора (2) соответственно; Ac и Kc – суммарная анодная кривая и суммарная катодная поляризационная кривая
Легирующие элементы (табл. 4÷6 ПРИЛОЖЕНИЕ 1) и выполняют функции ингибиторов катодной реакции выделения водорода. Они работают макро катодами и имеют перенапряжение выделения водорода гораздо большее, чем для чистого металла протектора. С другой стороны, находясь под протекторной защитой, эти компоненты сплава не окисляются, а, следовательно, сохраняют электропроводный каркас, обеспечивают более равномерное растворение протекторного сплава.
И, наоборот, жесткие требования предъявляются к предельному содержанию для примесных элементов (Fe, Cu, Si), имеющих низкое перенапряжение выделения водорода, которые будут уменьшать коэффициент полезного действия протектора. Так, для алюминиевых сплавов, увеличение суммарного содержания Fe+Si+Cu от 0,2% до 0,5% снижает от 85%
97

до 55%.
Основными проектными параметрами протекторных сплавов явля-
ются фактический (компромиссный) потенциал (
E пр х
) протектора и фак-
тическая токоотдача (Q). Изменение фактического потенциала
E пр х
обу-
словлено явлением поляризации под током саморастворения и является нежелательным. Чем меньше величина смещения потенциала протектора, тем качественнее будет протекторная защита. Безусловно, значение стационарного потенциала зависит от свойств окружающей среды и, как показала практика, может изменяться на величину порядка ±0,1 В относительно приведенных в табл.2.
Фактическая токоотдача (
Qфакт
Me
), учитывающая коэффициенты ис-
пользования ( ис) и полезного действия протектора( пд),
Q |
факт |
|
1000 пд ис |
, |
|
||||
|
|
|
|
|
|
Me |
|
qMe |
|
|
|
|
|
(9.11)
где qMe – электрохимический эквивалент металла протектора, г/А∙час. Поскольку фактические значения токоотдачи и потенциала суще-
ственно зависят от условий эксплуатации, то для приближенного расчета обычно принимают некоторые средние значения этих параметров. Например, для подземных трубопроводов эти значения приведены в табл.2.
Таблица 2 Основные электрохимические параметры протекторных сплавов
|
Фактиче- |
|
|
|
|
|
|
Коэффициент |
|
|
|
||
|
ский |
|
Фактическая |
Электрохимический |
|||||||||
|
|
полезного |
|||||||||||
|
|
|
токоотдача, |
||||||||||
Протекторный |
потенци- |
эквивалент, |
|||||||||||
действия |
|||||||||||||
|
|
|
факт |
|
|
|
|||||||
|
пр |
|
Q |
|
. |
|
|
. |
|
||||
сплав |
ал, Eх |
, В |
Me |
|
, А |
ч/кг |
|
q , кг /( А |
год ) |
||||
|
|
|
|||||||||||
|
|
|
пд, % |
|
|||||||||
|
(по МЭС) |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
Магниевый |
1,5 |
|
|
|
1400 |
|
|
60 |
7,2 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
Алюминиевый |
1,1 |
|
|
|
2600 |
|
|
85 |
3,9 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
Цинковый |
1,1 |
|
|
|
790 |
|
|
95 |
12,6 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цель работы – определение защитного потенциала металла конструкции и параметров катодной защиты.
98
Экспериментальная часть
Часть 1. Определение защитного потенциала металла.
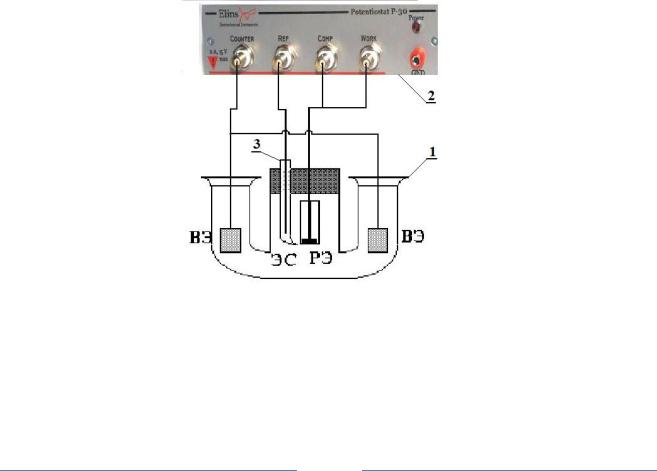
Работа проводится на установке, которая состоит из электролитической ячейки и потенциостата «Элинс P– 30S» (рис. 2), позволяющего на экране монитора видеть ход поляризационных кривых, автоматически записывать зависимости плотности тока от потенциала и изменения потенциала во времени при отключении тока, а также сохранять их в памяти компьютера. Порядок включения потенциостата и работу при определенных режимах указаны в ПРИЛОЖЕНИИ 2.
Предварительно подготовленные электроды помещают в электрохимическую ячейку, залитую электролитом (согласно задания).
Электрод поляризуют катодно, отрицательнее обратимого потенциала металла Eанобр , рассчитанного по уравнению Нернста.
Отключают поляризуюций ток и замеряют изменение потенциала во времени. На зависимости E τ (рис.3) методом нахождения точки пересечения касательных к двум участкам линий спада потенциала, когда омическая составляющая исчезает практически мгновенно, а поляризационная составляющая уменьшается медленнее, определяют величину защитного
потенциала метала Eзащ . Fe
Рис. 2. Схема установки для снятия кривыхизменения потенциала во времени
1 – стеклянная ячейка, 2 – потенциостат «Элинс Р –30S», 3 – стеклянный капилляр (гебер), РЭ – рабочий электрод, ВЭ – вспомогательные платиновые электроды, ЭС – хлорсеребряный электрод сравнения
99

Рис. 3. Зависимость изменения потенциала электрода во времени после отключения катодной поляризации
E |
пол |
– потенциал поляризации; |
|
||
время поляризации, 10 мс; |
||
|
|
откл |
Eзащ
Ме1
– защитный потенциал металла, В; пол τоткл –
– время спада потенциала во времени, 0,5 мс.
Часть 2. Определение параметров протекторной и катодной защиты
Метод катодной защиты, металл протектора (вспомогательного электрода) задается преподавателем. Предварительно подготовленные электроды помещают в электрохимическую ячейку (рис. 4), залитую электролитом (согласно заданию). Замеряют и записывают значения потенциалов электродов при разомкнутой цепи.
а) б)
Рис. 4. Электрическая схема для протекторной защиты (а) и защиты внешним током (б)
Ан – защищаемый металл, Аз – анод внешней защиты (инертный электрод), Пр – протектор, ИПТ – источник постоянного тока, Кл – электрический ключ цепи микроэлемента,Rм – магазин сопротивлений, П – переключатель для измерения потенциалов анода или катода, мА – миллиамперметр, мВ – милливольтметр
100
