
Коррозия лабы
.pdf
Рис. 4. Схема защиты с помощью двух протекторов
Пр1 и Пр2 –протекторы; К1 и К2 – точки дренажа.
Рис.5. Распределение потенциала по длине трубки при защите с помощью двух протекторов
111
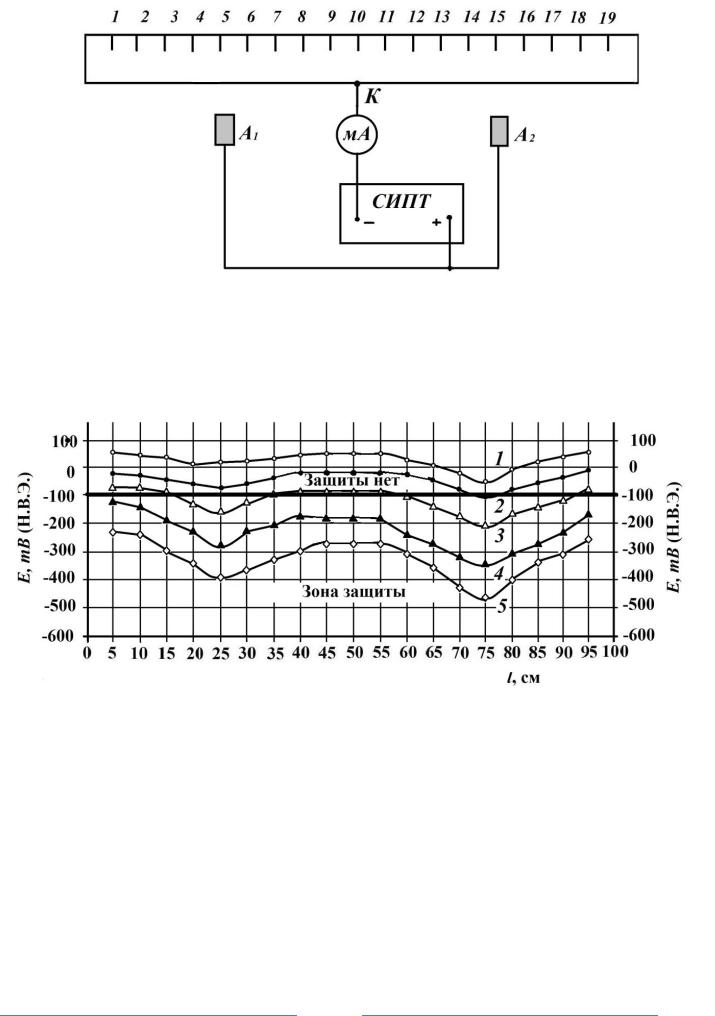
Рис. 6. Схема катодной защиты от внешнего источника тока
А1, А2 – графитовые аноды; К – точка дренажа; СИПТ – стабилизированный источник постоянного тока; мА – миллиамперметр
Рис. 7. Распределения потенциала по длине трубок при катодной защите с использованием 2 анодов при различных плотностях катодного тока
Цифры 1÷5 на кривых изменения потенциала по длине трубок соответствуют различным плотностям внешнего катодного тока j1<J2<j3<j4<j5
112
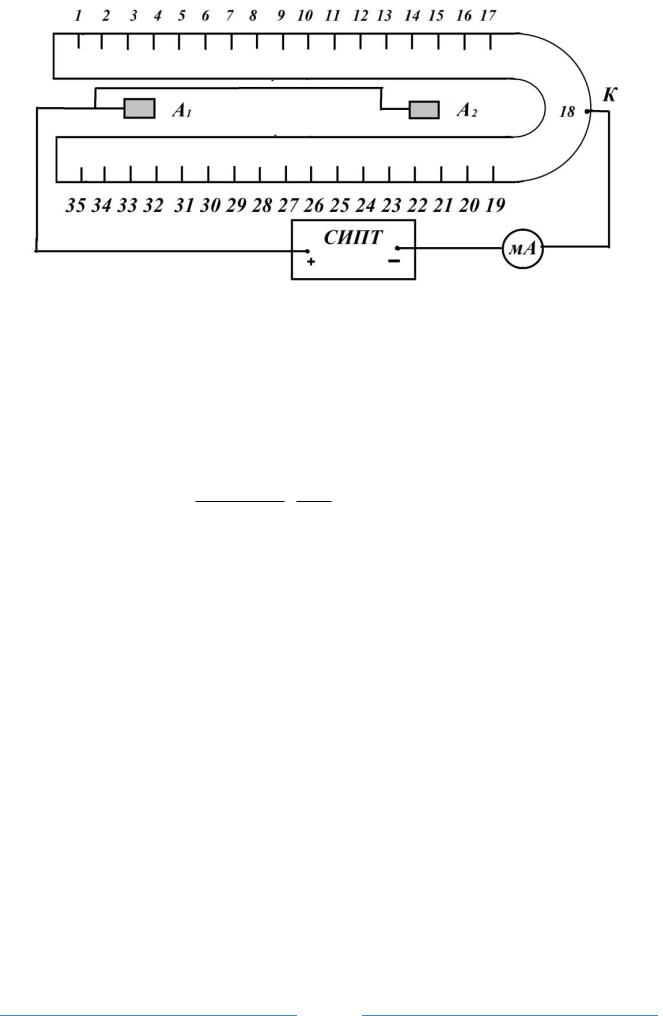
Рис. 8. Схема катодной защиты змеевика
А1, А2 – графитовые аноды; К – точка дренажа; СИПТ – стабилизированный источник постоянного тока.
3. Расчет расхода протектора для защиты по всей длине.
По величине силы тока в цепи протектора можно рассчитать ско-
рость коррозии протектора |
|
пр, г/м2·час |
|
|||||||
Kвес |
|
|||||||||
K |
|
|
I |
|
|
A |
10 |
4 |
|
|
|
|
Ме |
, |
(10.10) |
||||||
|
|
|
|
|
|
|||||
|
вес |
|
Sан пд ис |
|
z F |
|
|
|||
|
|
|
|
|
|
|
|
|||
где I – сила тока на протекторе |
Iкорпр ), А; |
|
|
|
||||||
Sан – рабочая (смоченная электролитом) поверхность протектора, см2; |
||||||||||
AМе – атомный вес металла протектора, г;
z – изменение валентности в анодной электрохимической реакции; F – число Фарадея, 26,8 А·час/г-экв.
пд – коэффициент полезного действия протектора (эта величина зависит от металла (сплава) и выбирается из данных табл.2);ис – коэффициент использования протектора (он равен 0,95 ÷ 0,98).
Глубинный показатель коррозии металла протектора (проницаемость):
|
K |
8,76 |
|
||
П |
вес |
|
|
, |
|
dМе |
|||||
|
|
||||
П
, мм/год
(10.11)
где
d Ме
– плотность металла протектора, г/см3.
Расход протектора, K пр, кг/м2 год, можно рассчитать с учетом его непроизводительных потерь:
113

K |
8,76 K |
|
. |
|
вес |
||||
пр |
|
|
(10.12)
Исходя из цены 1 кг протектора, можно оценить стоимость протекторной защиты конструкции.
Срок службы протекторов Т, в годах – это время, через которое необходимо производить замену протекторов, определяется по формуле:
Т |
М QMe пд ис |
, |
|
8760 Iпр |
|||
|
|
(9.13)
где М – масса протектора (кг); 8760 – среднее число часов в году (час/год);
Iпр |
|
|
|
– сила тока в цепи протектор – защищаемый металл, А; |
|||
QMe |
|
|
|
–теоретическая токоотдача металла протектора (А∙час/кг); |
|||
QMe |
1000 |
, |
|
qMe |
|||
|
|
||
(10.14)
где, qMe – электрохимический эквивалент металла протектора, г/А∙час.
4. Расчет расхода электроэнергии на год эксплуатации катодной зашиты.
Расход электроэнергии за 1 год составит, кВт·час:
W |
I U |
T |
, |
(10.15) |
|
1000 K |
|
K |
|||
|
|
||||
|
м |
пд |
|
||
|
|
|
|
||
где I – сила тока для полной защиты, А;U |
– напряжение на внешнем источ- |
||||
нике постоянного тока (при достижении защитного потенциала), В;T – количество часов в году, 8760 ч/год; Kтр – коэффициент мощности, КМ = 0,9; Kв –
коэффициент полезного действия источника постоянного тока, Кпд=0,93÷0,98. Затраты на электроэнергию составят, руб:
где
D W q, q – стоимость одного кВт·ч, руб/кВт·ч;
(10.16)
При написании отчета по работе необходимо: 1.Провести анализ коррозионного процесса
2.Определить защитный потенциал и радиус действия защиты 3.Дать сравнительную характеристику влияния различных факторов, ис-
следованных в работе, на параметры катодной защиты; 4.Сделать вывод по работе.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. При каких условиях достигается полная электрохимическая защита металла от коррозии?
114

2.Каким требованиям должен удовлетворять протектор?
3.Какие материалы (сплавы) могут использоваться в качестве анода – протектора при катодной электрохимической защите?
4.Каков физический смысл понятия «радиус действия» протек-
тора?
5.Какие факторы оказывают наибольшее влияние на «радиус действия» протектора?
6.В каких случаях необходимо использование только протекторной защиты?
7.Сокращаются ли суммарные потери металла в случае защиты протектором?
8.Какие материалы используются в качестве анодных заземлителей при защите внешним током? Назначение активаторов?
9.Докажите графически, что коррозионный процесс, имеющий большую катодную поляризуемость, будет иметь больший (+) защитный эффект и эффективность при одинаковой величине катодного тока внешней поляризации?
10.Что такое пд – коэффициент полезного действия протектора
иис – коэффициент использования протектора?
11.В каких случаях полная электрохимическая защита становится экономически невыгодной и когда она практически недостижима?
12.Что такое перезащита и чем она вызвана?
13.Сокращаются ли суммарные потери металла в случае защиты протектором?
14.Напишите реакцию, протекающую на электродах в Вашем случае коррозионных испытаний.
15.Как будет меняться локальный ток коррозии двухэлектродной системы при внешней катодной поляризации? (Пояснить на коррозионной диаграмме).
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Томашов, Н.Д.Теория коррозии металлов / Н.Д. Томашов. – М.: Изд-во АН СССР, 1959. – 590 с.
115

2.Эванс, Ю.Р. Коррозия и окисление металлов / Ю.Р. Эванс. – М.:
Машгиз, 1962.– 380 с.
3.Скорчеллетти, В.В. Теоретические основы коррозии металлов / В.В. Скорчиллети. – М.: Химия, 1973. – 263 с.
4.Соколовская, Е.М. Металлохимия / Е.М. Соколовская, Л.С. Гузей. – М.: Изд. Московского университета, 1986. – 264 с.
5.Дамаск, А. Точечные дефекты в металлах /А. Дамаск, Дж. Дине ; под ред. Б.Я. Любова. – М.: Мир, 1966. – 282 с.
6.Жуков, А.П. Основы металловедения и теории коррозии /А.П. Жуков, А.И. Малахов. – М.: Высшая школа, 1991. – 169 с.
7.Жук, Н.П. Курс теории коррозии и защиты металлов / Н.П. Жук. –
М.:Альянс, 2006. – 345 с.
8.Семенова, И.В. Коррозия и защита от коррозии /И.В. Семенова, Г.М. Флорианович, А.В. Хорошилов; под ред. И.В. Семеновой. – М.:
ФИЗМАТЛИТ, 2002. – 336 с.
9.Томашов, Н.Д.Теория коррозии и коррозионно-стойкие конструкционные сплавы / Н.Д. Томашов, Г.П. Чернова. – М.: Металлургия, 1986. –
189с.
10.Томашов Н.Д. Пассивность и защита металлов от коррозии. / Н.Д. Томашов, Г.П. Чернова. – М.: Наука, 1965. – 312 с.
11.Удиг Г.Г., Реви Р.У. Коррозия и борьба с ней. / Л.: Химия ,1991.
12.Сухотин, А.М.Справочник по электрохимии / А.М Сухотин; под ред. А.М Сухотина.– Л.: Химия, 1981 – 488 с.
13.Сухотин, А.М.Техника борьбы с коррозией. / А.М Сухотин; под ред. А.М Сухотина. – Л.: Химия, 1980 – 348 с.
14.Улиг, Г.Г. Коррозия и борьба с ней. Введение в коррозионную науку и технику. / Г.Г. Улиг, У.У. Реви. – М.: Химия, 1988. – 455 с.
15.Розенфелъд, И.Л. Коррозия и защита металлов. / И.Л. Розенфельд.– М.: Металлургия, 1970. – 448 с.
16.Попов, Ю.А.Теория взаимодействия металлов и сплавов с коррозионноактивной средой. / Ю.А. Попов. – М.: Наука, 1995. – 200 с.
17.Фрейман, Л.П. Потенциостатические методы в коррозионных исследованиях и электрохимической защите. / Л.П. Фрейман, В.А. Макаров,
И.Е. Брыскин. – Л.: Химия, 1972. – 240 с.
18.Стрижевский, КВ. Защита подземных теплопроводов от коррозии. / К.В. Стрижевский,М.А. Сурис. – М.: Энергоатомиздат, 1983. – 344 с.
19.Герасименко, А.А.Защита от коррозии, старения и биоповреждений машин, оборудования и сооружений: справочник / А.А. Герасименко; под ред. А.А. Герасименко. – М.: Металлургия, 1987. Т. 1. – 128 с.
20.Дамаскин, Б.Б., Электрохимия. / Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина. – М.: Химия, 2001. – 624 с.
116

21.Кузуб,B.C. Анодная защита металлов от коррозии. / В.С. Кузуб. – М.:
Химия, 1983.– 182 с.
22.Аколъзин, А.П.,Кислородная коррозия оборудования химических производств. /А.П. Акользин, А.К. Жуков.– М.: Химия, 1985. – 240 с.
23.Фокин, М.Н.Защитные покрытия в химической промышленности. / М.Н. Фокин, Ю.В. Емельянов.– М.: Химия, 1982. – 256 с.
24.Владычина Е.Н.Лакокрасочные покрытия / Е.Н. Владычина и др; под ред. Е.Н. Владычиной. – М.: Химия, 1972. – 304 с.
25.Бэкман, В., Швенк В. Катодная защита от коррозии: справочник / В. Бэкман, В Швенк; под ред. И.В. Стрижевского. – М.: Металлургия, 1984. –
495с.
26.Иосселъ, Ю.Я. Математические методы расчета электрохимической коррозии и защиты металлов: справочник / Ю.Я. Иосселъ, Г.Э. Кленов.– М.: Металлургия, 1984.– 271 с.
27.Красноярский, В.В. Электрохимический метод защиты металлов от коррозии / В.В. Красноярский.– М.: Машгиз, 1961. – 125 с.
28.Антропов, Л. И. Ингибиторы коррозии металлов / Л.И. Антропов, Е.М. Макушин, В.Ф. Панасенко.– Киев: Тех. школа, 1981. – 183 с.
29.Алексеев, С.Н.,Ингибиторы коррозии стали в железобетонных конструкциях / С.Н. Алексеев, В.Б. Ратинов, Н.К. Розенталъ, Н.М. Кашурников.– М.: Строй-издат, 1985. – 272 с.
30.Решетников, С.М.Ингибиторы коррозии металлов / С.М. Решетни-
ков.– Л.: Химия, 1986. – 144 с.
31.Иванов, Е.С. Ингибиторы коррозии металлов в кислых средах: справочник /Е.С. Иванов.– М.: Металлургия, 1986. – 175 с.
32.Розенфелъд, И.Л. Ингибиторы атмосферной коррозии. / И.Л. Розенфелъд,В.П. Персианцев.– М.: Наука, 1985. – 278 с.
33.Люблянский, Е.Я. Электрохимическая защита от коррозии / Е.Я. Люблянский.– М.: Металлургия, 1987. – 235 с.
34.Люблянский, Е.Я. Протекторная защита морских судов и сооружений от коррозии. / Е.Я. Люблянский. – Л.: Судостроение, 1979. – 287 с.
117
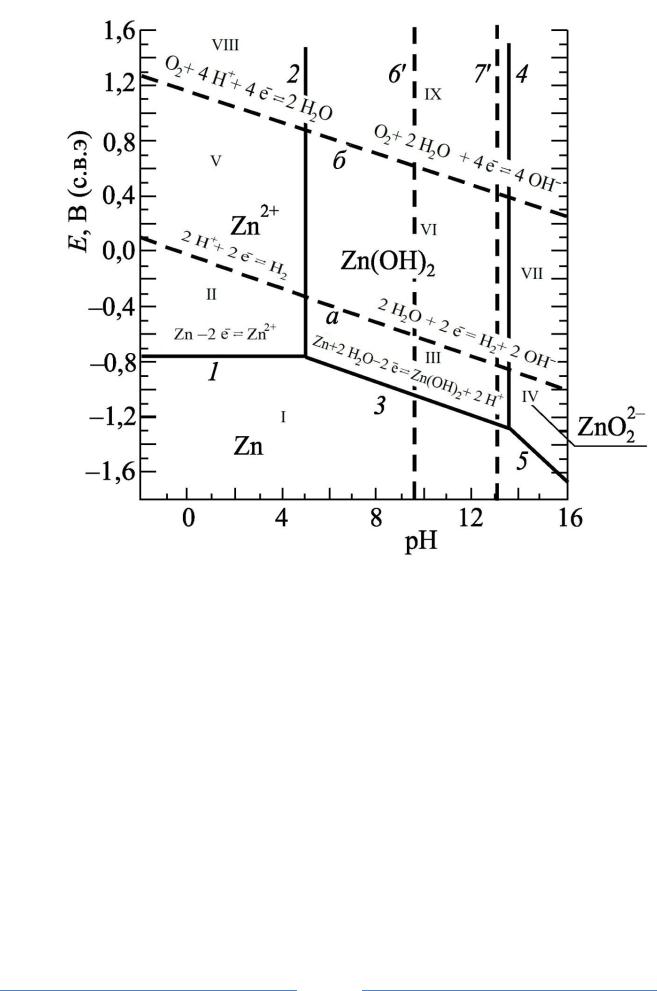
ПРИЛОЖЕНИЕ 1
Рис.1.Диаграмма
E pH
для системы Zn – H2O при + 25 0С
При построении диаграмм учитывают три типа равновесий в системе металл-вода (рассмотрим на примере системы Zn – водный раствор).
1.Равновесный обмен электрическими зарядами:
|
Zn2 |
|
|
|
|
|
|
|
|
|
0,76B, при T = 298 K и a |
|
=1 |
|||||||
|
2e |
Zn0 , E0 |
|
2 |
|
|
Zn |
|||||||||||||
|
|
|
|
|
|
|
Zn |
/ Zn |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
E |
обр |
E |
0 |
|
|
RT |
|
ln |
a |
Zn |
2 |
|
0,76 |
0,029lg(a |
|
2 ). |
|
(3.1) |
||
|
2 |
|
2 |
nF |
aZn |
|
|
|||||||||||||
|
Zn |
/ Zn |
|
Zn |
|
/ Zn |
|
|
|
|
Zn |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Эти равновесия не зависят от |
pH |
, а потенциал металла зависит |
||||||||||||||||||
|
|
|
||||||||||||||||||
только от активности его ионов в электролите. На рис.1 линия 1, характеризующая этот процесс, параллельна оси pH .
118

2. Ионно-молекулярные равновесия, не связанные с величиной потенциала. Они зависят только от величины pH :
|
Zn |
2 |
2H2O Zn(OH)2 |
2H |
|
при активности |
|
|
ход происходит при pH = 5,13 ед. (рис 3.3, 2);
a |
Zn |
2 |
|
|
|||
|
|
|
=1 фазовый пере-
6’);
Zn |
2 |
2H |
O HZnO |
|
3H |
|
|
2 |
|
||||
|
|
2 |
|
|
|
фазовый переход при
pH
=9,67 ед. (рис.1,
HZnO2 ZnO22 H фазовый переход при pH =13,11 ед. (рис 3.3, 4)
На диаграмме Пурбэ им отвечают линии, параллельные оси потенциалов.
3. |
Равновесия, которые зависят как от потенциала, так и от |
pH |
: |
||||
|
|||||||
Zn(OH) |
|
|
Zn0 |
2H O, фазовый переход при pH |
=13,11 ед. |
||
2 |
2H 2e |
||||||
|
|
|
2 |
|
|
|
|
(рис.1, 3)
|
|
|
|
|
|
|
RT |
|
a |
|
|
|
a |
2 |
|
|
|
обр |
|
|
0 |
|
|
|
Zn(OH) |
H |
|
||||||
E |
|
E |
|
|
ln |
|
2 |
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||
Zn(OH) 2 |
/Zn |
Zn(OH) 2 |
/Zn |
nF |
|
a |
|
a |
2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
Zn |
H |
O |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
, E
0 Zn(OH)
2 |
/Zn |
|
0,4B
(3.16)
При
aZn
=1 и
aZn(OH) 2
= 1,
обр |
|
|
E |
|
/Zn |
Zn(OH) |
2 |
= –
0,40 – 0,059
pH
. В этой области по-
тенциал цинка не зависит от активности ионов металла, а только от кис-
лотности среды |
pH |
(рис.1, 3, параллельная линиям а и б). |
|
4.Равновесия, которые зависят от активности ионов металла и
кислотности среды – pH:
|
2 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
2H2O 2e Zn |
4OH |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
ZnO2 |
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
данную |
|
|
реакцию |
в |
|
щелочной |
|
среде |
|
можно |
|
|||||||||||||||||||
[Zn(OH) |
|
|
2 |
|
|
Zn |
0 |
4OH |
|
, E |
0 |
|
|
|
|
|
1,216B |
|||||||||||||
4 |
] |
2e |
|
|
|
|
|
|
2 |
/Zn |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Zn(OH) |
] |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
a |
|
|
|
2 |
|
||
|
|
|
|
|
|
обр |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
[Zn(OH) 4 |
|
|||||||
|
|
|
|
E |
|
2 |
|
E |
|
|
|
|
2 |
|
|
|
|
ln |
] |
|
, |
|||||||||
|
|
|
|
|
|
/Zn |
|
|
|
|
|
/Zn |
|
|
|
|
|
4 |
|
|
||||||||||
|
|
|
|
|
[Zn(OH) |
] |
|
[Zn(OH) |
] |
|
|
nF |
|
a |
|
a |
|
|
|
|||||||||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
Zn |
|
|
- |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
при стандартных условиях
записать в виде
(3.17)
E[обрZn(OH) 4 ]2 /Zn 1,216 0,029lga[Zn(OH) 4 ]2 0,118lgaOH- .
В щелочной среде цинк проявляет амфотерные свойства и образует при окислении хорошо растворимые цинкат–ионы [Zn(OH)4]2-, поэтому его равновесный потенциал будет зависеть от активности его ионов и от активности ионов OH-, то есть pH раствора электролита (рис. 1, 5).
Параллельные линии – зависимости обратимых потенциалов водо-
119

родного (а) и кислородного (б) электродов от pH |
: |
|||||||||||||||||||||
|
|
Для водородного электрода: |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в кислых растворах H3O |
e |
1/2H2 H2O |
|
|
|||||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
|
E |
обр |
E |
0 |
|
|
|
RT |
ln |
a |
H |
|
. |
|
|
||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
H |
|
H |
/H2 |
nF |
P |
1/ 2 |
|
|
||||||||||
|
|
|
|
|
/H2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
E |
0 |
= 0 |
B,при T |
= 298 K и парциальном давлении |
||||||||||||||||||
|
||||||||||||||||||||||
|
H |
/H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
обр |
|
|
RT |
2,303lga |
|
0,059pH |
, |
|
|||||||||||
|
|
|
E |
/H2 |
|
F |
|
|
||||||||||||||
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||
PH
(3.5)
= 1 атм.
2
(3.6)
где величина
pH
=–
lga |
H |
|
|
||
|
|
влияет на величину равновесного потенциала
водородного электрода. |
|
|
|
|
|
|
||
в нейтральных и щелочных растворах |
H |
|||||||
E |
обр |
E |
0 |
|
RT |
ln |
aH2O |
|
H2 |
H2 |
n·F |
aOH- PH2 |
|||||
|
|
|
|
|
|
1/ 2 |
||
|
|
|
|
|
|
O e 1/ 2H |
|
OH |
|
2 |
2 |
|
||
|
|
|
, |
(3.7) |
|
при
E0 H2
0,82826
B
,
PH2
= 1 атм.,
T
=298 K,
aH2O
=1
|
обр |
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
EH2 0,82826 |
|
|
|
|
2,303lgaOH |
0,82826 0,059lgaOH . |
(3.8) |
||||||||||||||
|
F |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Растворенный в электролите молекулярный кислород – также будет |
|||||||||||||||||||||
участвовать в катодных реакциях на поверхности металла: |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в кислых растворах |
|
O2 4H |
4e 2H2O |
|
|
||||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
E обр E 0 |
|
RT |
ln |
aH PO2 |
, |
|
|
(3.9) |
|||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
O2 |
|
|
O2 |
|
nF |
|
2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
a |
O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
при E 0 |
=+1,23 |
B, P =1атм., T =298 K, a |
H O |
= 1 |
|
|||||||||||||||||
|
O |
2 |
|
O |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||
|
|
Eобр 1,23 |
RT |
2,303lga |
|
1,23 0,059pH . |
(3.10) |
|||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
O |
|
|
|
|
F |
|
|
|
H |
|
|
|
|
|
|
|
||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
в нейтральных и щелочных растворах O |
|
|
|||||||||||||||||||
2H O 4e 4OH |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
2 |
|
120
