
Коррозия лабы
.pdf
циалов двух металлов в контакте относительно стандартного хлорсеребряного электрода сравнения в начале и в конце опыта. Записать данные в табл. 1
Объем выделившегося водорода рассчитывается по разнице уровней раствора в бюретках от исходного значения на момент времени равном нулю.
|
|
Объемы выделившегося водорода на исследуемом металле |
Vt |
Me |
(в |
||||
|
|
|
|||||||
см |
3 |
или мл) и на контактирующем металле |
V |
|
конт |
за каждый заданный про- |
|||
|
t |
|
|||||||
|
|
|
|||||||
межуток времени приводится к нормальным условиям, пользуясь уравнением Менделеева–Клайперона:
V0Me
|
V |
|
Me |
273 (P ) |
|
|
|
||
t |
|
|
||
|
|
|
||
|
|
760 (273 t) |
||
,
(3.7)
где Vt |
Me |
– объем выделившегося водорода за промежуток времени при |
|
||
условиях проведения опыта, мл; |
||
P – атмосферное давление, мм рт. ст.; |
||
– парциальное давление водяных паров над раствором при условиях |
||
опыта, мм рт. ст.; |
||
t – температура, 0 С . |
||
Объем выделившегося водорода на контактирующем металле (приведенный к нормальным условиям) по измеренной величине силы тока между контактирующими металлами может быть рассчитан по закону Фарадея:
|
|
|
V |
|
конт |
I |
qv |
, |
(3.8) |
||
|
|
|
|
|
|
|
|||||
|
|
0 |
|
|
|
|
|||||
где I – средняя сила тока за заданный промежуток времени , А; |
|
||||||||||
|
=(τn–τn-1) – время контакта образца с коррозионной средой, за период |
||||||||||
от предыдущего измерения, час; |
|
|
|
|
|||||||
qv |
– объемный электрохимический эквивалент водорода, см3/А·ч. |
|
|||||||||
|
Затем следует сложить объемы выделившегося водорода за каждые |
||||||||||
промежутки времени |
V V |
Me |
V |
конт |
|
|
|
||||
0 |
|
0 |
|
0 . |
|
|
|||||
Учитывая, что при растворении одного грамм-эквивалента металла выделяется при нормальных условиях 11,2 л водорода, определяем количество растворенного металла g , г
g |
|
V0 |
|
|
AМе |
, |
(3.9) |
11200 |
z |
||||||
где AМе – атомный вес металла; z – изменение его валентности.
31

Тогда скорость коррозии |
|
|
|
|
|
|
|
Квес ,г/м2·час можно рассчитать по формуле |
|||||||
|
K |
|
|
g |
4 |
|
(3.10) |
|
вес |
S |
10 |
, |
|
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
где S – поверхность с обеих сторон образца, см2; |
|
||||||
– время опыта, час. |
|
|
|
|
|
|
|
Глубинный показатель коррозии |
П , мм/год (проницаемость) рассчи- |
||||||
тывается по формуле |
|
|
|
|
|
|
|
П
K |
|
8,76 |
|
вес |
|||
|
|
||
|
d |
||
|
|
Ме |
|
,
(3.11)
где
d Ме
– плотность металла, г/см3.
По рассчитанному глубинному показателю коррозии определить группу и балл стойкости металла в данной коррозионной среде.
По этим же формулам рассчитываются средние значения
V0
,
g
,
К вес
,
и |
П |
за все время опыта для заданных условий. |
|
|
Экспериментальные и расчётные данные приводят в сводных табли- |
цах, примерная форма которых дается ниже.
|
|
|
|
|
|
|
|
Таблица 2 |
|
Коррозионные характеристики ……… образцов |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
V0 , |
g |
, |
|
П , |
|
№№ |
Наличие |
Общее |
Квес , |
Группа и |
||||
время опы- |
мл |
г |
|
г/м2∙час |
мм/год |
балл |
||
образцов |
контакта |
|
||||||
та, час. |
|
|
|
|
|
стойкости |
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
нет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
есть |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Графически выражается зависимость объёмов выделившегося водорода на основном и контактирующем металлах, приведенного к нормаль-
ным условиям (отнесенного к единице поверхности и времени)
V0Me
,
V конт 0
и V – (на одном рисунке) и скорости коррозии от времени процесса К
0 вес
– (без контакта и в контакте).
По экспериментально измеренным компромиссным потенциалам исследуемого металла без контакта и с контактирующим металлом можно построить коррозионную диаграмму. Значения обратимых потенциалов для катодного и анодного процессов рассчитываются по уравнению Нерн-
ста: |
E |
обр E |
обр для катодной реакции выделения водорода; |
|
|
к |
Н 2 |
Eобр a
Eобр
Ме
для
анодной реакции окисления металла в данной среде (или определять из диаграммы Пурбэ). Компромиссные потенциалы под током коррозии металла без контакта Ех и в контакте Еy, приведенные к шкале нормального
32

водородного электрода, необходимо пересчитать из величины измеренного значения потенциала металла без контакта относительно хлорсеребряного электрода сравнения по формуле (3.9)
EМнвэe EМхсэe Eхсэобр , |
(3.12) |
где
E нвэ М e
– потенциал металла относительно нормального водородного элек-
трода, В; EМхсeэ – потенциал металла относительно хлорсеребряного элек-
трода сравнения, В;
E обр хсэ
– обратимый потенциал хлорсеребряного электро-
да сравнения (+0,202 В для насыщенного раствора KCl)
Величины токов коррозии без контакта и в контакте определяем через взаимосвязь токового показателя коррозии с отрицательным весовым показателем, рассчитанного ранее (табл. 2)
К вес
=ja∙ qMe,
(3.13)
где, ja– анодная плотность тока, А/м2; |
|
qMe– электрохимический эквивалент корродирующего металла, |
г/А∙ч. |
Изменение скорости коррозии исследуемого металла при контакте будет зависеть от направления сдвига его компромиссного потенциала (анодная или катодная поляризация), возрастает или уменьшается поляризация анодного процесса.
Долю сопротивления каждой ступени (анодной или катодной) в общем сопротивлении всего процесса необходимо рассчитать по степени
контроля |
Ci |
данной ступени по формулам (2.1) – (2.3) (лабораторная |
работа №2):
Отчёт по работе должен состоять из введения, методики эксперимента, экспериментальных и расчетных результатов, графических зависимостей, обсуждения результатов, рекомендации по способу защиты металла от коррозии, выводов и списка использованной литературы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.Что такое объемный показатель коррозии, как он вычисляется и каков его физический смысл?
2.Как пересчитать объемный показатель коррозии в отрицательный весовой и глубинный?
3.Почему различные металлы в растворе кислоты одной и той же концентрации корродируют с различной скоростью?
4.Как изменится стационарный потенциал и скорость коррозии стального образца при увеличении концентрации соляной кислоты? Дать подробное объяснение.
33

5.Как влияет на скорость коррозии контакт образца с металлом, имеющим потенциал более положительный, в другом случае – более отрицательный?
6.Какие знаете способы подавления коррозии с водородной деполяризацией?
7.Каковы особенности процесса коррозии с водородной деполяризацией?
8.В каких случаях возможен процесс коррозии с выделением водорода с термодинамической и кинетической точек зрения?
9.Как будет меняться скорость коррозии и стационарный потенциал стального образца во времени при растворении его в ограниченном объеме раствора соляной кислоты?
10.Влияет ли скорость движения электролита на скорость коррозии с водородной деполяризацией?
11.Построить модельную коррозионную диаграмму для качественной оценки результатов Вашего опыта и показать на ней реализацию защитного или разностного эффекта. Как это соотносится с количеством выделяющегося водорода?
ИССЛЕДОВАНИЕ КОРРОЗИИ МЕТАЛЛА НА МОДЕЛИ МИКРОЭЛЕМЕНТА
Лабораторная работа 4
Коррозия металлов в электролитах является результатом работы многочисленных короткозамкнутых микроэлементов, образующихся на его поверхности. Разность потенциалов между отдельными микроучастками металла, являющаяся причиной появления микроэлементов, а, следовательно, и коррозии металла, возникает в результате наличия в нем примесей, легирующих компонентов, структурной неоднородности металла, различного состояния его поверхности. Причиной появления микропар может быть также различие в составе электролита у разных микроучастков поверхности.
Коррозия является результатом ряда сопряженных реакций. На анодных участках микрогальванопары в ходе коррозии происходит ионизация металла:
Me ne Men . |
(4.1) |
34

На катодных участках: возможно выделение водорода (у металловс более отрицательным обратимым потенциалом, чем у водородного элек-
трода): |
|
|
|
|
|
|
в кислой среде разряжаются ионы водорода |
||||||
|
|
|
, E |
0 |
0,0B; |
|
2H |
2e H |
|||||
|
|
|||||
|
|
2 |
|
|
|
|
E |
обр |
|
RT |
2,303 lg a |
|
|
0,059 pH. |
|
|
|
|||||
|
F |
H |
|
||||
|
H /H |
|
|
|
|
||
|
2 |
|
|
|
|
(4.2)
В щелочной среде |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
0 |
|
|
|
2H |
|
O 2e H |
|
2OH |
, E |
0,828 B |
, |
|||
2 |
2 |
|
|
|||||||
|
|
|
|
|
|
|
|
|||
E |
обр |
0,828 |
|
RT |
2,303lg a |
|
|
0,828 0,059lg a |
|
|
. |
|
|
|
|
|
|
||||||||
H |
|
F |
OH |
|
OH |
|
||||||
|
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
(4.3)
|
|
|
|
Eобр 0,828 0,059lg |
Kw |
, |
(4.4) |
||
|
|
|
|
|
|||||
|
|
|
|
H2 |
|
aH |
|
||
|
|
|
|
|
|
|
|
||
где |
Kw [H |
|
- |
|
14 |
моль/л – константа автопротолиза воды. |
|||
|
] [OH |
] 10 |
|
||||||
|
|
|
|
|
|
|
|||
|
Более |
|
вероятный процессом на катодных |
участках – ионизация |
|||||
(восстанавлление) кислорода, растворенного в электролите.
При коррозии металлов с более положительным обратимым потенциалом для анодной реакции по сравнению с обратимым потенциалом для катодной реакции выделения водорода, на катоде будет идти только процесс ионизации кислорода.
В зависимости от кислотности электролита процесс ионизации мо-
лекулярного кислорода может описываться реакциями: |
|
||||||||||||||||
в кислых растворах |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O2 4H |
|
2H 2O , E 0 |
|
|
|
|
|
|
|
|
|
||||||
4e |
=+1,23 |
B |
(4.4) |
||||||||||||||
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
a |
4 |
|
P |
|
|
|
|
||
|
обр |
|
|
0 |
|
H |
|
|
|
|
|
||||||
E |
E |
|
ln |
|
|
|
O |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
2 |
, |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
O |
2 |
|
O |
2 |
nF |
|
|
|
2 |
|
|
|
|
||||
|
|
|
|
|
|
|
a |
|
O |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
при
PO2
=1атм., n=4, T =298 K, aH O |
= 1 |
|
|
|
||||
|
|
|
2 |
|
|
|
|
|
обр |
1,23 |
RT |
|
|
|
|
1,23 0,059pH . |
|
EO2 |
|
2,303lg a |
|
|
||||
F |
H |
|||||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
Обратимый потенциал кислородного электрода положительнее водородного электрода на 1,23 B:
E |
обр |
1,23 0,059pH |
1,23 E |
обр |
. |
|
|||
|
H2 |
|
|||||||
O |
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
В щелочных растворах |
|
|
|
|
|
|
|
||
O2 |
|
|
, E0 |
|
|
|
|
|
|
2H 2O 4e |
4OH |
/ OH |
=+0,401 |
B, |
|||||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
(4.5)
(4.6)
35

|
|
|
|
|
|
|
RT |
|
a |
2 |
|
·P |
|
|
|
|
|
|
|
|
|
H |
O |
||||
E |
обр |
|
E |
0 |
|
|
ln |
|
|
O |
|||
|
|
|
|
2 |
|
|
2 |
||||||
O2 / OH |
|
O2 / OH |
|
nF |
|
a |
4 |
|
|
||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
,
при PO |
2 |
=1атм.,n=4,T |
||||
|
|
|
|
|
|
|
E |
обр |
|
|
0,401 |
||
|
|
|
|
|
||
O |
/ OH |
|
||||
|
|
|||||
|
2 |
|
|
|
|
|
=298 K, aH O |
= 1 |
2 |
|
RT |
2,303lga |
|
0,401 0,059lga |
|
. |
|
F |
|
|
||||
OH |
OH |
|
||||
|
|
|
Поэтому с термодинамической точки зрения процессы ионизации кислорода на катоде будут протекать в первую очередь в коррозионном процессе, так как обратимый потенциал имеет значительные положительные значения (чем больше кислотность раствора, тем более положителен обратимый потенциал).
Если катодный процесс протекает при малых плотностях тока и свободном подводе кислорода, то изменение потенциала катода с изменением плотности тока (рис.1) определяется логарифмической зависимостью (участок АВС)
ηО2 = а + b∙lg(jKt) |
(4.7) |
Из-за незначительной растворимости |
кислорода в электролитах |
(до 2,5·10-4 моль/л) уже при незначительных плотностях тока поверхностная концентрация кислорода снижается, а потенциал катода значительно смещается в область электроотрицательных значений (рис.1, участок CD).
Рис.1. Суммарная поляризационная кривая для катодного процесса с кислородно-водородной деполяризацией
36

При концентрации кислорода у поверхности катода равной нулю (сколько кислорода поставляется диффузией в единицу времени к поверхности катода, столько его мгновенно ионизируется в электрохимической реакции) катодная поляризация стремится к бесконечности. Реакция восстановления молекул кислорода будет протекать на предельной плотности тока диффузии
jдифпр n F Kдиф |
CO 2 |
, |
(4.8) |
|
|||
|
диф |
|
|
где n – число электронов в катодной электрохимической реакции; F – число Фарадея, А∙с/г-экв.;
Kдиф
– коэффициент диффузии молекул кислорода в электролите, см2/с;
диф
– толщина диффузионного слоя, см;
СО2 – концентрация растворенного кислорода в объеме раствора, моль/см3.
Как только потенциал катода сместится в область потенциалов, отрицательнее значения обратимого потенциала водородного электрода
Eобр H2
в этом растворе (рис.1, точка E), на катоде начнется восстановление
воды или ионов водорода (рис.1, участок ЕF). Потенциал катода будет изменяться при этом в соответствии с закономерностями водородной деполяризации (рис.1, участок DF). На катоде будут параллельно протекать реакции восстановления кислорода на предельной плотности тока (участок DG) и выделения водорода – совместная водородно-кислородная деполяризация.
Различные скорости доставки кислорода к различным участкам поверхности металла катода приводят к возникновению аэрационных коррозионных гальванопар. На более аэрируемых участках поверхности металла локализуется протекание катодного процесса, на что указывает сдвиг потенциала металла в положительную сторону от Eх до Ey за счет увеличения концентрации кислорода в электролите или облегчения доставки кислорода к поверхности металла перемешиванием электролита.
Перемешивание электролита в одном из пространств ячейки, облегчая диффузионные процессы (в результате уменьшения толщины диффу-
зионного слоя), что приводит к усиленной коррозии этих участков (с jдифпр 1 до jдифпр 2 рис. 2).
37
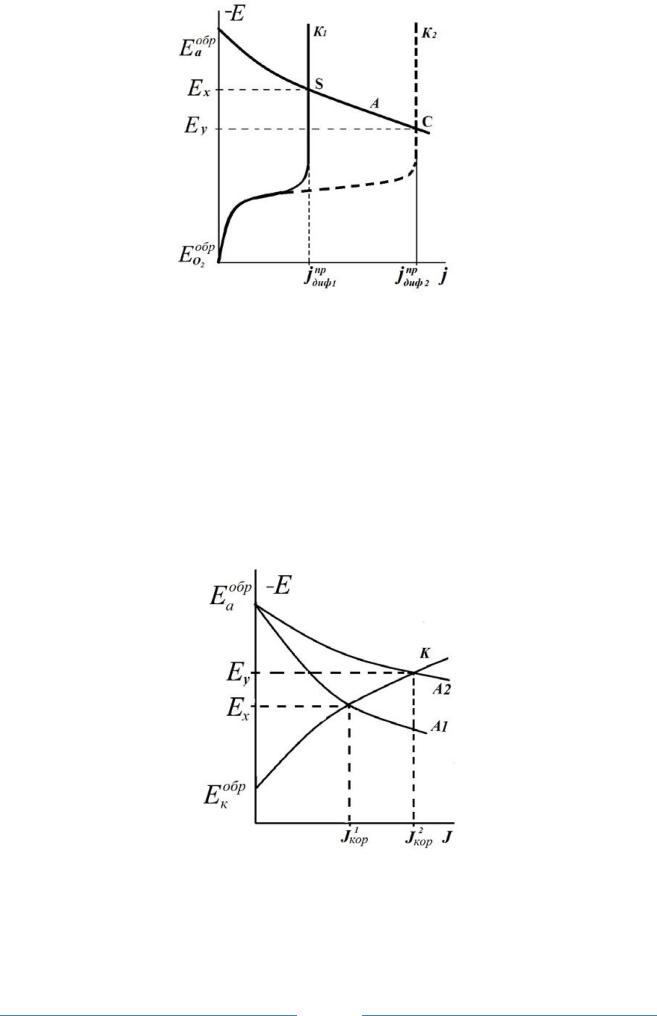
Рис.2. Коррозионная диаграмма влияния перемешивания электролита на катодный процесс
К1 и К2 – катодные поляризационные кривые без перемешивания и с перемешиванием электролита соответственно
Перемешивание электролита одновременно снижает концентрационную поляризацию и катодного, и анодного процесса (облегчая отвод первичных продуктов анодного процесса — ионов металла, протонов водорода в глубину раствора (рис. 3), что может вызывать и из-
менение обратимого потенциала металла
E обр М е
).
Рис.3. Коррозионная диаграмма влияние перемешивания на анодный процесс
А1 и А2 – анодные поляризационные кривые без перемешивания и с перемешиванием электролита соответственно
38

Скорость коррозии определяется в основном скоростью наиболее затруднено протекающей реакции. Степень затрудненности электродной реакции может быть оценена по величине её поляризации, т. е. смещению электродного потенциала от «равновесного» (обратимого) значения до установившегося «рабочего» значения под током при коррозии. Так как составляющие элемента включены по току последовательно, электродный процесс с большей поляризацией обычно и определяет скорость процесса в целом. При прочих равных условиях поляризация в значительной степени зависит от ряда факторов: вида электрода, состава электролита, степени его перемешивания, температуры. Все эти параметры, естественно, скажутся и на скорости коррозии.
Изучение влияния различных факторов на работу коррозионных микрогальванопар удобно производить на так называемой «модели микроэлемента». Эта модель представляет собой макрогальванический элемент с пространственно разделенными металлическими электродами относительно больших размеров, включенный в измерительную цепь, при помощи которой можно определять силу тока, протекающего в элементе, и потенциалы отдельных электродов. Это позволяет пространственно разделить анодные и катодные участки, направив большую часть электронов с микрокатодов на макрокатод за счет большей ЭДС макроэлемента, по сравнению с ЭДС микроэлемента, что позволяет замерять потенциалы анода и катода. Металл с более электроотрицательным потенциалом выполняет функцию макроанода (предполагается, что на всей его поверхности протекает только анодная реакция окисления металла), металл с более положительным потенциалом работает в гальваническом элементе макрокатодом.
По величине силы тока в элементе возможно рассчитать скорость коррозии металла – анода Kвес ,г/м2·час
K |
|
|
I |
|
A |
10 |
|
Ме |
|||||
|
|
|
|
4 |
||
|
вес |
|
Sан |
|
z F |
|
|
|
|
|
|
где I – сила тока в элементе, А;
Sан – рабочая (смоченная электролитом с см2;
AМе – атомный вес металла, г;
, |
(4.9) |
двух сторон) поверхность анода,
z – изменение валентности металла; F – число Фарадея, 26,8 А·час/г-экв.
По скорости коррозии может быть рассчитан глубинный показатель коррозии П , мм/год (проницаемость):
39
где
d Ме
|
K |
|
8,76 |
|
П |
вес |
|||
|
|
|||
|
|
|
||
|
|
d |
||
|
|
|
Ме |
|
– плотность металла, г/см3.
,
(4.10)
Цель работы – определение на модели микроэлемента скорости коррозии металла и влияние на нее перемешивания и температуры, установление вида деполяризации и определение природы контролирующей стадии коррозионного процесса.
Экспериментальная часть
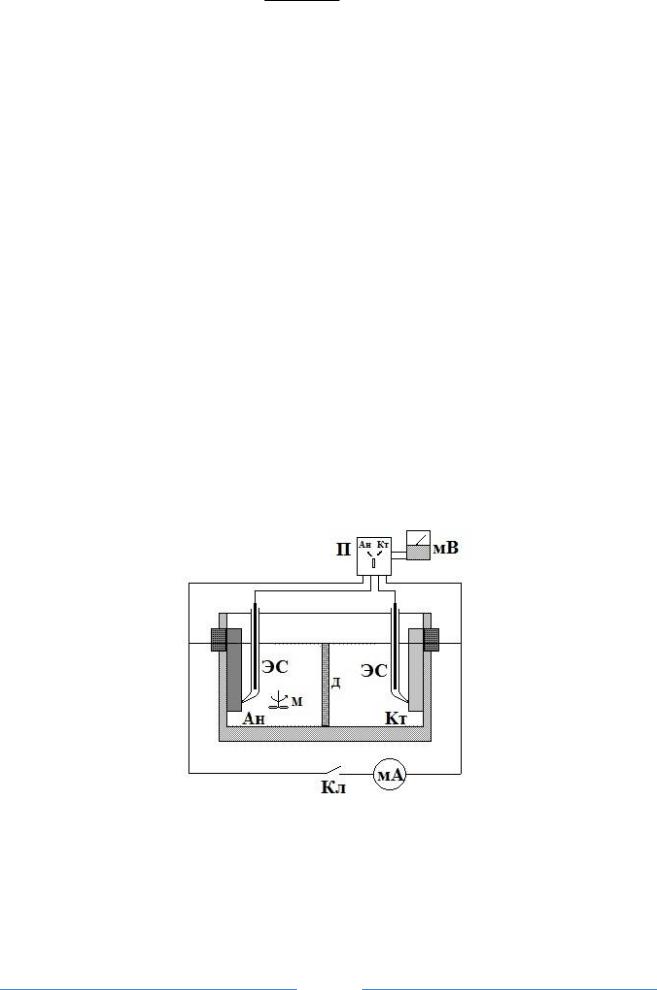
Металлические электроды зачистить наждачной бумагой, промыть дистиллированной водой и высушить фильтровальной бумагой. Металл с более электроотрицательным потенциалом выполняет функцию макроанода (предполагается, что на всей его поверхности протекает анодная реакция окисления металла), металл с более положительным потенциалом работает в гальваническом элементе макрокатодом (на всей его поверхности протекает катодная реакция восстановления окислителя, присутствующего в электролите). Электродами сравнения (ЭС) служат цинковые стержни, которые помещают во встроенные стеклянные геберы вблизи рабочих электродов.
Модельная ячейка микроэлемента и электрическая схема для работы приведены на рис. 4.
Рис. 4. Модельная ячейка микроэлемента и электрическая схема работы:
Ан – анод, Кт – катод, ЭС – цинковый электрод сравнения, Кл – ключ замыкания, П – переключатель для измерения потенциалов анода или катода, мА – миллиамперметр, мВ – милливольтметр, М – мешалка, Д – пористая диафрагма
40
