
Коррозия лабы
.pdf
значения поляризующего тока (по заданию преподавателя): 0,1; 0,2; 0,3; 0.5; 1,0; 2,0; 3,0; 5,0; 7,0; 10,0; 15,0;(20,0 ÷ 50,0) мА. При каждом из этих значений замеряют потенциал анода, катода и падение напряжения в электролите поворотом ручки переключателя измерения потенциалов (П) в соответствующее положение.
Экспериментальные и расчетные данные сводятся в таблицы, примерная форма которых приводится ниже.
Таблица 1.
Экспериментальные данные работы коррозионной гальванопары
Металл анода …… , металл катода …………. Электролит………..…;
Sан = ………см2; |
Sкт =………см2; Межэлектродное расстояние…………см. |
||||
|
|
|
|
|
|
Температура, |
Сила то- |
Падение напряжения в |
Потенциал по цинковому элек- |
||
0 С |
ка, I |
|
электролите U эл , B |
троду сравнения E , B |
|
|
мА |
|
|
анода |
катода |
|
|
|
|
|
|
По данным измерений построить коррозионную диаграмму, нанести на оси ординат потенциалы по цинковому электроду сравнения, а на оси абсцисс – величину тока. Определить по диаграмме максимальный корро-
зионный ток системы
I max
кор
.
Затем графически найти величину фактиче-
ского коррозионного тока |
Iкорфакт |
с учетом падения напряжения в электро- |
||||||||||
лите (рис.1). |
|
|
|
|
|
|
|
|
|
|
||
|
|
По величине силы тока в элементе рассчитать скорость коррозии ме- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
талла – анода Kвес ,.г/м2·ч |
|
|
|
|
|
|
|
|
|
|||
|
|
K |
|
|
|
I |
|
A |
10 |
|
|
|
|
|
|
|
Ме |
|
|
||||||
|
|
|
|
|
|
|
4 |
, |
(2.6) |
|||
|
|
|
вес |
|
Sан |
|
z F |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
где |
I – сила тока в элементе, А; |
|
|
|
|
|
|
|||||
Sан |
– рабочая (с двух сторон смоченная электролитом) поверхность анода, |
|||||||||||
см2; |
|
|
|
|
|
|
|
|
|
|
||
|
Ме – атомный вес металла, г; |
|
|
|
|
|
|
|||||
A |
|
|
|
|
|
|
|
|
|
|
|
|
z |
– изменение валентности металла; |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
F – число Фарадея, 26,8 А·ч/г-экв. |
|
|
|
|
||||||||
|
|
По скорости коррозии рассчитывается глубинный показатель корро- |
||||||||||
зии П, мм/год (проницаемость): |
|
|
|
|
|
|
||||||
|
|
|
П |
Kвес |
8,76 |
, |
|
(2.7) |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
d Ме |
|
|
|
|
|
где d Ме – плотность металла, г/см3.
21

Вычислить степень контроля отдельных стадий процесса. Окончательные расчетные данные дать в сводной таблице по форме, приведенной ниже. Привести коррозионную диаграмму.
Таблица 2.
Основные параметры работы коррозионного элемента
Поля- |
Падение |
Степень |
|
Коррози- |
Ско- |
|
||||||
риза- |
|
рость |
|
|||||||||
напряжения |
контроля, |
|
онный ток, |
|
||||||||
ция, |
Контроли- |
корро- |
|
|||||||||
|
% |
|
I , мА |
|
П, |
|||||||
B |
в электроли- |
|
|
рующий |
|
зии |
|
|||||
|
|
|
|
|
|
|
мм/год |
|||||
|
|
те |
|
|
|
процесс |
|
|
|
|
|
|
|
|
|
|
|
Макс. |
|
Факт. |
|
|
|||
|
|
|
|
|
|
|
|
|||||
Eан |
Eкт |
U эл , B |
Cан |
Cкт |
CR |
|
|
Kвес |
, |
|
||
|
|
|
|
|
|
|
г/м2∙час |
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Отчет по работе должен содержать введение, методику эксперимента, экспериментальные результаты, обсуждение результатов, рекомендации по способу защиты металла от коррозии, выводы и список использованной литературы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.Какие потенциалы отождествляются с обратимыми потенциалами анода и катода?
2.Чем вызвана анодная и катодная поляризация при прохождении электрического тока через электроды?
3.Что такое полностью и неполностью поляризованные коррозионные системы?
4.Что такое контролирующий фактор и степень контроля коррозионного процесса?
5.Какой контроль коррозионного процесса в Вашей работе?
6.Напишите электродные реакции, протекающие на электродах в Вашей работе.
7.Будет ли Ваша двухэлектродная система работать как полностью поляризованная, если электроды соединить медной проволочкой?
8.При каких условиях система будет корродировать с максимальным током коррозии?
9.Как изменится ток коррозии в двухэлектродной системе при неизменном омическом сопротивлении, если уменьшится величина анодной и катодной поляризации?
10.Как изменится ток коррозии и величина потенциалов анода и катода, если омическое сопротивление системы будет возрастать (объяснить на диаграмме).
22

11.Как по изменению потенциалов электродов и падения напряжения на омическом сопротивлении коррозионного элемента определить величину тока коррозии?
12.Почему фактическая величина тока коррозии меньше максимального
тока?
13.Можно ли без внешнего источника тока снять полную коррозионную диаграмму?
14.Что называют потенциалом коррозии системы («компромиссным потенциалом») и для чего необходимо знание этой величины?
15.Как изменится величина тока коррозии при замене электролита с 0,1н NaCI в элементе Сu – Fe на 0,1н HCI?
ВЛИЯНИЕ ПРИРОДЫ КОНТАКТИРУЮЩЕГО МЕТАЛЛА НА СКОРОСТЬ ПРОЦЕССА КОРРОЗИИ С ВОДОРОДНОЙ ДЕПОЛЯРИЗАЦИЕЙ
Лабораторная работа 3
У металлов с более отрицательным обратимым потенциалом, чем у водородного электрода в той же коррозионной среде, процесс коррозии может протекать с водородной деполяризацией и с кислородной (смешанной) деполяризацией. При низкой скорости доставки кислорода и высокой коррозионной активности среды долей последнего процесса можно пренебречь. В этом случае скорость коррозии металла может быть рассчитана по объёму выделившегося водорода, учитывая эквивалентность по массе разрушающегося металла в этой реакции
Me nH |
|
Me |
n |
n / 2H |
, |
(3.1) |
|
|
|||||
|
|
|
|
2 |
||
где Me – корродирующий металл. |
|
|
|
|
||
Эта реакция имеет электрохимический характер и её интенсивность определяется степенью затруднения работы микрогальванопар, образующихся на поверхности корродирующего металла. В простейшем виде эту микрогальванопару можно представить как
|
|
|
Me │электролит│ |
|
2 |
' |
), |
|
|
|
H |
( Me |
|||
|
|
|
|
|
|
|
|
где |
Me |
' |
– инородный металл (примесь, легирующий компонент сплава |
||||
|
|||||||
или структурная неоднородность), на котором протекает реакция выделения водорода.
23

Протекающие реакции в коррозионном элементе, например, для кислой среды выглядят так:
при
анодная – ионизация металла |
|
Me - ne |
|
Me |
n |
; |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
||
катодная – выделение |
водорода |
H |
|
e |
|
1 / 2H |
, E |
0,0B. |
|||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||||||||||||
|
|
E |
обр |
E |
0 |
|
RT |
ln |
a |
H |
|
. |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
H |
|
H |
nF |
P |
1/ 2 |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
/H2 |
/H2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
T |
= 298 K, n=1 и парциальном давлении |
PH |
2 |
= 1 атм. |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Eобр |
|
|
RT |
2,303lga |
|
|
0,059pH , |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H /H |
2 |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3.2)
где величина pH =– lga |
H |
|
|
|
дородного электрода.
в щелочных растворах
влияет на величину обратимого потенциала во-
|
|
|
|
|
E |
0 |
0,828 B |
|
H O e 1 / 2H |
|
|
|
|||||
|
OH |
, |
|
(3.3) |
||||
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
при
PH2
|
|
|
|
обр |
|
0 |
|
|
|
RT |
|
|
a |
H2O |
|
|
|
|
|||||
|
|
|
E |
E |
|
|
ln |
|
|
|
, |
|
|
||||||||||
|
|
|
H |
|
H |
|
n·F |
a |
|
|
|
|
P |
1/ 2 |
|
|
|||||||
|
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
- |
H |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
= 1 атм., T |
=298 K, aH O =1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
E |
обр |
0,828 |
RT |
2,303lg a |
|
|
|
|
0,828 0,059lg a |
|
. |
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
H |
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
F |
|
|
|
|
OH |
|
|
|
OH |
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
В зависимости от легкости протекания анодной реакции окисления металла или катодной реакции выделения водорода процесс коррозии может подразделяться на коррозию с катодным или анодным контролем. При высоком электрическом сопротивлении электролита может наблюдаться «омический» контроль процесса.
Поэтому наиболее эффективное воздействие на скорость коррозии металла можно оказать, изменяя интенсивность протекания того электродного процесса, который определяет скорость коррозии. Вещества, замедляющие скорость коррозии металла, носят название ингибиторов.
Определение скорости коррозии металла по количеству выделившегося водорода во много раз проще, чем весовой метод. Подобным способом удается снять кинетику коррозии во времени. Однако этот способ не может быть использован при наличии кислородной деполяризации и для металлов с более положительным обратимым потенциалом, чем у водородного электрода. Коррозионная устойчивость металла не может быть оценена по выделению водорода и в случае межкристаллитной коррозии.
Присоединение к корродирующему металлу другого металла изменит локальную и общую скорость коррозии, так как изменяется поляризация электродных процессов.
Если присоединяется металл, имеющий более положительный по-
24
тенциал – макрокатод (при отсутствии на испытуемых образцах оксидных пленок), в средах неокисляющих кислот можно ожидать снижения локальной коррозии (положительный разностный («дифференц») эффект).
|
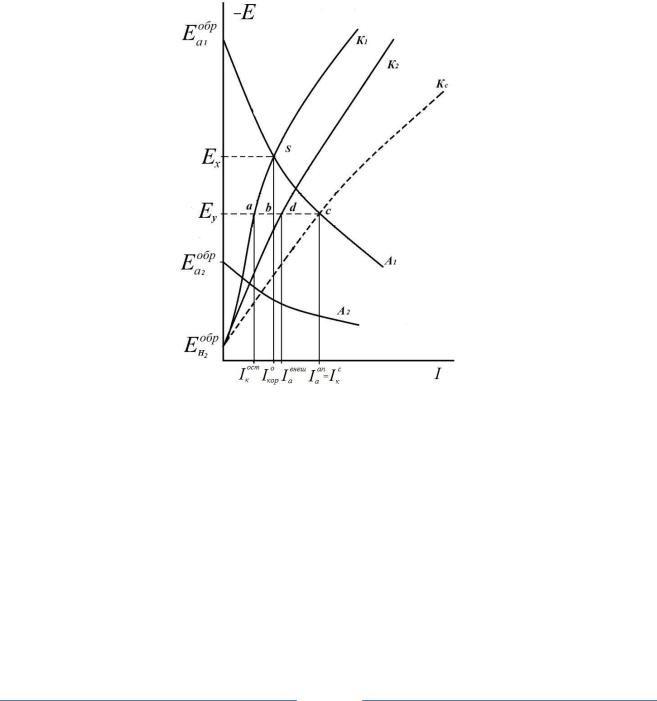
Рассмотрим процесс коррозии на примере Zn, имеющего обратимый |
|||
потенциал для анодной реакции в данной среде |
E |
обр |
. Катодным процессом |
|
|
|
|
||
|
|
a1 |
|
|
|
|
|
|
|
при |
коррозии цинка будет процесс выделения |
водорода, тогда для |
||
Eобр |
Eобр . В такой двухэлектродной системе (рис. 1) установится значение |
|||
к |
Н 2 |
|
|
|
компромиссного потенциала Ех(при отсутствии сопротивления электролита). Анодный и катодный процессы будут протекать сопряженно, то есть Iaлок.=Iклок.= I0кор = [ExS] –это и есть локальный (внутренний) ток коррозионной гальванопары Zn–анод–Н2 – катод (водород, выделяющийся на катодных участках поверхности Zn).
Рис. 1. Коррозионная диаграмма анодной поляризации системы при подключении макрокатода
А1 и К1 – анодные и – катодные поляризационные кривые для основного металла;
А2 и К2 – для контактирующего металла; Eaобр1 и Eaобр2 – обратимые потенциалы для |
|
анодных реакций на основном и контактирующем металлах; I 0 – ток коррозии |
|
основного металла без контакта; I к |
кор |
– остаточный локальный катодный ток на ос- |
|
ост |
|
новном металле при анодной поляризации, который будет определять локальный (внутренний) ток его гальванопары; Iaвнеш – внешний анодный ток (электроны идут
с основного металла на контактирующий металл – макрокатод); Iаап – ток анодного растворения основного металла при анодной поляризации системы
25

При подключении макрокатода, например Cu, (обратимый потенци-
ал для анодного процесса для Cu – |
E |
обр |
положительнее Ex, следовательно, |
|
|
||
|
a2 |
|
|
|
|
|
анодный процесс на меди термодинамически запрещен) на один цинковый анод будут работать 2 катода (катодные участки на цинке и меди), оба будут ассимилировать электроны, образующиеся при анодной реакции окисления цинка.
Так как в агрессивной среде только один катодный деполяризатор (ионы водорода в кислой среде), то на цинковом и медном электродах будет протекать одна и та же катодная реакция – выделение водорода, поэтому катодные поляризационные кривые К1 и К2 выходят из одной точки
– обратимого потенциала водородного электрода E обр .
H2
В многоэлектродной коррозионной системе сумма анодных токов всегда должна быть равна сумме катодных токов. Суммарная катодная кривая Кс строится методом сложения катодных токов при постоянных
значениях потенциалов линия – [ E |
обр |
Кс] (рис. 1). |
|
|
|
|
H |
|
|
2 |
|
Точка пересечения суммарной катодной кривой с анодной кривой, точка С, даст значение общего анодного тока системы (Iаап=Iкс). При этом токе единый компромиссный потенциал системы от значения Ex (для локальной короткозамкнутой системы цинк – анод, цинк – катод)) сместился в область более положительных значений – вдоль анодной поляризационной кривой для корродирующего металла до Ey. Установится новый компромиссный потенциал трех-электродной системы – Ey.
Е=Ex –Ey – это и есть анодная поляризация коррозионной системы после подключения макрокатода.
При потенциале Еу локальный катодный ток для Zn–Iклок = Iкост= [Eya] и будет определять локальный (внутренний) ток гальванопары Zn– анод–Н2–катод, он уменьшится с [ExS] до [Eya].
Явление уменьшения локального тока коррозии под действием внешней анодной поляризации называется положительным разностным (дифференциальным) эффектом (+) РЭ. Величина на которую уменьшится локальный ток двухэлектродной системы [ExS]–Eya] =[ab] – величина (+) разностного эффекта.
При анодной поляризации системы до Ey появится внешний анодный ток (часть электронов идущих с Znна Cu – макрокатод (рис.1), отрезок [ас] равный отрезку [Eyd] – ток идущий на выделение водорода на контактирующем металле) Iавнеш= Iаап–Iкост
Работа коррозионной гальванопары (Zn–анод–Н2–катод) будет тормозиться, но скорость коррозии металла при анодной поляризации увеличится с I0кордо Iаап за счет облегчения протекания контролирующего катодного процесса (увеличение катодной поверхности и уменьшения перена-
26

пряжения для реакции выделения водорода при подключении макрокатода).
Когда присоединяется металл, имеющий более отрицательный обратимый потенциал, чем обратимый потенциал для корродирующего металла, последний поляризуется катодно (рис. 1, лабораторная работа № 5). По этой причине можно ожидать некоторого уменьшения локальной скорости коррозии на испытуемом образце. Снижение скорости коррозии будет зависеть от поляризуемости катодного процесса выделения водорода: при большей поляризуемости произойдет более заметное уменьшение скорости локальной коррозии (+ЗЭ – положительный защитный эффект).
На скорость коррозии с водородной деполяризацией могут оказывать влияние примеси ионов металлов, находящихся в растворе электролита. Ряд ионов металлов из раствора способны контактно осаждаться - выделяться в виде примесного металла на поверхности корродирующего металла. Изменяется природа металла катодных участков, меняются величины констант «а» и «в» в уравнении Тафеля для процесса выделения водорода.
Термодинамически осаждение примесных ионов в виде металла возможно, если значение равновесного (обратимого) потенциала примесного
металла
E обр Меприм
будет
положительнее обратимого потенциала для корро-
дирующего
уравнению
металла |
|
обр |
. Выразив равновесные потенциалы металлов по |
Мекор |
|||
|
E |
|
|
Нернста, можно переписать неравенство в виде
E |
обр |
|
(E |
0 |
|
R T |
ln C |
|
|
) |
|
|
|
|
|
||||||||
Меz |
/ Ме |
Меz / Ме |
z F |
Ме |
Z |
||||||
|
|
|
|
|
|||||||
|
|
прим |
|
прим |
|
|
|
|
Eобр Мекор
, (3.4)
где CMeZ+ –концентрация примесных ионов в электролите, г-ион/л (активность в уравнении Нернста может быть заменена на концентрацию, так как при этом коэффициент активности близок к 1).
Из неравенства (3.4) следует, что предельно допустимая концентрация примесных ионов в электролите, при достижении которой невозможно осаждение примесных ионов в виде металла определяется уравнением
|
z F |
обр |
обр |
|
|
СМеz exp[ |
|
(EМекор |
EМеz / Ме |
)]. (3.5) |
|
R T |
|||||
|
|
прим |
|
||
|
|
|
|
Из уравнения следует, что предельно допустимая концентрация примесных ионов в электролите в наибольшей мере зависит от потенциала корродирующего металла. При коррозии поверхность металла, как прави-
ло, приобретает стационарное (компромиссное) значение |
|
ст |
, |
||
Мекор |
|||||
|
|
|
E |
|
|
сдвинуто относительно |
Eобр |
в положительную сторону. |
|
|
|
|
Мекор |
|
|
|
|
которое
При меньшем перенапряжении выделения водорода на вновь образовавшихся участках стационарный потенциал корродирующего металла
27
будет сдвигаться в положительном направлении (поляризоваться анодно, как в приведенном ранее случае подключения макрокатода) до рабочего
значения
E |
раб |
|
|
Мекор |
|
, растет скорость выделения водорода и при катодном кон-
троле всего процесса увеличивается скорость коррозии (саморастворения) металла. Если перенапряжение выделения водорода на примесном металле больше (выше), чем на корродирующем металле, стационарный потен-
циал
E |
обр |
|
|
Мекор |
|
сдвигается
в отрицательную сторону до рабочего значения
E |
раб |
|
|
Мекор |
|
ближе к
E |
обр |
|
|
Мекор |
|
, то есть поляризоваться катодно (менее анодно), что
уменьшает скорость коррозии металла.
В обоих случаях меняются как возможности осаждения примесных ионов в виде металла, так и предельно допустимые концентрации примес-
ных ионов в электролите, так как последняя будет определяться |
Eст |
или |
|
|
|
Мекор |
|
E |
раб |
|
|
|
|
|
|
Мекор |
|
|
|
С |
|
|
exp[ |
z F |
(E |
ст |
(E |
раб |
) E |
обр |
|
)]. |
|
|
|
|
|
||||||||||
Ме |
z |
R T |
Ме |
Ме |
Ме |
z |
/ Ме |
||||||
|
|
|
|
кор |
|
кор |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
прим |
|
(3.6)
Термодинамический расчет
С |
Ме |
z |
|
|
не всегда соответствует реальным
значениям предельных концентраций примесей, установленных практиче-
ским путем. В большинстве случаев расчетные значения
С |
Ме |
z |
|
||
|
|
существен-
но ниже практически установленных. То есть последние не вызывают заметного возрастания скорости выделения водорода.
Относительно высокое значение безвредной концентрации примесей
вэлектролите может быть обусловлено следующими причинами: экранированием примесных металлов за счет подщелачивания прикатодной зоны
врезультате чего ионы корродирующего металла, поступающие с анодных участков в прикатодные, могут образовывать труднорастворимые гидрооксиды, что уменьшает (экранирует) поверхность примесного металла; образованием электролитических сплавов корродирующего металла с примесным, облегчая выделение примесного металла за счет эффекта деполяризации, что увеличивает перенапряжение выделения водорода.
Зависимость между содержанием примеси в электролите и скоростью выделения водорода (саморастворения, коррозии металла) можно получить при использовании величины водородного перенапряжения на многофазных электродах. Примесь, содержащаяся в электролите, считается безвредной, если скорость выделения водорода в ее присутствии не превышает максимальных значений скорости при ее отсутствии.
Цель работы – определить локальную и общую скорость для процесса коррозии металла, протекающего с водородной деполяризацией, его
28
глубинный показатель (проницаемость) в зависимости от контакта с ним некоторых металлов или других факторов (по заданию руководителя).
Экспериментальная часть
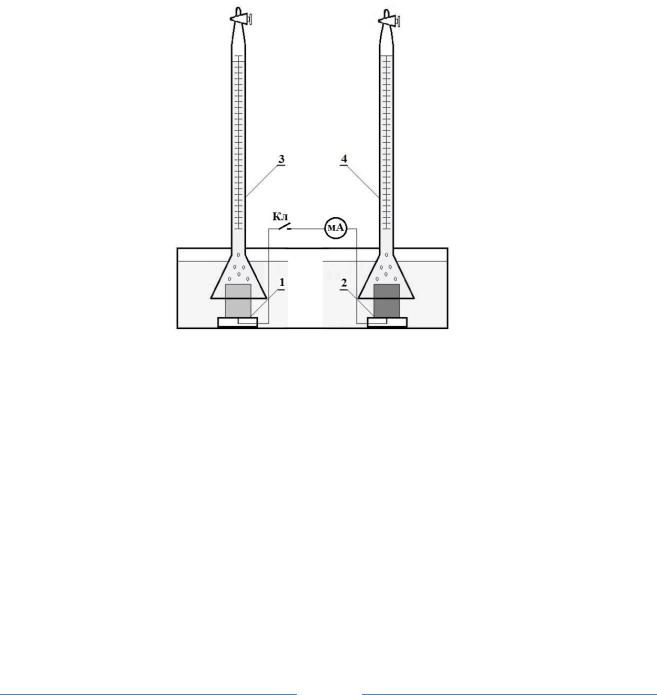
Прибор для определения скорости коррозии по количеству выделившегося водорода представляет собой эвдиометр(в простейшем случае две перевернутые бюретки), заполненные раствором, находящимся в сосуде, под которые в нижней части помещены образцы, под одну – испытуемый 1, под другую – контактирующим с ним 2 (рис.2.).
Часть 1. Образцы 1 и 2 плоские пластинки с изолированным токоподводом. До начала опыта замерить поверхность обоих образцов, обезжирить их, промыть, протравить в растворе HCl (1:1) и вновь тщательно промыть. Проверить бюретки на герметичность.
Рис. 1. Установка для определения скорости коррозии металла по объему выделившегося водорода:
1 – исследуемый металл; 2 – контактирующий металл; 3 и 4 – бюретки для сбора водорода при коррозии исследуемого металла и с контактирующего металла; мА – миллиамперметр, для определения силы тока между исследуемым и контактирующими металлами; Кл – электрический ключ замыкания металлов.
Поместить образцы под бюретки (образцы должны находиться в вертикальном положении), залить раствор в сосуд и заполнить бюретки, пользуясь резиновой грушей. Ключ (Кл) должен быть разомкнут. Записать уровень электролита в каждой бюретке и тотчас же включить секундомер для отсчета времени опыта. Длительность и периодичность ведения опыта
29
зависит от скорости заполнения бюретки водородом и задается препода- |
|||||||||||
вателем. Записать температуру воздуха и атмосферное давление в поме- |
|||||||||||
щении. |
|
|
|
|
|
|
|
|
|
|
|
Затем производить замеры уровня заполнения бюреток раствором |
|||||||||||
через равные промежутки |
времени опыта и записывать данные в табл. 1 |
||||||||||
(в бюретке над образцом 2 выделения водорода может не быть). |
|
|
|
||||||||
|
|
|
|
|
|
|
|
Таблица 1 |
|||
|
Экспериментальные данные по кинетике выделения водорода |
|
|
||||||||
|
|
при коррозии ………… образцов |
|
|
|
|
|
|
|||
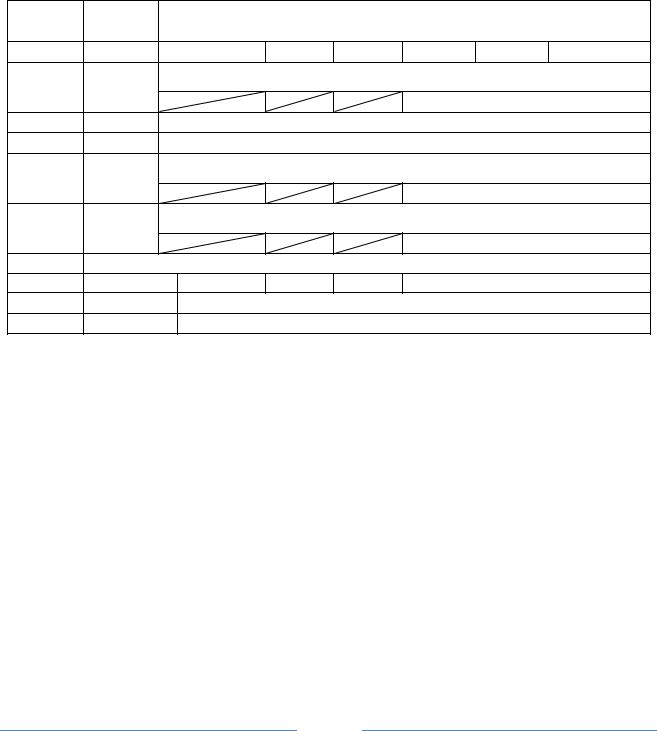
Раствор.........................; Давление, P =............мм.рт.ст.; Температура, t |
=........0С; |
||||||||||
Поверхность образцов: (И) исследуемого.........см2, (К) контактирующего..............см2 |
|||||||||||
Металл |
Наличие |
Время от начала опыта, (периоды времени измерений по зада- |
|||||||||
образцов |
контакта |
|
|
нию преподавателя), мин |
|
|
|
|
|
|
|
И / К |
|
5 |
10 |
15 |
20 |
25 |
|
|
и.т.д. |
|
|
|
|
Объем выделившегося водорода на исследуемом металле V |
Me |
,мл |
|||||||
|
|
|
|||||||||
И |
нет |
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
||
И |
нет |
|
Потенциалы исследуемого металла ……., В |
|
|
|
|||||
К |
нет |
|
Потенциал контактирующего металла …..., В |
|
|
|
|||||
|
|
Объем выделившегося водорода на исследуемом металле V |
Me |
,мл |
|||||||
|
|
|
|||||||||
И |
есть |
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Объем водорода на контактирующем металлеV |
конт |
, мл |
|
||||||
|
|
|
|
||||||||
К |
есть |
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Сила тока, мА |
|
|
|
|
|
|
|
|
есть |
|
|
|
|
|
|
|
|
|
|
И |
есть |
|
Потенциалы исследуемого металла ……., В |
|
|
|
|||||
К |
есть |
|
Потенциал контактирующего металла …..., В |
|
|
||||||
Примечание: Над чертой – экспериментально определенный объём водо- |
|||||||||||
Me |
|
|
|
|
|
|
V |
Me |
|
|
|
рода Vt |
; под чертой – приведенный к нормальным условиям |
0 . |
|
|
|
||||||
|
|
|
|
||||||||
Часть 2. Производится измерение компромиссного потенциала исследуемого образца и контактирующего металла без их электрического контакта милливольтметром относительно стандартного хлорсеребряного электрода сравнения, заполненного насыщенным раствором KCl (погружением гибкого капилляра в сосуд под воронкой бюретки).
Вторая часть работы заключается в том, что устанавливается гальванический и электролитический контакт между металлами, замыкается ключ (Кл) при полностью заполненных раствором бюретках. Вновь с заданной периодичностью снимаются уровни заполнения обеих бюреток раствором, замеряется сила тока коррозии (в миллиамперах) на постоянном диапазоне шкалы миллиамперметра. Производится измерение потен-
30
