
Коррозия лабы
.pdf
зованием раствора 1н НСlO4+ 1н NaCl). Оценку склонности к МКК проводят путем осмотра поверхности образца при увеличении в 500 раз. Признаком склонности к МКК является наличие сетки растравленных границ зерен.
Разработанный метод определения устойчивости сталей к МКК, заключающийся в потенциостатическом травлении с последующим металлографическим исследованием полированных образцов, более трудоемок, чем гальваностатический и потенциодинамические методы ускоренных испытаний.
ГОСТ 6032-2003 «Стали и сплавы коррозионно-стойкие. Методы испытаний на стойкость к межкристаллитной коррозии» (Метод Б)– «Анодное травление образцов в ингибированной серной кислоте».
Метод анодного травления, заключающийся в анодной поляризации исследуемого участка поверхности стали, обладает тем достоинством, что позволяет быстро определить склонность стали к межкристаллитной коррозии непосредственно на полуфабрикатах и готовых сварных изделиях.
Применение этого метода дает возможность производить межоперационную проверку склонности металла к межкристаллитной коррозии и соответствующей термической обработкой устранить эту склонность.
Ускоренные потенциодинамические методы определения устойчивости нержавеющих сталей к межкристаллитной коррозии.
Электрохимические исследования поведения сталей показывают, что потенциодинамические анодные кривые сталей, склонных и несклонных к МКК, различаются значениями потенциалов и токов в области перехода от активного состояния к пассивному. Значительно лучше эти различия проявляются на кривых обратного хода.
Стали типа XI8HI0T, склонные к МКК, активируются при обратном
ходе анодной кривой в области потенциалов от + 0,28 до – 0,1 |
B , в то |
время как не склонные – не активируются и анодный ток у них постоянно уменьшается, постепенно переходя в катодную область, вследствие электрохимического превращения анодных продуктов (рис.1).
Эти зависимости и были положены в основу потенциодинамического метода определения склонности стали к МКК, позволяющего уменьшить время испытаний до 3÷8 мин.
На основании этого метода критерием не склонности стали к МКК необходимо считать наличие петли анодного тока (гистерезис) при обратном ходе по сравнению с прямым ходом. Между глубиной МКК сталей и плотностью тока их активации jакт (рис.1) наблюдается симбатная зависимость. Большим величинам плотности тока обычно соответствует меньшая стойкость стали в этой среде к МКК.
61

Рис. 1. Обратный ход анодной поляризационной кривой для стали:
1 – склонная к МКК; 2 –не склонная к МКК;
ГОСТ 9.914-91 «Стали и сплавы коррозионно-стойкие методы испытания на стойкость против межкристаллитной коррозии»устанавливает ускоренный электрохимический метод потенциодинамическои реактивации (ПДР) определения стойкости против межкристаллитной коррозии коррозионностойких сталей марок 08X18H10T и 12Х18Н10Т.
Метод заключается в потенциодинамической поляризации образца или участка поверхности изделия в заданном диапазоне потенциалов последовательно в анодном (пассивация) и катодном (реактивация) направлениях и сопоставлении анодного количества электричества (заряда), израсходованного в процессе реактивации и пассивации (рис.2).
Рис. 2 Типичные анодные потенциодинамические кривые пассивации (I) и реактивации (II), получаемые при испытании сталей методом ПДР
62

Раствор №1 для испытания – концентрация раствора серной кислоты 0,5 моль∙дм-3 и концентрация раствора роданида калия 0,01 моль∙дм-3.
В держателе электрохимической ячейки закрепляют испытуемый образец. Подключают к потенциостату держатель с образцом, вспомогательный (платиновый) электрод и хлорсеребряный электрод сравнения (допускаются другие электроды сравнения), устанавливаемый в электрохимическую ячейку через электролитический ключ, заполненный испытываемым раствором.
Подают на образец потенциал равный минус 0,5 В и выдерживают в течение 1÷2 мин. Включают анодную развертку потенциала со скоростью 3,0∙10-3 В∙с-1. Поляризацию ведут до потенциала плюс 0,3 В, а затем поляризуют в обратном направлении до потенциала минус 0,5 В с той же скоростью. Анодные заряды пассивации и реактивации регистрируют с помощью кулонометрического интегратора или же определяют по площади под соответствующей потенциодинамической кривой, зарегистрированной самописцем.
О стойкости стали против межкристаллитной коррозии судят по величине отношения заряда реактивации (площади под кривой прямого хода) к заряду пассивации (площади под кривой обратного хода) или плотностей токов максимумов.
На стали, стойкой против межкристаллитной коррозии, указанное отношение должно быть меньше 0,11, а на стали нестойкой — больше или равно этой величине.
Допускается проводить испытания в растворе №2 – концентрация раствора серной кислоты 2 моль∙дм-3 и концентрация раствора роданида калия 0,001 моль∙дм-3.
Подают на образец потенциал равный минус 0,65 В и включают анодную развертку потенциала со скоростью 8,0∙10-3 В∙с-1. Поляризацию ведут до потенциала плюс 0,55 В. Уменьшают скорость изменения потенциала до 3,0∙10-3 В∙с-1и поляризуют образец в обратном направлении до потенциала минус 0,65 В. С этой же скоростью повторяют цикл прямой (пассивационной) и обратной (реактивационной) поляризации в том же интервале потенциалов (от минус 0,65 до плюс 0,55 В и обратно), регистрируют соответствующие анодные потенциодинамические кривые или же анодные заряды пассивации и реактивации.
При испытании отношение заряда реактивации к заряду пассивации на стали, стойкой против межкристаллитной коррозии, указанное отношение должно быть меньше 0,01, на стали со слабой склонностью к межкристаллитной коррозии — от 0,01 до 0,05, а на стали со значительной склонностью к межкристаллитной коррозии — свыше 0,05.
63
Цель работы– определение склонности хромистоникелевой стали к межкристаллитной коррозии и установление влияния термической обработки на межкристаллитное разрушение.
Экспериментальная часть
Часть 1. Электрохимический метод – «Анодное травление образ-
цов в ингибированной серной кислоте».
По заданию преподавателя получить образцы хромистоникелевой стали. Образцы должны быть шлифованными и отполированными, не иметь на поверхности язв, раковин и грубых изъянов. С помощью средств визуализации изображения (фото-видеокамеры) записывают в память компьютера кристаллическое строение поверхности образцов.
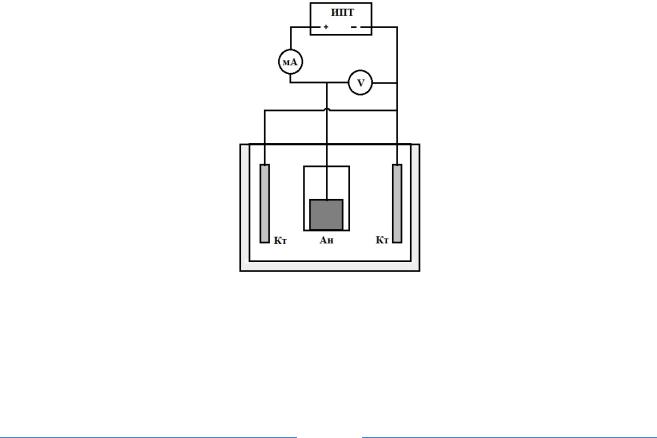
В стеклянный стакан наливают раствор H2SO4, 60% концентрации, содержащей 0,5% уротропина – ингибитора коррозии железа в кислотах, закрывают крышкой с закрепленными свинцовыми катодами. Температура комнатная. Собирают электрическую схему(рис.3).
На образце отмечают, можно карандашом, участок, который будет погружен в раствор кислоты и замеряют его размеры. Рассчитывают площадь поверхности и силу тока, которую необходимо подать на образец.
Плотность анодного тока при этом должна быть равна 0,3÷0,6 |
А/ cм |
2 |
. |
|
|||
|
|
Образец помещают в раствор кислоты и присоединяют его к положительному, а катоды к отрицательному полюсу источника постоянного тока, включают ток и ведут электролиз в течение 2÷5 минут, замеряя напряжение между анодом и катодом.
Рис. 3. Электрическая схема установки
Ан – анод (исследуемый электрод), Кт – свинцовые катоды, ИПТ – источник постоянного тока, V – вольтметр, мА – миллиамперметр
64

Затем образец вынимают, тщательно промывают водой, протирают и высушивают фильтровальной бумагой, затем помещают на столик микроскопа для визуального осмотра.
В случае наличия склонности стали к межкристаллитной коррозии при увеличении не менее х20 ÷ хЗ0 видна непрерывная сетка протравленных границ кристаллитов. С помощью средств визуализации изображения (фото-видеокамеры) записывают в память компьютера кристаллическое строение поверхности образца.
Рис. 4. Снимок поверхности хромистоникелевой стали после анодного травления, склонной к межкристаллитной коррозии
На рис.4. видны светлые кристаллиты практически не подверженные коррозии, окруженные по внешним границам темным слоем вытравленных менее стойких приграничных слоев. При наличии межкристаллитной коррозии образца следует провести термическую обработку в муфельной печи при температуре 1080÷11500С в течение 25÷30 минут, затем быстро охлаждают (окунанием в емкость с водой) и после полировки поверхности, вновь проводят анодное травление, как описано выше. После закаливания склонность к межкристаллитной коррозии должна уменьшиться или полностью исчезнуть, что должно отразиться на структуре образца.
Часть 2.Ускоренные потенциодинамические методы определения устойчивости нержавеющих сталей к межкристаллитной коррозии.
Экспериментальная часть
Образцы закаленных или отпущенных сталей в виде пластин или цилиндрических электродов с токоотводом зачистить наждачной бумагой
65
(№ 240, что соответствует 7 классу чистоты поверхности), промыть дистиллированной водой и высушить.
В качестве электролита для стали XI8HI0T используется 10%-ный раствор H2S04 с добавлением 0,0025 г/л KCNS для повышения чувствительности и воспроизводимости результатов метода.
Предварительная электрохимическая подготовка заключается в катодном активировании образцов в том же растворе при потенциале– 0,35 B (относительно хлорсеребряного электрода сравнения) в течении1 мин и анодном травлении при потенциале 0,0 B – 3 мин. После этого производится снятие анодной кривой обратного хода от +0,75 B со скоростью 4 мB / c до потенциала – 0,1 B .
Стали ЭИ–943 ввиду их повышенной коррозионной устойчивости в растворах серной кислоты при комнатной температуре не активируются ни в прямом, ни в обратном направлении потенциодинамической кривой. Активация подобных сталей, склонных к МКК, наблюдается в растворах NaCl. Для определения склонности к МКК сталей ЭИ–943 электрохимическая подготовка в растворе 0,5 н NaCl заключается в катодной активации при –1,0 B в течении 1 минуты. После чего производится снятие потенциодинамической кривой обратного хода со скоростью 8 мB / c от потенциала +1,05 B до потенциала +0,2 B . И в этом случае склонность к МКК оценивается по появлению анодной петли в этом интервале потенциалов. Отсутствие петли и постоянное уменьшение анодного тока означает стойкость сталей ЭИ–943 к МКК.
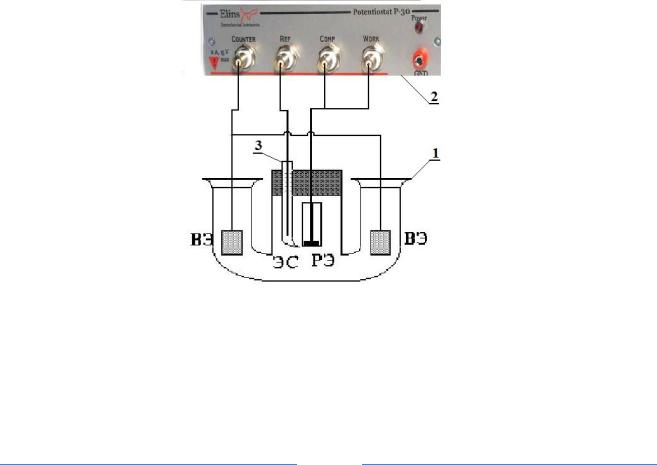
Рис. 5. Схема установки для снятия поляризационных кривых
1 – стеклянная ячейка, 2 – потенциостат «Элинс Р 30», 3 – стеклянный капилляр (гебер), РЭ – рабочий электрод, ВЭ – вспомогательные свинцовые электроды, ЭС – электрод сравнения
66
Электрохимическая подготовка и снятие потенциодинамических анодных кривых прямого и обратного хода проводятся на потенциостате «Элинс Р–30S» (порядок включения потенциостата и работы при определенных режимах указаны в ПРИЛОЖЕНИИ 2).
После механической подготовки поверхности исследуемый образец помещается в электрохимическую ячейку и подключается к 2 клеммам потенциостата: “Work” (Рабочий электрод) и. потенциальному электроду
– “Ref”. В качестве вспомогательных электродов используются две свинцовые пластины с существенно большей поверхностью, чем рабочий электрод, и подсоединяются они к соответствующей клемме потенциостата – “Counter” (Вспомогательный электрод) (рис. 5).
Для измерения и задания необходимых величин потенциалов на рабочий электрод через промежуточные сосуды подключается хлорсеребряный электрод сравнения с насыщенным раствором КCl (его потенциал по стандартному водородному электроду равен +0,202 B), который подсоединяется к соответствующей клемме потенциостата – “Comp” (Электрод сравнения рабочего электрода). Собирают схему (рис.5) и после проверки правильности сборки проводят электрохимическую подготовку и сами исследования согласно вышеуказанным методикам.
По полученным результатам рассчитывается плотность тока и строится поляризационная кривая в координатах j Ea . По характеру хода об-
ратных анодных кривых и величине тока
jакт
определяется склонность
(относительная) к МКК различных аустенитных нержавеющих сталей, а также влияние вида и глубины их термообработки.
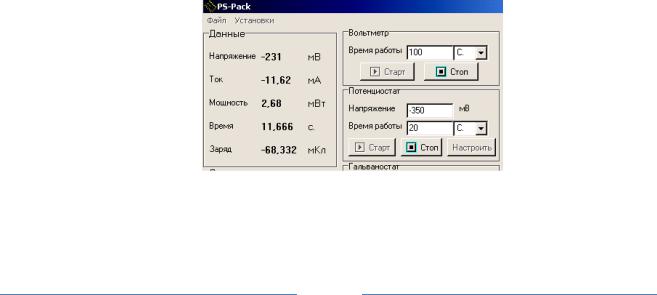
Анодные заряды пассивации и реактивации регистрируются с помощью кулонометрического интегратора, программно встроенного в потенциостате «Элинс Р–30S» (рис.6) – в окне «Данные» постоянно регистрируется количество протекшего электричества в мили Кулонах (мКл), отражено как «Заряд». Необходимо записать величину заряда на прямом ходе поляризационной кривой то -0,5 В до +0,5 В, а затем на обратном
(+0,5 ÷ - 0,5 В).
Рис. 6 Диалоговоеокно программы PS–Pack управления потенциостатом «ЭЛИНС P-30S»
67

Полученные окончательные результаты качественно сравнить с результатами, полученными при выполнении Части 1(образцы после снятия поляризационных кривых подвергнуть визуальному осмотру под микроскопом).
Отчет по работе должен содержать введение, методику эксперимента, экспериментальные результаты (снимки поверхности образцов до и после испытаний), обсуждение результатов, рекомендации по способу защиты металла от коррозии, выводы и список использованной литературы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.В чем заключается эффект воздействия МКК на сталь?
2.Какие теории существуют для объяснения появления у легированных хромом сталей склонности к МКК?
3.Какая из теорий является общепринятой и в чем она заключается?
4.Почему межкристаллитная коррозия хромоникелевых сталей наблюдается после некоторой выдержки её в температурной зоне 400÷800 0С?
5.В чем выражается взаимосвязь между склонностью к МКК нержавеющей стали и содержанием в ней хрома?
6.От чего зависит температурный режим, при котором наблюдается максимальная склонность нержавеющей стали к межкристаллитной коррозии?
7.Каковы методы предотвращения склонности стали к межкристаллитной коррозии?
8.Почему при понижении содержания углерода в стали склонность к МКК уменьшается?
9.В чем заключается предупреждение МКК путем закалки изделий?
10.Продолжительный отпуск стали при t=750÷900° С как метод предупреждения МКК.
11.Требования к легирующим компонентам сталей и механизм их действия, с целью защиты от МКК?
12.Борьба с МКК путем воздействия на агрессивную среду.
13.Какие существуют методы испытания на склонность к межкристаллитной коррозии и в чем они заключаются?
68
ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ЗАЩИТА СТАЛИ ОТ КОРРОЗИИ
Лабораторная работа № 7
Повышенная коррозионная стойкость металлов в выбранном растворе может быть достигнута переводом его в пассивное состояние путем анодной поляризации от источника постоянного тока до определенных величин потенциала.
Под пассивным состоянием понимают состояние повышенной коррозионной стойкости металла или сплава, которое вызвано торможением анодного процесса растворения металла в условиях, когда с термодинамической точки зрения они являются вполне реакционноспособными.
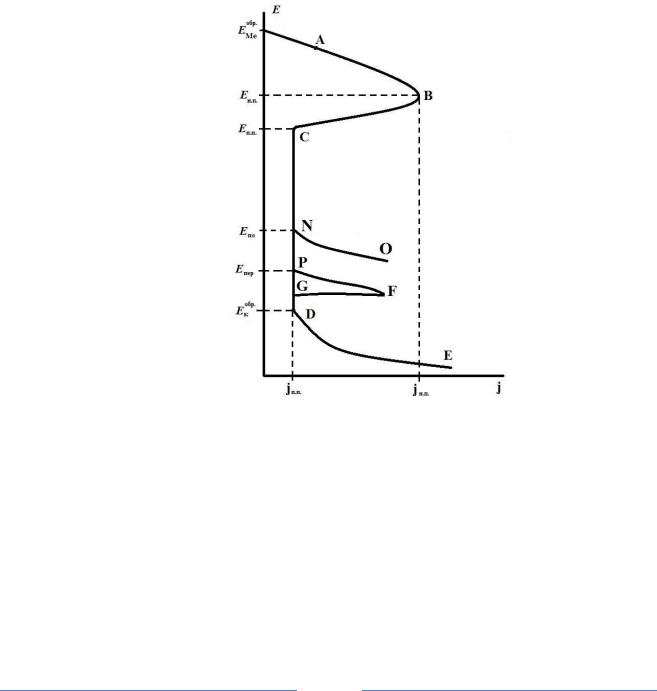
Рис. 1. Идеальная анодная поляризационная кривая металла:
EМобре – обратимый потенциал металла в растворе электролита; Eнп и
jнп
– потенциал
и плотность тока начала пассивации; Eпп и
jпп
– потенциал и плотность тока полной
пассивации;
E обр О 2
– обратимый потенциал реакции выделения кислорода; Eпер – по-
тенциал перепассивации; Eпо – потенциал пробоя оксидной пленки; АВ – область ак-
тивного растворения металла; ВС – область неустойчивой пассивации; СP– область полной пассивации металла или сплава; DЕ – область выделения кислорода; PFG – область перепассивации; NO – область питтингобразования
69

Наступление пассивного состояния для металлов характеризуется резким уменьшением скорости коррозии, со значительным смещением потенциала в положительную сторону, например, для стали в растворах сер-
ной кислоты от |
Eан = –0,2÷–0,5 |
B до +0,5÷+1,0 |
B . В общем виде анодные |
поляризационные кривые для металлов, склонных к пассивации, имеют форму, представленную на рис. 1.
Кривая [ |
E |
обр |
А] соответствует зависимости потенциала электрода от |
||
Ме |
|||||
|
|||||
плотности тока при растворении металла в активном состоянии |
|||||
|
|
|
Me+ nH2O→ Men+∙nH2O + n e |
(1) |
|
При смещении потенциала в область положительных значений от точки (А) становится возможен процесс адсорбции кислорода и возникновения защитной оксидной адсорбционной пленки МеОадс или фазовой оксидной пленки МеО.
Me+ H2O→ МеО+ 2H+ + 2 e (2)
Скорость образования пленки очень мала, как вследствие некоторого перенапряжения данного электрохимического процесса, так и из-за химического растворения в электролите, поэтому толщина пленки невелика.
В точке B при потенциале начала видимой пассивации Енп ускорение анодного процесса (1) растворения металла в результате смещении потенциала в более положительную сторону становится равным замедлению этого процесса при образовании защитного слоя - адсорбционного или фазового оксида по реакции (2), и достигается предельная плотность тока пассивации (jнп).
После прохождения точки B,скорость анодного процесса роста защитной пленки уже превышает скорость ее химического растворения и начинается процесс формирования пленки, что ведет к аномальному уменьшению анодного тока до jпп при смещении потенциала в положительную сторону в область Епп.
При очень положительных (Епер) потенциалах часто еще до начала выделения кислорода возможно увеличение скорости анодного растворения металла или сплава, вследствие перепассивации (отрезок PF), наступает возможность образования окислов высшей валентности или соединений металла (компонентов сплава) хорошо растворимых в электролите
(3),
а также явление вторичной пассивности (отрезок FG) в связи с образованием на поверхности новых трудно растворимых соединений, вызывающих падение анодного тока.
При наличии в растворе ионов – депассиваторов (например,F-, Cl-, Br-, J-) область потенциалов полной пассивации может уменьшиться за
70
