
Коррозия лабы
.pdf
при
E |
0 |
|
|
|
|
|
|
||
O |
/ OH |
|||
|
||||
|
2 |
|
|
|
E |
обр |
|
E |
0 |
|
|
|
|
|
|
|
|
|
|
|||
|
O |
/ OH |
|
|
O |
/ OH |
|
|
|
|
|
|
|
||||
|
2 |
|
|
|
2 |
|
|
|
=+0,401 B, PO2 =1атм.,
RT |
|
a |
2 |
|
·P |
|
|
|
H O |
|
|||||
ln |
|
|
O |
, |
|||
|
|
2 |
|
|
2 |
||
nF |
|
|
a |
4 |
|
|
|
|
|
OH |
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|
||
T =298 K, aH2O = 1
(3.11)
E |
обр |
|
0,401 |
RT |
2,303lga |
|
0,401 0,059lga |
|
. |
|
|
|
|
|
|||||||
|
|
|
F |
|
|
|||||
|
2 |
/ OH |
|
OH |
OH |
|
||||
O |
|
|
|
|
|
|
||||
(3.12)
Потенциал кислородного электрода положительнее водородного электрода на 1,23 B:
Eобр O2
1,23 0,059pH
1,23
Eобр H2
.
(3.13)
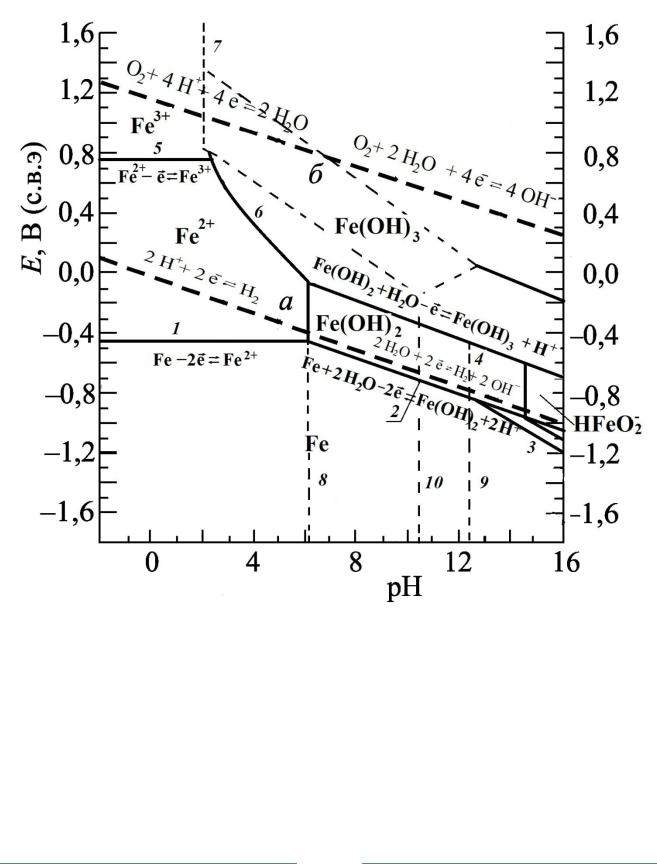
Диаграмма равновесия для железа приведена на рис. 2.
|
1. Ионно-молекулярные равновесия, не связанные с величиной по- |
||||||||||
|
|
|
тенциала. Они зависят только от величины |
pH |
: |
||||||
|
|
|
|
||||||||
|
Fe |
2 |
2H2O Fe(OH)2 |
2H |
|
(рис 2, линия 8); |
|
|
|||
|
|
|
|
||||||||
|
Fe |
3 |
3H2O Fe(OH)3 |
3H |
|
(рис.2, 7); |
|
|
|||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe(OH)2 HFeO2 H |
|
(рис 2, 9); |
|
|
||||||
|
Fe |
2 |
- |
3H |
|
|
|
|
|
|
|
|
|
2H2O HFeO2 |
|
(рис.2, 10). |
|
|
|||||
На диаграмме Пурбэ им отвечают линии, параллельные оси потенциалов.
2.Равновесный обмен электрическими зарядами:
в кислой среде при PH< 6,5 (рис. 2 линия 1) соответствует реакции
(2.1) Fe 2e Fe E 0,44B2 0,
Зависимость обратимого потенциала железа от концентрации соответствующих ионов описывается уравнением Нернста
обр |
0 |
RT |
|
a |
Fe2 |
|
|
EFe2 /Fe EFe2 /Fe |
|
ln |
|
. |
(2.2) |
||
|
|
|
|||||
|
|
nF |
|
aFe |
|
||
Потенциалжелеза не зависят от pH , а определяется только активно- |
|||||||
стью его ионов в электролите. На рис.2 линия 1, характеризующая этот процесс, параллельна оси pH .
|
в кислой среде при PH< 3,0 (рис. 2 линия 5) соответствует реакции |
|||
|
|
Fe3 , E0 |
0,44B. |
(2.3) |
|
Fe2 e |
|||
121
Зависимость обратимого потенциала железа от концентрации соответствующих ионов описывается уравнением
обр |
0 |
RT |
|
a |
3 |
|
|
|
EFe2 /Fe3 EFe2 /Fe3 |
|
ln |
|
Fe |
. |
(2.4) |
||
nF |
aFe2 |
|||||||
|
|
|
|
|
||||
Рис. 2. Диаграмма Е – рН для системы железо – вода при 25 0 С (гидратированная форма оксидов)
3.Равновесия, которые зависят как от потенциала, так и от pH :
в нейтральных и слабощелочных средах анодная реакция протекает
по другому механизму |
|
|
|
|
|
|
2H , E0 |
0,047B. |
|
Fe 2H2O 2e |
Fe(OH)2 |
(2.5) |
122

В общем виде уравнение обратимого потенциала этой реакции
приaFe=1,
|
|
|
|
|
|
|
|
|
RT |
|
a |
|
|
|
a |
2 |
|
|
|
|
обр |
|
|
|
0 |
|
|
|
|
|
H |
|
|
||||||
E |
|
E |
|
|
ln |
|
Fe(OH) 2 |
|
|
, |
|||||||||
Fe(OH)2/Fe |
Fe(OH)2/Fe |
nF |
|
a |
|
a |
2 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
Fe |
H |
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
aFe(OH) |
2 |
=1 и aH |
O |
= 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2.6)
E обр
Fe(OH)
2 |
/Fe |
|
= – 0,047 – 0,059
pH
.
(2.7)
В этой области потенциал железа металла, а только от кислотности среды
не
pH
зависит от активности ионов (рис.2, линия 2 параллельная
линиям а и б).
при более положительных потенциалах, чем для реакции (2.5) в нейтральных и слабощелочных средах становится возможным окисление
Fe(OH)2до Fe(OH)3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, E |
0 |
|
|
||
Fe(OH) H |
O e Fe(OH) |
H |
0,271B |
(2.8) |
|||||
|
|
||||||||
2 |
2 |
3 |
|
|
|
|
|
|
|
|
|
обр |
|
|
|
|
0 |
|
|
|
|
RT |
|
a |
|
|
a |
H |
|
|
||
E |
|
|
|
E |
|
|
|
|
|
ln |
|
|
Fe(OH) 3 |
|
|
, |
||||||
Fe(OH) |
/Fe(OH) |
|
|
Fe(OH) |
/Fe(OH) |
|
nF |
a |
|
|
|
a |
|
|
|
|||||||
|
|
3 |
|
2 |
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Fe(OH) |
2 |
|
H O |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
при aFe(OH) |
|
=1, aFe(OH) |
2 |
=1 и aH |
O |
= 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
3 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(2.9)
обр |
|
= – 0,271 – 0,059 pH , |
EFe(OH) |
/Fe(OH) |
|
3 |
|
2 |
на рис.2, линия 4 параллельная линиям а и б.
(2.10)
4.Равновесия, которые зависят от активности ионов металла и кислотности среды – pH:
в щелочных средах при pH> 13,5 (рис.2, линия 3) равновесный потенциал железа будет зависеть от активности его ионов и от активности
- |
pH |
|
|
ионов OH , то есть |
раствора электролита. |
||
|
|
|
|
|
HFeO2 3H |
|
|
|
|
|
Fe 2H2O 2e |
|
|
(2.11) |
||
Eобр |
|
|
0,493 0,0886pH 0,0295lg(a |
|
- ). |
||
- |
/Fe |
HFeO |
|
||||
HFeO |
|
|
2 |
|
|||
|
2 |
|
|
|
|
|
|
в слабокислой среде при PH≈ 2÷6,5 протекает реакция окисления ионов железа (II) cобразованием Fe(OH)3
|
|
Fe(OH)3 3H , EFe(OH)0 |
3 /Fe2 1,057B |
|
Fe2 3H2O e |
||||
Eобр |
|
1,057 0,1773pH 0,059lg a |
(2.12) |
|
2 |
2 |
|||
Fe(OH) 3 /Fe |
|
|
Fe |
|
123

(рис.2, линия 6) равновесный потенциал железа будет зависеть от активности его ионов и pH раствора электролита.
|
|
|
|
|
|
|
|
Таблица 1 |
|
|
Средние коэффициенты активности ( |
|
) кислот при различных |
||||||
|
|
||||||||
|
|
|
температурах. |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
t,0C |
Значение коэффициента активности при m моль/1000 г. воды |
|
|||||||
|
0.1 |
0.2 |
0.5 |
1.0 |
|
2.0 |
3.0 |
4.0 |
|
|
|
|
Соляная кислота |
|
|
|
|
|
|
0 |
0.803 |
0.776 |
0.776 |
0.842 |
|
1.078 |
1.452 |
2.006 |
|
15 |
0.800 |
0.772 |
0.766 |
0.823 |
|
1.039 |
1.373 |
1.862 |
|
35 |
0.792 |
0.760 |
0.748 |
0.794 |
|
0.976 |
-- |
--- |
|
45 |
0.787 |
0.754 |
0.738 |
0.779 |
|
0.948 |
-- |
--- |
|
60 |
0.781 |
0.744 |
0.724 |
0.754 |
|
0.907 |
-- |
--- |
|
|
|
|
Серная кислота |
|
|
|
|
|
|
0 |
0.294 |
0.235 |
0.177 |
0.151 |
|
0.150 |
0.175 |
0.213 |
|
15 |
0.266 |
0.210 |
0.157 |
0.133 |
|
0.131 |
0.149 |
0.178 |
|
35 |
0.221 |
0.171 |
0.129 |
0.109 |
|
0.105 |
0.116 |
0.135 |
|
45 |
0.199 |
0.155 |
0.116 |
0.097 |
|
0.093 |
0.102 |
0.117 |
|
60 |
0.177 |
0.138 |
0.102 |
0.086 |
|
0.081 |
0.087 |
0.099 |
|
Средние коэффициенты активности (
Таблица 2
) щелочей
|
|
Значение коэффициента активности |
|
при m моль/1000 г. вод |
|
|||||||||
t, °С |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 |
|
0,2 |
0,5 |
1,0 |
2,0 |
3,0 |
|
|
4,0 |
6,0 |
8,0 |
|
10,0 |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гидроксид натрия |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
0,768 |
|
0,716 |
0,690 |
0,672 |
0,689 |
0,762 |
|
0,882 |
1,40 |
2,31 |
|
4,00 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
0,766 |
|
0,714 |
0,693 |
0,678 |
0,696 |
0,774 |
|
0,889 |
1,35 |
2,17 |
|
3,61 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
0,707 |
0,783 |
|
0,895 |
1,27 |
1,93 |
|
3,00 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
0,677 |
0,742 |
|
0,839 |
1,14 |
1,63 |
|
2,34 |
|
|
|
|
|
|
Гидроксид калия |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
10 |
0,794 |
|
0,759 |
0,736 |
0,757 |
0,890 |
1 |
|
|
1,41 |
2,42 |
4,24 |
|
7,37 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
0,792 |
|
0,756 |
0,733 |
0,755 |
0,884 |
1 |
|
|
1,39 |
2,33 |
3,98 |
|
6,73 |
40 |
0,783 |
|
0,747 |
0,722 |
0,740 |
0,858 |
1 |
|
|
1,30 |
2,09 |
3,40 |
|
5,50 |
60 |
0,772 |
|
0,733 |
0,704 |
0,713 |
0,811 |
1 |
|
|
1,177 |
1,81 |
2,82 |
|
4,37 |
80 |
0,759 |
|
0,718 |
0,683 |
0,680 |
0,755 |
1 |
|
|
1,043 |
1,53 |
1,82 |
|
3,42 |
Соотношение между активностью электролита а,его моляльностью m, средним коэффициентом активности зависит от типа валентности электролита и может быть выражено:
124

для HCl иHNO3 –
a
m2
(
|
) |
2 |
|
|
|
|
|
; для Н2SO4–
a 4m |
3 |
( |
|
) |
3 |
|
|
|
|
||
|
|
|
|
|
|
Таблица 3
Активность воды в растворах электролитов
ан2о |
Концентрация электролита, % (масс.), при температуре, °С |
|
||||||
tзам |
0 |
25 |
50 |
75 |
100 |
|
tкип |
|
|
|
|||||||
|
|
|
Серная кислота |
|
|
|
|
|
0,98 |
4;о |
4 |
4,0 |
4,2 |
4,5 I |
4,8 |
|
— |
0,95 |
9,6 |
9,6 |
9,6 |
9,6 |
10 |
10,2 |
|
— |
0,90 |
14,4 |
15 |
16,6 |
16,6 |
17 |
17,6 |
|
— |
0,85 |
17,8 |
20 |
21,8 |
22,0 |
22,5 |
23,3 |
|
— |
0,80 |
21,4 |
23,5 |
25,6 |
26,0 |
27 |
28,2 |
|
— |
0,75 |
24,6 |
26,5 |
28,3 |
29,5 |
31 |
32,0 |
|
— |
0,70 |
28,2 |
30 |
31,6 |
32,5 |
34 |
35,6 |
|
— |
0,65 |
— |
— |
34,2 |
35,3 |
37 |
38,6 |
|
— |
0,60 |
— |
— |
37,0 |
38,2 |
40 |
41,4 |
|
— |
0,55 |
— |
— |
39,6 |
41,0 |
42,5 |
44,0 |
|
44,2 |
0,50 |
— |
— |
42,4 |
43,8 |
45 |
46,5 |
|
47,2 |
0,45 |
— |
— |
44,8 |
46,4 |
47,5 |
49,0 |
|
49,7 |
0,40 |
— |
— |
47,2 |
48,5 |
50 |
51,7 |
|
52,4 |
0,35 |
— |
— |
49,7 |
51,2 |
52,5 |
54,2 |
|
55,4 |
0,30 |
— |
— |
52,5 |
53,8 |
55 |
56,5 |
|
58,1 |
0,25 |
— |
— |
55,2 |
56,5 |
58 |
59,0 |
|
60,7 |
0,20 |
— |
— |
58,0 |
59,3 |
60,5 |
61,6 |
|
— |
0,15 |
— |
— |
60,8 |
62,2 |
63,5 |
64,8 |
|
— |
0,10 |
— |
— |
64,2 |
66,2 |
67 |
68,5 |
|
— |
0,05 |
— |
— |
70,0 |
71,2 |
72,5 |
73,7 |
|
— |
|
|
|
Соляная кислота |
|
|
|
|
|
0,98 |
2,0 |
1,7 |
1,9 |
2,1 |
2,2 |
2,4 |
|
— |
0,95 |
4,4 |
4,6 |
4,0 |
4,4 |
4,8 |
5,2 |
|
— |
0,90 |
7,4 |
7,0 |
7,5 |
8,1 |
8,6 |
9,2 |
|
— |
0,85 |
9,7 |
9,6 |
10,2 |
10,8 |
11,4 |
12,0 |
|
— |
0,80 |
11,6 |
11,8 |
12,5 |
13,2 |
13,9 |
14,7 |
|
— |
0,75 |
13,6 |
13,6 |
14,4 |
15,2 |
16,0 |
16,9 |
|
— |
0,70 |
15,4 |
15,6 |
16,4 |
17,2 |
18,0 |
18,9 |
|
— |
0,65 |
17,5 |
17,3 |
18,1 |
19,0 |
19,8 |
20,7 |
|
— |
0,60 |
20 |
19,0 |
19,9 |
20,7 |
21,6 |
22,5 |
|
— |
0,55 |
— |
20,7 |
21,6 |
22,5 |
23,4 |
24,4 |
|
— |
0,50 |
— |
22,2 |
23,3 |
24,3 |
25,4 |
26,4 |
|
— |
0,45 |
— |
23,8 |
25,0 |
26,1 |
27,3 |
28,4 |
|
— |
0,40 |
— |
25,4 |
26,6 |
27,9 |
29,1 |
30,3 |
|
— |
0,35 |
— |
27,2 |
28,5 |
29,8 |
31,1 |
32,4 |
|
— |
0,30 |
— |
29,0 |
30,5 |
32,0 |
33,5 |
35,0 |
|
— |
0,25 |
— |
31,0 |
32,6 |
34,2 |
35,8 |
37,4 |
|
— |
0,20 |
— |
33,2 |
35,0 |
36,8 |
38,6 |
40,4 |
|
— |
125

Продолжение таблици 3
ан2о |
Концентрация электролита, % (масс.), при температуре, °С |
|||||||
tзам |
0 |
25 |
50 |
75 |
100 |
tкип |
||
|
||||||||
|
|
|
Гидроксид натрия |
|
|
|
||
0,98 |
2,51 |
2,5 |
2,5 |
2,5 |
2,5 |
2,5 |
— |
|
0,95 |
5,7 |
5,7 |
5,8 |
5,8 |
5,8 |
5,9 |
5,9 |
|
0,90 |
10,1 |
10,1 |
10,2 |
10,2 |
10,2 |
10,2 |
10,2 |
|
0,85 |
13,4 |
13,4 |
13,5 |
13,6 |
13,7 |
13,8 |
13,8 |
|
0,80 |
16,1 |
16,1 |
16,3 |
16,6 |
16,8 |
17,0 |
17,1 |
|
0,75 |
19,0 |
19,1 |
19,2 |
19,3 |
19,6 |
20,0 |
20,4 |
|
0,70 |
— |
20,5 |
21,0 |
21,6 |
22,2 |
22,9 |
23,5 |
|
0,65 |
— |
22 |
23,0 |
24,0 |
25,0 |
26,0 |
26,4 |
|
0,60 |
— |
24 |
25,0 |
26,0 |
27,2 |
28,3 |
29,0 |
|
0,55 |
— |
25,5 |
26,7 |
28,0 |
29,2 |
30,5 |
31,6 |
|
0,50 |
— |
27 |
28,5 |
30,0 |
31,5 |
33,0 |
34,3 |
|
0,45 |
— |
28,5 |
30,1 |
31,8 |
33,5 |
35,2 |
36,9 |
|
0,40 |
— |
30 |
31,7 |
33,7 |
35,7 |
37,7 |
39,7 |
|
|
|
|
Гидроксид калия |
|
|
|
||
0,98 |
3,1 |
3,0 |
3,0 |
3,0 |
3,0 |
3,0 |
3,0 |
|
0,95 |
7,1 |
7,1 |
7,1 |
7,1 |
7 |
7,0 |
6,8 |
|
0,90 |
12,2 |
12,2 |
12,1 |
12 |
12 |
12,0 |
12,0 |
|
0,85 |
15,5 |
16 |
16,2 |
16,1 |
16,1 |
16,1 |
16,1 |
|
0,80 |
18,8 |
19 |
19,6 |
19,6 |
19,6 |
19,6 |
19,7 |
|
0,75 |
21,7 |
22 |
22,4 |
22,4 |
22,4 |
22,5 |
23,0 |
|
0,70 |
24,7 |
25 |
25,1 |
25,2 |
25,3 |
25,5 |
26,1 |
|
0,65 |
27,6 |
27,5 |
27,5 |
27,6 |
27,8 |
28,0 |
29,2 |
|
0,60 |
— |
— |
29,7 |
30,0 |
30,2 |
30,5 |
31,9 |
|
0,55 |
— |
— |
31,8 |
32,1 |
32,4 |
32,8 |
34,5 |
|
0,50 |
— |
— |
33,8 |
34,2 |
34,7 |
35,2 |
37,0 |
|
0,45 |
— |
— |
35,9 |
36,5 |
37,1 |
37,8 |
39,6 |
|
0,40 |
— |
— |
37,9 |
38,7 |
39,5 |
40,4 |
42,1 |
|
0,35 |
— |
— |
40,0 |
41,0 |
42,0 |
43,1 |
44,8 |
|
0,30 |
— |
— |
42,1 |
43,3 |
44,5 |
45,8 1 |
47,0 |
|
|
|
|
Хлорид натрия |
|
|
|
||
0,98 |
3,4 |
3,4 |
3,4 |
3,4 |
3,4 |
3,4 |
3,4 |
|
0,95 |
7,9 |
7,9 |
7,9 |
7,9 |
7,9 |
7,9 |
7,9 |
|
0,90 |
14,2 |
14,2 |
14,2 |
14,3 |
14,4 |
14,4 |
14,4 |
|
0,85 |
19,1 |
19,1 |
19,1 |
19,2 |
19,4 |
19,6 |
19,6 |
|
0,80 |
23,1 |
23,1 |
23,1 |
23,3 |
23,6 |
23,9 |
23,9 |
|
0,75 |
— |
26,2 |
26,6 |
26,8 |
27,1 |
27,4 |
27,5 |
|
|
|
|
Сульфат натрия |
|
|
|
||
0,98 |
— |
5,8 |
6,6 |
6,9 |
7,5 |
8,1 |
— |
|
0,96 |
— |
11,0 |
12,0 |
13,0 |
14,0 |
15,0 |
— |
|
0,95 |
— |
13,0 |
14,3 |
15,6 |
17,0 |
18,5 |
— |
|
0,94 |
— |
15,2 |
16,8 |
18,4 |
19,9 |
21,4 |
— |
|
126

Продолжение таблици 3
0,92 |
— |
19,7 |
21,4 |
23,1 |
24,8 |
26,5 |
— |
|
ан2о |
Концентрация электролита, % (масс.), при температуре, °С |
|||||||
tзам |
0 |
25 |
50 |
75 |
100 |
tкип |
||
|
||||||||
|
|
|
Хлорид калия |
|
|
|
||
0,98 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
4,5 |
|
0,95 |
10,7 |
10,7 |
10,7 |
10,7 |
10,7 |
10,8 |
10,8 |
|
0,90 |
19,1 |
19,1 |
19,1 |
19,1 |
19,1 |
19,1 |
18,9 |
|
0,85 |
— |
25,4 |
25,4 |
25,4 |
25,4 |
25,4 |
25,4 |
|
0,80 |
— |
30,9 |
30,9 |
30,9 |
30,9 |
30,9 |
30,9 |
|
0,75 |
— |
35,8 |
35,8 |
35,9 |
35,9 |
35,9 |
35,9 |
|
В табл.4÷6 приводятся химические составы некоторых протекторных сплавов соответственно на магниевой, алюминиевой и цинковой основе.
|
|
|
|
|
|
|
Таблица 4 |
||
|
|
|
|
|
|
|
|
|
|
Марка |
Легирующие элементы, % |
|
Примеси предельные, % |
|
|||||
магниевого |
|
|
|
|
|
|
|
|
|
Al |
Zn |
Mn |
Fe |
Cu |
Ni |
Si |
Ti |
||
сплава |
|||||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Мл16 |
7,5...9 |
2...3 |
0,15...0,5 |
0,03 |
0,15 |
0,01 |
0,2 |
- |
|
|
|
|
|
|
|
|
|
|
|
Mл4вч |
5...7 |
2...3 |
0,15...0,5 |
0,003 |
0,004 |
0,001 |
0,05 |
- |
|
|
|
|
|
|
|
|
|
|
|
МП1 |
5...7 |
2 ..4 |
0,02...0,5 |
0,003 |
0,004 |
0,001 |
0,04 |
0,04 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 5 |
||
|
|
|
|
|
|
|
|
|
Марка |
|
|
|
|
|
Примеси |
|
|
алюминиевого |
Легирующие элементы, % |
предельные, % |
||||||
сплава |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
Mg |
Sn |
Zr |
Fe |
Cu |
|
Si |
|
|
|
|
|
|
|
|
|
АП2 |
0,4...0,8 |
- |
- |
- |
0,1 |
0,01 |
|
0,1 |
|
|
|
|
|
|
|
|
|
АП3 |
4...6 |
- |
- |
0,001...0,1 |
0,1 |
0,01 |
|
0,1 |
|
|
|
|
|
|
|
|
|
АП4 |
4...6 |
0,5...1,0 |
0,05...0,1 |
- |
0,1 |
0,01 |
|
0,1 |
|
|
|
|
|
|
|
|
|
127

|
|
|
|
|
|
|
Таблица 6 |
|
|
|
|
|
|
|
|
|
|
Марка |
|
|
|
|
|
Примеси |
|
|
цинкового |
|
|
|
|
|
|
||
|
Легирующие элементы, % |
|
предельные, |
|
||||
сплава |
|
|
|
|||||
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Al |
Mg |
Mn |
Ti |
Si |
Fe |
Cu |
Pb |
|
|
|
|
|
|
|
|
|
ЦП1 |
0,4...0,8 |
- |
- |
- |
- |
0,001 |
0,001 |
0,005 |
|
|
|
|
|
|
|
|
|
ЦП2 |
0,5...0,7 |
0,1...0,3 |
0,1...0,3 |
- |
- |
0,004 |
0,001 |
0,005 |
|
|
|
|
|
|
|
|
|
ЦП3 |
0,2...0,6 |
- |
- |
0,005....0,1 |
0,005....0,1 |
0,004 |
0,001 |
0,005 |
|
|
|
|
|
|
|
|
|
Таблица 7
Бактериологический и химический анализ водопроводной воды.
Показатель |
Значение |
|
Показатель |
значение |
Свободный остаточный |
0,26 |
|
Свободный остаточный |
<0,30 |
хлор, мг/дм3 |
|
|
хлор, мг/дм3 |
|
Суммарный остаточный |
2,08 |
|
Хлориды, мг/дм3 |
3,07÷1,4 |
хлор, мг/дм3 |
|
|
|
|
Хлориды, мг/дм3 |
31,07 |
|
Запах 20°С, баллы |
2 |
Запах 20°С, баллы |
1 |
|
Запах 60°С, баллы |
3(H2S) |
Привкус, баллы |
1 |
|
Цветность, градус |
28±3 |
Цветность, градус |
10 |
|
Мутность, мг/дм3 |
5,42±0,54 |
Мутность, мг/дм3 |
0,79 |
|
РН |
7,70±0,44 |
РН |
6,71 |
|
Общая жесткость, мг/дм3 |
5,30±0,07 |
Общая жесткость, мг/дм3 |
5,58 |
|
Окисляемость, КМnО4 |
0,98+0,49 |
|
|
|
мг /дм3 |
|
Окисляемость, КМnО4 |
1,54 |
|
Железо, мг/дм3 |
0,64±0,12 |
мг /дм3 |
|
|
|
|
Железо, мг/дм3 |
0,46 |
|
Соли аммония, мг/дм3 |
0,11±0,01 |
Алюминий, мг/дм3 |
0,102 |
|
Сульфаты, мг/дм |
10,6 |
Нитриты, мг/дм3 |
0,005 |
|
Сульфиды, мг/дм |
0,2 |
Нитраты, мг/дм3 |
2,20 |
|
Анализ проведен ИЦ ЛХП ФГУП |
|
Соли аммония, мг/дм3 |
0,15 |
|
ЦНИЛХИ". |
|
128
ПРИЛОЖЕНИЕ 2
ПОТЕНЦИОСТАТ «ЭЛИНС P–30S»
Перед началом работы необходимо соединить прибор кабелем с ПК, заземлить и подключить к сети переменного тока. Для включения прибора необходимо нажать красную кнопку на задней панели.
Для обеспечения максимальной помехозащищенности при проведении измерений исследуемый объект, например, электрохимическая ячейка, должен быть помещен в металлический экран. При этом рекомендуется соединить экран и заземляющий разъем потенциостата с внешним заземлением.
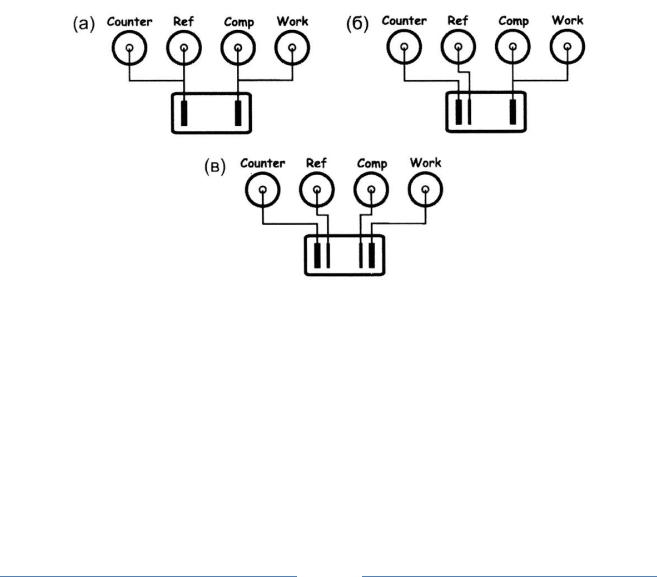
В данных приборах реализуются три основных способа подключения к исследуемому объекту (электрохимической ячейке): двух–, трех – и четырех электродная схемы (рис. 1).Во всех случаях токовыми электродами являются “Counter” (Вспомогательный электрод) и “Work” (Рабочий электрод), а соответствующими потенциальными – “Ref” и “Comp” – (Электрод сравнения рабочего электрода).
Рис. 1. Подключение электрохимической ячейки по двух– (а), трех – (б) и четырех электродной (в) схемам
Во всех случаях прибор стабилизирует величину сигнала электрода “Comp” относительно электрода “Ref” (касательно системы знаков напряжений; положительному напряжению (потенциалу) при этом соответствует положительный ток).
129
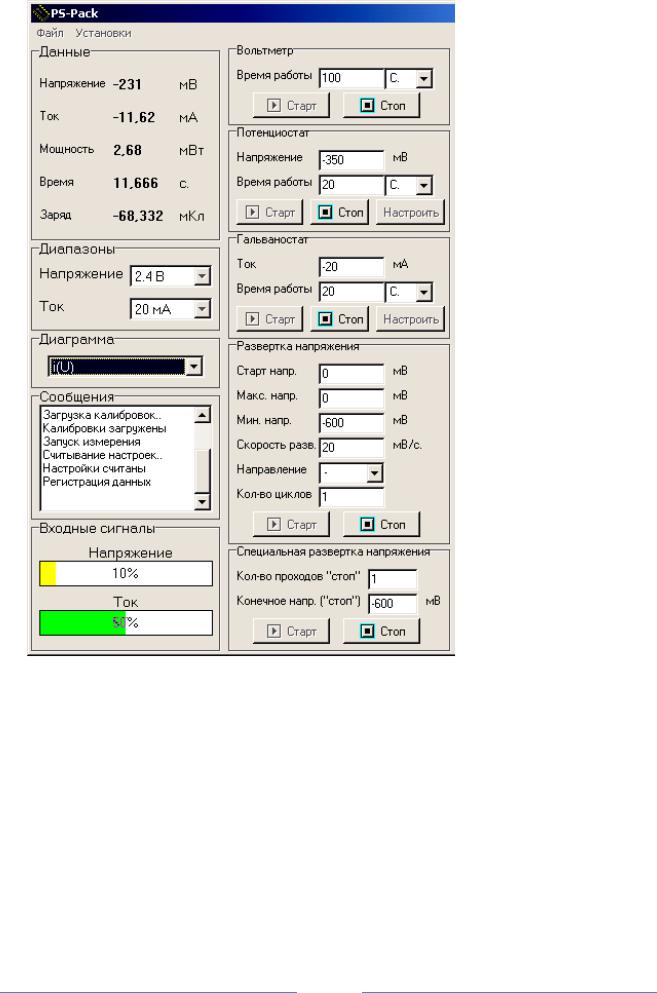
Блок «Вольтметр» измерение и регистрация потенциала электрода
Блок «Потенциостат» потенциостатическая поляризация системы
Блок «Гальваностат» наложение на систему постоянного тока
Блок «Развертка напряжения» задаются области поляризации системы, скорость развертки потенциала и направление поляризации
Блок управления разверткой напряжения и окончанием выполнения программы
Рис. 2. Диалоговое окно программы PS Pack управления потенциостатом «ЭЛИНС P-30S»
Запуск рабочей программы осуществляется двойным нажатием левой кнопки мыши на расположенную на рабочем столе иконку программы, (либо запуском файла PS Pack.exe) на рабочем столе появляется окно (рис. 2), в левом верхнем углу которого расположены два основных меню: «Файл» и «Установки».
Рабочее окно программы PS Pack (рис. 2) можно условно поделить на две части. На правой части представлены основные пять режимов работы прибора: «вольтметр», «потенциостат», «гальваностат», «развертка
130
