
Коррозия лабы
.pdf
счет пробоя пассивной пленки. Это явление имеет место при достижении потенциала пробоя пленки (Епо), при котором ионы – активаторы вытесняют ионы кислорода из поверхности пассивной пленки. Защитный оксид может заменяться незащитным растворимым соединением металла – отре-
зок (NO).
MeO + 2Cl-→MeCl2 + ½ O2→Me++ Cl- + ½O2 (4)
Протекание этой реакции на отдельных участках приводит к процессу местной коррозии в виде питтингов.
Значения потенциалов, при которых данный металл (сплав) находится в пассивном состоянии, определяют экспериментально, для чего сни-
мают реальную анодную поляризационную кривую с помощью потен-
циостата при небольших скоростях развертки потенциала, т. е. в условиях близких к стационарным.
Ранее в коррозионных диаграммах мы имели дело с идеальными поляризационными кривыми, в которых начальный потенциал анодной кривой может быть отождествлен с обратимым потенциалом анодного процесса на металле ЕобрМе, а начальный потенциал катодной кривой с обратимым потенциалом процесса катодной деполяризации Еобркт. Такие кривые получаются на идеальных электродах, у которых на аноде протекает только один процесс – ионизации металла, на катоде только один катодный деполяризующий процесс, а при отсутствии тока они приобретали свои обратимые (равновесные) потенциалы.
Для реальных электродов, вследствие их термодинамической неустойчивости в агрессивной среде, происходит явление саморастворения, то есть генерирования собственного тока коррозии и поляризационные кривые для реальных металлов будут отличаться от идеальных кривых.
Рассмотрим, какие поляризационные кривые будут получаться на реальных электродах, то есть при условии работы на них своих внутренних гальванопар. Допустим, что в растворе находится реальный электрод, на котором самопроизвольно протекает коррозионный процесс, то есть его нужно рассматривать как систему короткозамкнутых элементов. В этом случае начальный потенциал такого электрода будет Ест, который имеет какое-то промежуточное значение между Еобрк и ЕобрМе, – единый компромиссный потенциал системы, когда локализуется внутренний ток саморастворения Iаид =Iкид = Iкор.
При анодной поляризации системы потенциал электрода будет смещаться в положительном направлении, до значения Е1 положительнее Ест, при этом в системе появится внешний анодный ток, величина которого будет соответствовать разности идеального анодного и катодного токов (при Ест –равновесии Iкид = Iаид и внешний ток равен нулю). При по-
тенциале Е1Iкид = [Е1 К1],Iаид = [Е1А1]. Тогда Iавнеш = Iаид - Iкид = [А1К1] – ток
71
внешней анодной поляризации (рис 2).
Изменение величины внешнего анодного тока в зависимости от общего потенциала электрода и будет реальной анодной поляризационной кривой для работающего коррозионного элемента (линия ЕстR1 BC), что можно зафиксировать приборами.
При потенциале равному Екобр – обратимому потенциалу для катодного
процесса (точка B) Iкид= 0 Iанвнеш = Iаид - Iкид = Iаид.
При более положительных потенциалах, чем Екобр идеальная анодная поляризационная кривая будет совпадать с реальной анодной поляризационной и кривой (отрезок BC).
Анализируя работу систем, склонных к пассивации, можно выделить три наиболее характерных случаев коррозии пассивирующихся систем, исходя из различной кинетики анодных процессов.
1. Активное состояние пассивирующейся системы
Если эффективность катодного процесса относительно невелика (например, для выделения водорода, когда металл имеет потенциал отрицательнее обратимого водородного, или кислородно-водородная деполяризация), то анодная и катодная поляризационные кривые пересекаются в активной области растворения металла (точка S рис.2).
Рис. 2 Идеальные анодная (А), катодная (К) и реальная анодная (R) поляризационные кривые коррозионной системы склонной к пассивации
Реальная анодная поляризационная кривая (R) (кривая с учетом тока саморастворения, за вычетом Iкид) для этого случая будет начинаться из точки Ест – компромиссного потенциала коррозии данной системы (рис 2)
72

и будет отличаться от идеальной поляризационной кривой (А).
Такая система при Ест находится в самопроизвольном устойчивом активном состоянии, когда наблюдается постоянное высокое значение тока коррозии.
Если ее каким-либо внешним воздействием (например, при наложении внешней анодной поляризации) перевести в пассивное состояние (положительнее Епп), то пока анодный ток не отключен система находится в пассивном состоянии, но после отключения внешнего тока во времени начнется химическое растворение защитной оксидной пленки в агрессивном электролите и система самопроизвольно вернется в активное состояние Ест, скорость коррозии возрастет от jпп до jкор.
2.Пассивно-активное состояние системы
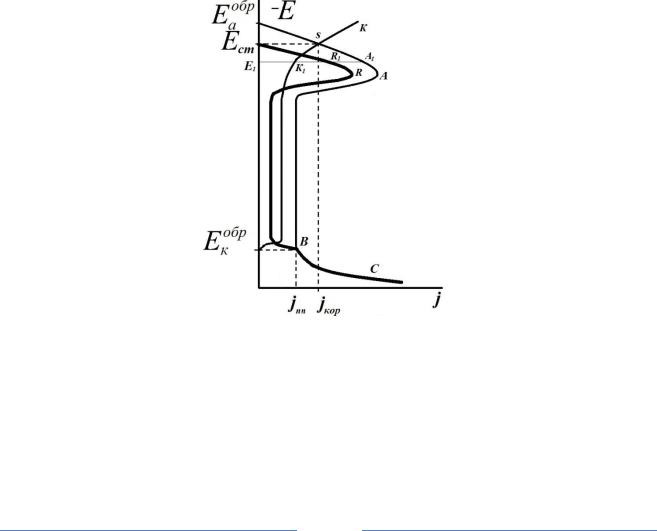
Если катодная поляризационная кривая имеет большую поляризуемость и высокие плотности тока (например, процесс коррозии пассивирующегося металла протекает с водородно-кислородной деполяризацией), тогда анодная и катодная кривые пересекаются в 3-х точках (B), (C),(F). Точка (B) находится в активной зоне при потенциале Е1ст, точка (С) находится в зоне неустойчивого пассивного состояния при потенциале Е2ст, точка (F) в области пассивного состояния при потенциале Е3ст (рис 3).
Рис. 3 Идеальные анодная (А), катодная (К) и реальная анодная (R) поляризационные кривые коррозионного процесса
Условия нахождения системы в активно-пассивном состоянии можно сформулировать так же исходя из значений токов. Плотность идеаль-
73

ного катодного тока jk1 при потенциале пассивации Енп должна быть меньше плотности тока пассивации jнп, однако плотность катодного тока jk2 при потенциале полной пассивации Епп превосходит плотность тока полной пассивации jпп.
Таким образом, пассивно-активное состояние системы характеризуется тем, что система может находиться в двух стационарных состояниях: а) в устойчиво-активном состоянии при потенциале Е1ст и растворяться с большим током коррозииjкор; б) в устойчиво-пассивном состоянии при потенциале коррозии Е3ст и корродировать в пассивном состоянии с ничтожно малым токомjпп. Однако эти два состояния не могут самопроизвольно восстанавливаться после их нарушения.
Критическим потенциалом, определяющим то или иное состояние данной системы, будет точка пересечения кривых в неустойчивом пассивном состоянии Е2ст. Отрицательнее Е2ст система будет самопроизвольно активироваться, положительнее этого потенциала – самопроизвольно пассивироваться.
Снятая реальная анодная поляризационная кривая будет выходить из точки с самым отрицательным компромиссным потенциалом Е1ст. При анодной поляризации внешний анодный ток сначала будет увеличиваться до Енп, затем уменьшится до нуля в точке Е2ст. Величина и направление тока реальной анодной кривой определяется разностью идеального катодного и анодного тока IАнвнеш = IКтид - IАнид.
При дальнейшей анодной поляризации положительнее Е2ст в системе появится внешний катодный ток, который будет в системе до третьего компромиссного потенциала Е3ст. При более положительных потенциалах внешний ток вновь станет анодным.
Появление этой катодной петли на реальной анодной кривой и есть следствие процесса самопроизвольной пассивации поверхности – на участке формирования пассивной пленки при наличии достаточно эффективного катодного процесса в системе. На этом участке система самопроизвольно стремится запассивироваться и перейти к потенциалу Е3ст, то есть к потенциалу коррозии в области пассивного состояния.
При отключении анодного тока система останется в пассивном состоянии в точке Е3ст, скорость растворения пленки будет равна скорости ее роста при протекании анодного тока с минимальной плотностью тока полной пассивации jпп. Пассивное состояние будет сохраняться длительное время, пока не возникнут какие либо внешние воздействия.
Подобный эффект наблюдается при легировании стали хромом 18% и никелем 14 % или другими добавками, повышающими устойчивость пассивного состояния (5% Si, 5% V, 5% Mo или 2,5 % Re).
Если система находится в пассивном состоянии Е3ст и мы дадим ей
74
толчок внешнего катодного тока, то система перейдет в активное состояние Е1ст, процесс коррозии будет протекать с большой скоростью.
Если пассивную пленку нарушить образивом, обнажить поверхность металла, то система перейдет в активное состояние.
Если на такую систему, находящуюся в активном состоянии Е1ст, подать внешний анодный ток, больший чем jп– ток пассивации, то система перейдет в устойчивое пассивное состояние и приобретет Е3ст.
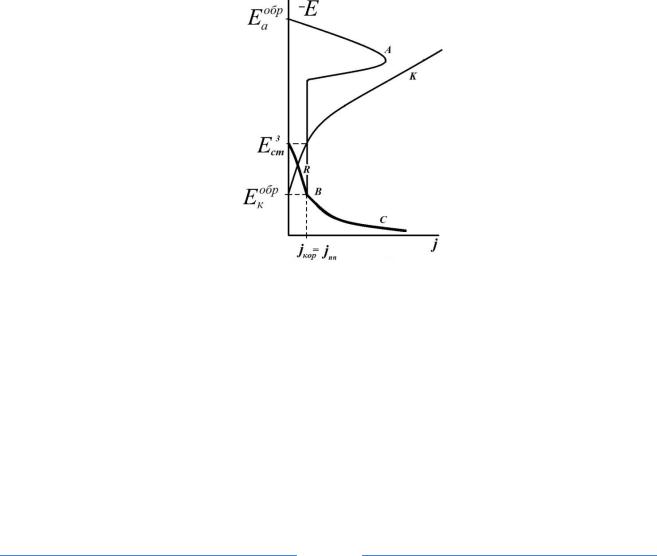
3. Самопроизвольное устойчивое пассивное состояние
При большой эффективности катодного процесса вероятен случай, когда катодная кривая не доходит до анодной петли активного растворения и пересекается с анодной кривой только на участке полного пассивного состояния при потенциале Е3ст, но при потенциалах более отрицательных, чем потенциал пробоя пассивной пленки. Для данной системы устойчиво только одно – пассивное состояние (рис. 4).
Если каким-либо образом искусственно система будет выведена из пассивного состояния, то после снятия внешнего воздействия система самопроизвольно возвратится в пассивное состояние. Это самопроизвольно пассивирующиеся системы.
Рис. 4 Идеальные анодная (А), катодная (К) и реальная анодная (R) поляризационные кривые коррозионного процесса
Таким образом, анодная электрохимическая защита осуществляется переводом потенциала металла или сплава от стационарного значения
E1 ст
в область потенциалов полной пассивации. В этом случае ток корро-
зии численно равен току полной пассивации, который, как правило, имеет ничтожно малую величину и зависит от скорости растворения пассивной пленки металла в данном растворе и ионной проводимости защитной
75

пленки.
Цель работы – Часть 1. Провести анализ работы коррозионных пассивирующихся систем (определение параметров анодной защиты – потенциалов области полной пассивации сталей в растворах серной кислоты, токов перевода системы в пассивное состояние и токов поддержания пассивности), путем снятия реальной анодной поляризационной кривой (марка стали и концентрация кислоты задается преподавателем); Часть 2. Определение скорости коррозии на неполяризованном образце
стали и анодно поляризованном до потенциала области полной пассивации (численное значение потенциала задается преподавателем).
Экспериментальная часть
Анодные поляризационные кривые и выдержка образца при постоянном потенциале осуществляется с помощью потенциостата «Элинс Р- 30S».
Установка состоит из электролитической ячейки и потенциостата (рис. 5), позволяющего на экране монитора видеть ход поляризационных кривых и автоматически фиксировать зависимости величины тока и потенциала в памяти компьютера. Порядок включения потенциостата и работы при определенных режимах указаны в ПРИЛОЖЕНИИ 2.
Поверхность исследуемого образца и обезжиривают венской известью (MgO), тщательно промывают дистиллированной водой и устанавливают в электролитическую ячейку.
Рис. 5. Схема установки для снятия поляризационных кривых
1 – стеклянная ячейка, 2 – потенциостат «Элинс Р 30», 3 – стеклянный капилляр (гебер), РЭ – рабочий электрод, ВЭ – вспомогательные свинцовые электроды, ЭС – электрод сравнения
76

В качестве электрода сравнения удобно использовать образец из стали (Ст3) не склонной к самопассивации в кислоте. Электрод сравнения зачищают наждачной бумагой. Собирают электрическую схему рис.5
После проверки схемы преподавателем измеряют и записывают изменение стационарного потенциала исследуемого образца относительно стального электрода сравнения в течение 10 минут (режим работы потенциостата – «Вольтметр»). Затем активируют образец путем его катодной поляризации (режим работы – «Гальваностат») при токе -20 мА в течение 5 минут, после чего снова измеряют стационарный потенциал.
Затем образец начинают анодно поляризовать от потенциала, измеренного после активации (режим работы – «Развертка напряжения»), со скоростью 2÷4 mB/ c , записывая изменение силы тока от потенциала. Измерения прекращают, когда ток начинает значительно возрастать при потенциалах положительнее потенциала выделения кислорода, при этом на исследуемом образце начинают видимо выделяться пузырьки газа (надо учитывать, что после пассивной области возрастание тока может быть связано и с перепассивацией – на анодной кривой появится подъем плотности тока (пик) в области потенциалов еще до выделения кислорода рис.1).
На реальной анодной кривой определяют область потенциалов полной пассивации, токи начала пассивации и полной пассивации.
Образец вновь активируют путем его катодной поляризации (режим работы – «Гальваностат») при токе -20 мА в течение 5 минут, после чего снова измеряют стационарный потенциал (если оксидные пленки полностью восстановлены, то он будет находиться в области активного растворения).
Далее образец анодно поляризуют при выбранном постоянном потенциале (по заданию преподавателя) в течение 10 минут (режим работы – «Потенциостат»). Затем вновь измеряют и записывают изменение стационарного потенциала образца в течение 10 минут (режим работы – «Вольтметр»), определяя, нарушается ли пассивность после отключения внешнего тока анодной защиты.
Рабочий электрод отключают от потенциостата, определяют (смоченную электролитом) поверхность рабочего электрода.
Для определения потенциала электрод сравнения (сталь3) отнорсительно водородной шкалы, его подключают к потенциостату вместо рабочего (к клеммам “Work” и “Comp” ), а стандартный хлорсеребряный электрод подключить к клемме – “Ref” и поместить в электролит. В режиме работы – «Вольтметр» измерить и записать значение стационарного потенциала электрода сравнения относительно хлорсеребряного электрода.
77

Зная потенциал хлорсеребряного электрода, значения измеренных потенциалов пересчитывают по отношению к нормальному водородному электроду, учитывая, что стальной электрод сравнения в кислоте так же находится под током саморастворения (коррозии) и значение его стационарного (компромиссного) потенциала значительно отличается от обратимого железа, который для оценки можно принять – 0,44 В.
По полученным результатам рассчитывается плотность тока и стро-
ится поляризационная кривая в координатах |
E |
ан – jан – реальная анодная |
|
|
поляризационная кривая, которая берет свое начало из стационарного (под собственным током коррозии), а не из обратимого потенциала стали
(рис.2).
На оси потенциалов реальной анодной поляризационной кривой необходимо нанести точки обратимых потенциалов (рассчитанных по уравнению Нернсста или из диаграмм Пурбе) для всех возможных анодных электрохимических реакций: ионизации железа и легирующих компонентов стали; образования из фазовых оксидов; процессов перепассивации и выделения кислорода.
В отчете следует провести анализ данных зависимостей для определения возможности использования анодной электрохимической защиты и ее параметров (согласно цели работы).
Часть 2. По снятой анодной поляризационной кривой преподаватель задает величину потенциала для анодной электрохимической защиты.
Для выполнения второй части работы два предварительно подготовленных одинаковых образца (одной марки стали и площади поверхности) взвешивают на аналитических весах с точностью до четвертого знака.
Первый образец помещается в электрохимическую ячейку (рис.5) и при заданном потенциале, анодно поляризуется в течение, 2÷3 часов, после тщательно промывается водой, высушивается и вновь взвешивается.
Параллельно этому опыту второй образец выдерживается в течение этого же времени в таком же количестве электролита, что и в электролитической ячейке, в отдельном стаканчике. Затем после промывки и сушки образец взвешивается для определения весовых потерь за время опыта.
По убыли веса образцов определяется отрицательный весовой пока-
затель коррозии |
|
|
|
|
|
Квес , г/м2∙час по уравнению (7.1): |
|
||||
|
Квес |
|
g |
104 , |
(7.1) |
|
S |
||||
|
|
|
|
|
|
где g – убыль веса образца, г;
S– рабочая (смоченная электролитом) поверхность образца, см2;
– время проведения коррозионных испытаний, час.
Отрицательный весовой показатель определяют для обоих образцов.
78

Эффективность анодной электрохимической защиты вычисляют по формуле:
|
К |
|
К |
|
|
Э% |
вес |
вес П |
|||
|
|
||||
|
|
|
|||
|
|
|
|
|
|
|
|
|
К |
|
|
|
|
|
вес |
|
100%
,
(7.2)
где
К вес
, К
вес
П – весовые показатели коррозии неполяризованного и анод-
но поляризованного образца. Результаты записывают в таблицу 1.
Таблица 1
Параметры анодной электрохимической защиты
Материал электрода ………… Электролит …………
Поверхность, см2:№1 (неполяризованный)…….;№2 (анодно поляризованный)…….. Длительность испытания…… час, Температура электролита ………… °С. Потенциал анодной поляризации ………….. В.
|
|
|
|
|
|
jа , |
|
Образцы |
Вес образца, г |
g |
, г |
Квес ., |
Э% |
||
|
2 |
А/м2 |
|||||
|
|
|
|
|
|||
|
|
|
|
|
г/м ∙час |
|
|
|
до |
после |
|
|
|
|
|
№ 1 (непляризованный) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ 2 (поляризованный) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Записываются возможные уравнения электрохимических превращений, протекающих на различных участках (потенциалах) анодной поляризационной кривой.
По величине реальных плотностей тока анодной поляризационной кривой необходимо определить плотность тока для перевода данного металла в устойчивое пассивное состояние и плотность тока для поддержания устойчивого пассивного состояния.
Отчет по работе должен состоять из введения, методики эксперимента, экспериментальных результатов, обсуждения результатов и списка используемой литературы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.Что такое пассивное состояние металла или сплава, чем оно отличается от термодинамической устойчивости?
2.Каков механизм пассивации металлов и сплавов?
3.Что такое перепассивация и когда она возникает?
4.Каков механизм растворения металлов в области полной пассива-
ции?
5.Изменяют ли величину потенциала и тока пассивации, полной пассивации, продукты, образовавшиеся на аноде за счет протекания вторич-
79

ных процессов коррозии?
6.В случае коррозии с водородной деполяризацией, какими приемами можно перевести двухэлектродную систему из активного состояния в пассивное?
7.Что такое фладе - потенциал? Совпадает ли он по величине с потенциалом начала пассивации?
8.В случае коррозии с кислородной деполяризацией, какими методами можно перевести двухэлектродную систему из активного в пассивное состояние?
9.Почему в области полной пассивации скорость растворения анода не зависит от потенциала анода?
10.Какой из параметров (ток, потенциал пассивации, полной пассивации) является решающим для перевода двухэлектродной системы в устойчивое пассивное состояние?
11.Способы перевода системы в устойчивое пассивное состояние через воздействие на характер анодных процессов?
12.Способы перевода системы в устойчивое пассивное состояние через воздействие на характер катодных процессов?
13.Как по реальной анодной поляризационной кривой определить плотность тока для перевода данного металла в устойчивое пассивное состояние и плотность тока для поддержания устойчивого пассивного состояния?
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ С ПОМОЩЬЮ ИНГИБИТОРОВ
Лабораторная работа № 8
Ингибиторами (замедлителями) коррозии называются вещества (неорганические и органические), введение небольших количеств которых в коррозионную среду заметно уменьшает скорость коррозии, вследствие торможения анодного процесса (анодные замедлители), катодного процесса (катодные замедлители) или вследствие воздействия на оба процесса (замедлители смешанного действия) и увеличения омического сопротивления системы при образовании на металлической поверхности пленки, обладающей пониженной электропроводностью.
Коррозия металлов в кислотах, протекающая с водородной деполяризацией (основной катодный процесс – восстановление ионов водорода),
80
