
Коррозия лабы
.pdf
При разомкнутом ключе (Кл) и выключенной мешалке измерить
|
исх |
помощью потенциометра (милливольтметра мВ) потенциалы анода |
Eа |
с
и
катода Eкисх , записать в табл. 1. Затем при замкнутом ключе (Кл), после
3÷5 минутной выдержки, когда установится постоянная сила тока, записать величину проходящего тока, «рабочие» потенциалы анода и катода
под током –
E раб а
и
E раб к
.
Включить мешалку (при замкнутом ключе) поочередно в катодном и анодном пространствах и каждый раз, после установления постоянной величины силы тока, замерить и записать потенциалы электродов и величину протекающего тока.
Таблица 1
Экспериментальные данные по исследованию коррозионного элемента
Металл анода ……; металл катода ………. Электролит…………;
Sан = ………см2; Sкт =………см2; Межэлектродное расстояние……см.
Температура, |
Наличие пере- |
Сила тока, |
Потенциал по цинковому элек- |
||
0 С |
мешивания |
I |
троду сравнения |
E , B |
|
|
|
мА |
|
|
|
|
|
анода |
|
катода |
|
|
|
|
|
||
|
|
|
|
|
|
Использование в качестве электродов сравнения амальгамированных цинковых электродов упрощает электрическую схему, однако требует перевода обратимых потенциалов для анодных и катодных процессов на электродах со шкалы по цинковому электроду сравнения на шкалу нормального водородного электрода. Рассчитанные по уравнению Нернста величины равновесных (обратимых) потенциалов для металла – анода
Eобр a
Eнвэ
Me
и реакций для катодных деполяризаторов
Eобр к
E нвэ O 2
(или EHнвэ ), от-
носительно нормального водородного электрода, пересчитываются отно-
сительно цинкового электрода сравнения |
Zn |
EМe по формуле (4.11): |
где EМZne и
|
|
EМZne EМнвэe |
EZnобр , EZn |
Eнвэ EZnобр , |
(4.11) |
|
|
|
|
H |
H |
|
|
E |
Zn |
|
|
|
||
H |
– потенциал металла и потенциал водородного электрода, |
|||||
|
||||||
|
|
|
|
|
||
относительно цинкового электрода сравнения;
EZnобр – обратимый потенциал цинкового электрода сравнения рассчитыва-
ется по уравнению Нернста или определяется из диаграммы Пурбэ для цинка (см. ПРИЛОЖЕНИЕ 1)
41

По полученным экспериментальным и расчетным данным строится коррозионная диаграмма Эванса и проводится анализ работы коррозионного элемента. Определяются вид и природа анодных и деполяризующих катодных процессов, влияние на них перемешивания электролита и при-
рода контролирующей стадии коррозионного процесса. |
|
|
|||||||||
Степени контроля |
Ci коррозионного |
процесса по |
данной ступени |
||||||||
рассчитать по формулам (2.1) – (2.3) (лабораторная работа № 2). |
|||||||||||
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
Коррозионные характеристики коррозионного элемента |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Плотность |
Степень контроля, % |
Скорость |
П , |
||||||
Темпе- |
Наличие |
мм/год |
|||||||||
|
|
|
коррозии |
||||||||
анодного |
|
|
|
||||||||
ратура, |
переме- |
|
|
|
Группа и балл |
||||||
|
|
|
|
|
|
||||||
тока, |
|
|
|
|
К |
|
|||||
0С |
шивания |
|
Cан |
Cкт |
CR |
вес , |
|
стойкости ме- |
|||
мА/см2 |
|
|
|||||||||
|
|
|
|
|
2 |
|
|
||||
|
|
|
|
|
|
|
г/м ∙час |
талла |
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Отчет по работе должен содержать введение, методику эксперимента, экспериментальные результаты, обсуждение результатов (влияние пе-
ремешивания электролита на |
|
Квес |
комендации по способу защиты использованной литературы.
, С%, вид деполяризации и их доли), реметалла от коррозии, выводы и список
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.Почему при замыкании ключа в цепи двух электродов ток коррозии сначала имеет большое значение, затем во времени уменьшается и достигает постоянного значения?
2.Почему при сотрясении ячейки ток в цепи двухэлектродной системы возрастает?
3.Почему ток коррозии в двухэлектродной системе не достигает бесконечно больших величин даже при R электролита равном нулю?
4.Напишите электродные процессы, протекающие на электродах в данном электролите (по условиям работы)?
5.В каких случаях перемешивание электролита в катодном пространстве в большей степени сказывается на возрастании величины тока коррозии по сравнению с перемешиванием в анодном пространстве?
6.Нарисуйте диаграмму коррозии, на которой были бы качественно отображены изменения потенциалов электродов и силы тока, полученные в вашей работе.
42

7.Что такое токовый показатель коррозии и его физический смысл?
8.Почему при замыкании ключа в цепи двухэлектродной системы потенциал анода смещается в положительном, а катода в отрицательном направлении?
9.Напишите выражение максимального тока коррозии двухэлектродной системы. От каких характеристик электродных процессов он зависит?
10.Почему с увеличением температуры электролита ток коррозии двухэлектродной системы возрастает?
11.Как рассчитать глубинный показатель коррозии по величине токового показателя?
12.Почему катодные реакции ионизации кислорода и выделения водорода при коррозионном процессе называются деполяризующими?
13.Почему в перемешиваемом электролите макроэлемента наблюдается меньшая поляризация катода при более высоком токе?
14.Можно ли по величине изменения потенциалов электродов при замыкании их накоротко определить вид контроля коррозионного процесса?
15.Как скажется на интенсивности работы макроэлемента деаэрация раствора?
16.Назначение раздельного перемешивания электролита в катодном и анодном пространствах?
ИЗУЧЕНИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КАТОДНОЙ ЗАЩИТЫ МЕТАЛЛОВ НА МОДЕЛИ ДВУХЭЛЕКТРОДНОГО ГАЛЬВАНИЧЕСКОГОЭЛЕМЕНТА
Лабораторная работа № 5
Одним из распространенных способов защиты от коррозии металлических конструкции, находящихся в почве или морской воде, является электрохимическая катодная защита. При этом способе защищаемая конструкция катодно поляризуется с тем, чтобы её потенциал достиг величины равновесного потенциала металла конструкции. Это прекращает анодное разрушение металла. Катодная поляризация осуществляется или посредством электрического подсоединения к защищаемой конструкции анода из более отрицательного металла, который окислятся (растворяется) в ходе эксплуатации (протекторная защита), или же от внешнего источни-
43
ка постоянного тока с помощью инертного вспомогательного электрода, подсоединяемого в качестве анода.
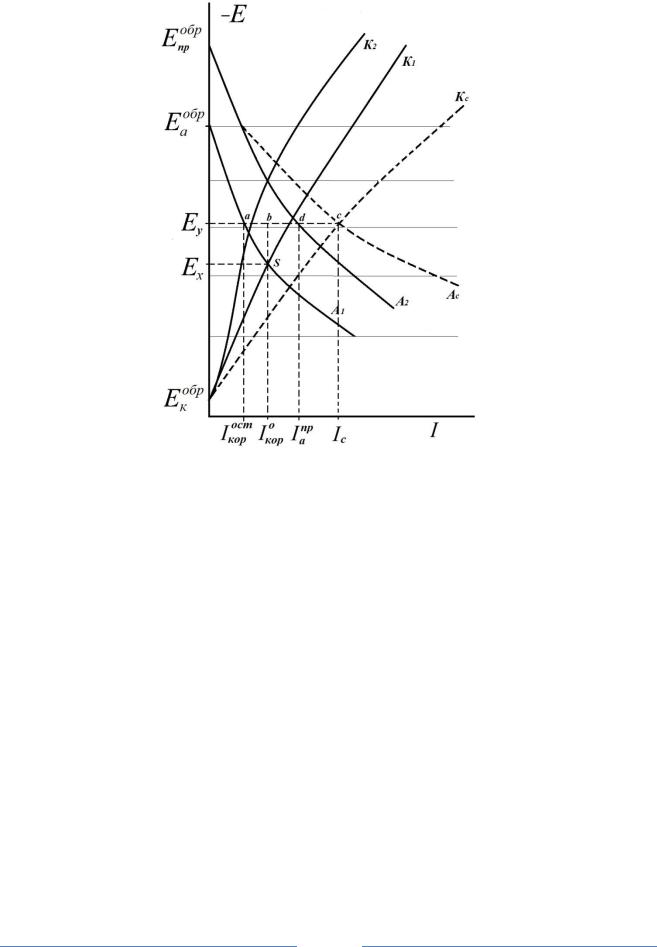
Рис.1. Коррозионная диаграмма катодной защиты с помощью протектора:
A1 и A2 – анодные, а K1 иK2 – катодные поляризационные кривые для защищаемого металла и для протектора; Acи Kc– суммарная анодная кривая и суммарная катодная кривая
Рассмотрим катодную электрохимическую защиту созданием контакта с другим металлом (рис.1), имеющим в рассматриваемых условиях более отрицательный потенциал анодной электрохимической реакции –
протекторная защита.
Пусть в двухэлектродной короткозамкнутой коррозионной системе (например, Fe – анод; окислитель в электролите – катод) установился ло-
кальный ток коррозии |
i0 |
и единый компромиссный потенциал |
E |
х |
(рис. |
|
|
|
кор |
|
|
|
|
обр |
|
|
обр |
|
|
|
1). [ Eа |
А1] – анодная поляризационная кривая для железа, [ Eк |
K1] – ка- |
||||
тодная поляризационная кривая для катодного процесса на катодных участках железа.
До подключения локальные токи саморастворения железа равны Iа Iк Iкор0 – отрезок [Ex S]
Подключим к короткозамкнутой локальной системе металл с более
44

отрицательным потенциалом – дополнительный анод – протектор, например Zn.
обр |
обр |
K2] – поляризаци- |
[ Eпр |
А2] – анодная кривая растворения цинка, [ Eк |
|
онная кривая катодных процессов на поверхности Zn (катодные реакции |
||
одни и те же на железе и на цинке, так как катодный процесс – процесс восстановления окислителя из электролита, все катодные кривые выходят
обр |
|
из одной точки – Eк |
). |
Таким образом, система из локальной двух–электродной стала ко- |
|
роткозамкнутой четырех–электродной. В таких системах сумма всех катодных токов равна сумме всех анодных токов. Построим суммарную анодную и суммарную катодную кривые, складывая токи при фиксированных потенциалах.
После подключения Zn произошла катодная поляризация микроэле-
мента (Fe – Ox-окислитель)– компромиссный потенциал системы с |
Ex |
сместился в область более отрицательных значений до |
E |
y |
. При этом по- |
||||||||||||
|
|||||||||||||||
тенциале суммарный ток коррозии Zn и Fe |
I |
c равен отрезку [ |
E |
y c], |
в кото- |
||||||||||
|
|
|
|||||||||||||
ром [ |
E |
y a] – локальный (остаточный) анодный ток на Fe |
I |
ост |
, а [ |
E |
y d] – |
||||||||
кор |
|||||||||||||||
|
|
|
|||||||||||||
|
|
|
|
|
I |
пр |
|
|
|
|
|
|
|
|
|
анодный ток растворения Zn макроанода – протектора |
а . |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
Часть электронов с цинка идет в локальную систему (Fe – анод – Ox
– катод) и гасит внутренний (локальный ток) системы, но появляется
внешний катодный ток Iквнеш Iс Iкорост [ad]. |
|
|
|
|
|
|
||||||
|
|
В результате локальный |
анодный ток |
саморастворения |
железа |
|||||||
|
|
|
I |
0 |
(отрезок[ Eх S]) |
|
|
|
|
ост |
|
|
уменьшится от значения |
кор |
до значения Iкор |
(отрезок |
|||||||||
|
||||||||||||
[ |
E |
y a]), а общий анодный и катодный ток возрастет до |
I |
с |
E |
y c. Весовые по- |
||||||
|
||||||||||||
|
|
|
||||||||||
тери металла локального анода (Fe) – уменьшаются, но общие весовые потери обоих металлов, выраженные в грамм-эквивалентах, возрастут за счет растворения Zn анода.
Явление уменьшения локального тока коррозии металла под действием внешней катодной поляризации называется положительным за-
щитным эффектом (+)ЗЭ (на диаграмме это отрезок [ab] |
= [ Eх S] – |
||
[ Eу a]. |
|
|
|
( )ЗЭ К |
зэ |
I внеш, |
(5.1) |
|
к |
|
|
Величина Кзэ показывает, какая доля внешнего катодного тока идет на катодную поляризацию системы, то есть, на сколько эффективно расходуется внешний ток (от металла протектора или от источника постоян-
45

ного тока).
Чем отрицательнее обратимый потенциал металла макроанода – протектора, чем меньше поляризуемость реакции ионизации металлапротектора, тем сильнее будет сдвинут потенциал коррозионной системы в отрицательную сторону и меньше будет остаточный ток коррозии – работы собственных микрогальванопар.
Протекторная защита является технически более простой, хотя её использование влечет за собой довольно большой расход цветного металла – протектора. Следует подчеркнуть, что в большинстве случаев количественный расход металла (сплава) протектора будет выше расхода на коррозию металла при отсутствии защиты.
В ряде случаев экономически и технически более выгодным будет использование катодной защиты с наложением внешнего тока, несмотря на большие единовременные затраты на установку источника постоянного тока.
Катодная защита от внешнего источника постоянного тока.
Защищаемая металлоконструкция присоединяется к отрицательному полюсу источника постоянного тока, а положительный полюс к выносному дополнительному аноду, помещенному в агрессивную среду (как правило, в наполнитель – активатор). Коррозионная диаграмма защиты внешним током представлена на рис. 2.
В данном случае до подключения локальные токи саморастворения
железа равны
Iа
Iк
I 0 кор
= [
Ex
S]. После подключения внешнего источни-
ка тока коррозионная система осталась двухэлектродной (Fe – анод, Ох –
катод). Поляризация такой системы внешним катодным током от
Ex
до
нового значения компромиссного потенциала
с.
При более отрицательном потенциале |
E |
|
E |
идет от точки S до точки |
|
|
у |
|
у |
локальный анодный ток на |
|
защищаемом металле уменьшился до
I |
ост |
|
кор |
||
|
,
появился внешний катодный
ток Iквнеш Iс Iкорост (отрезок [ac]). Положительный защитный эффект (+)ЗЭ–
отрезок
[ab] = [ Ex S]
( )ЗЭ
–[ E
Кзэ
у a]. |
|
|
|
I внеш , К |
зэ |
1/(1 P / P ), |
(5.2) |
к |
a к |
|
где
Pa
tgα
и
Pк tgβ
– поляризуемости анодного и катодного электрохи-
мических процессов (рис. 2).
46
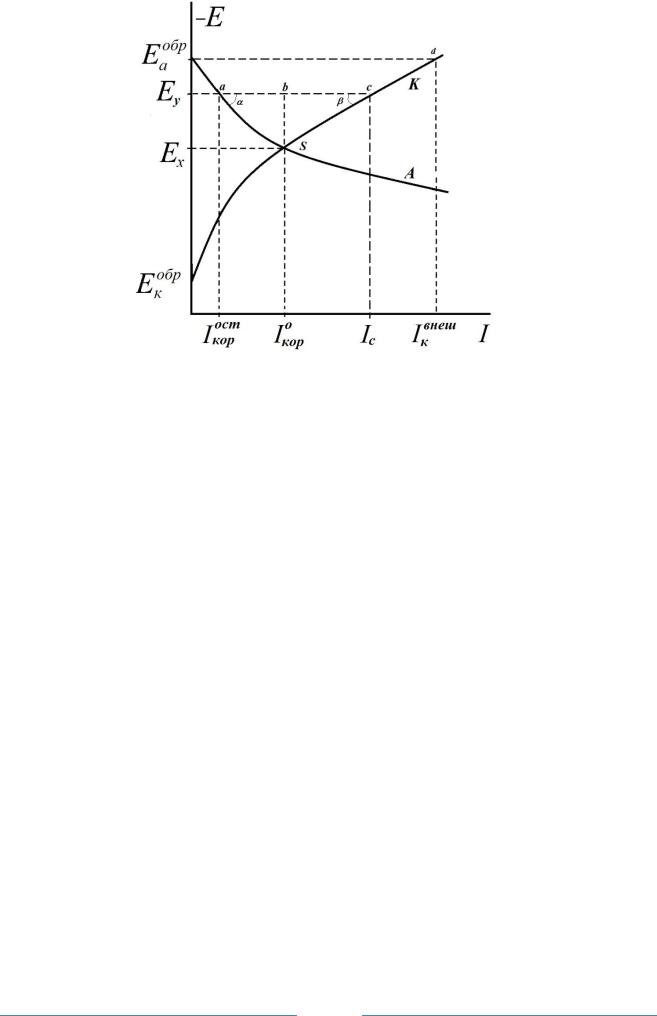
Рис.2. Коррозионная диаграмма катодной электрохимической защиты от внешнего источника постоянного тока
Защитный эффект тем больше, чем больше катодная и меньше анодная поляризуемость процессов в защищаемой коррозионной системе.
Таким образом, величина уменьшения локального тока коррозии (уменьшение весовых потерь металла) при катодной поляризации определяется величинами торможений анодного и катодного процессов (их поляризуемостями), то есть преимущественно природой лимитирующих стадий электрохимических реакций.
При катодной поляризации системы до значения обратимого потен-
циала анодной реакции
E |
|
E |
|
|
обр |
|
y |
а |
(точка d , рис. 2)
I ост кор
0,
процесс корро-
зии металла прекратится – условие полной электрохимической защиты.
К недостаткам катодной электрохимической защиты относится сравнительно ограниченный радиус её действия, что вынуждает устанавливать протекторы (или инертные аноды) на относительно небольшом расстоянии друг от друга. Оптимальное расстояние между анодами зависит отряда факторов: состава и электропроводности коррозионной среды, материала протектора, силы тока, проходящего через инертный анод, расстояния от него до защищаемой конструкции.
Цель работы – изучение протекторной и катодной защиты с наложением внешнего постоянного тока.
47

Вариант «А» – для студентов, обучающихся по направлению 18.03.01– «Химическая технология».
Экспериментальная часть
До начала работы тщательно обработать наждачной бумагой электроды коррозионного элемента, с тем, чтобы удалить с их поверхности оксидные пленки. Затем электроды обезжирить, протирая влажной содой, промыть дистиллированной водой, протравить в растворе соляной кислоты (1:1), тщательно промыть водой, высушить фильтровальной бумагой. На поверхности образцов не должно быть следов коррозии. Площади всех рабочих электродов должны быть примерно равными.
Электроды, имитирующие коррозионный элемент – анод, катод, и протектор (или вспомогательный анод при защите внешним током), крепят на специальной ячейке из органического стекла (рис. 3) с ее торцов и прижимают к ним кончики капилляров (геберов) стеклянных трубок, в которые помещают цинковые электроды сравнения (предварительно зачистив их) для замера потенциалов электродов.
Рис. 3. Схема ячейки
Ан, Кт, Пр. – электроды анод, катод и протектор;
Эсан, Эскт, Эспр – цинковые электроды сравнения анода, катода и протектора в стеклянных трубках
1. Изучение протекторной защиты металлов.
Изучение катодной электрохимической защиты удобно производить на так называемой «модели двухэлектродного коррозионного микроэлемента». Эта модель представляет собой гальванический элемент с пространственно разделенными металлическими электродами относительно больших размеров. Металл с более электроотрицательным потенциалом выполняет функцию макроанода (предполагается, что на всей его поверхности протекает анодная реакция окисления металла) и при внешнем токе
48
ровном нулю устанавливается стационарный (бестоковый) потенциал
анодной реакции |
E |
ст |
. Металл с более положительным потенциалом ра- |
|
ан |
||||
|
ботает в гальваническом элементе макрокатодом, при отсутствии внешнего тока поверхность приобретает стационарный (бестоковый) потенциал
|
E |
ст |
|
катодной реакции |
кт . |
||
|
В качестве анода внешней защиты – протектора используется растворимый металл (сплав) с более отрицательным обратимым потенциалом
для анодной реакции окисления |
E |
обр |
, чем у металла анода коррозионного |
|
пр |
||||
|
элемента.
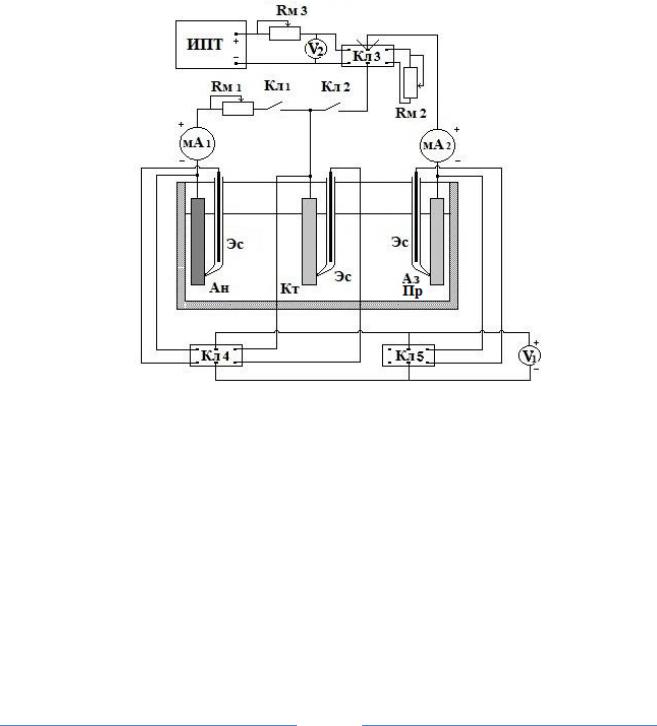
Собирается электрическая схема (рис.4).
Рис. 4. Электрическая схема измерения параметров электрохимической катодной защиты:
Ан – анод; Кт – катод; Пр – металл-протектор (при протекторной защите) или Аз – внешней анод (инертный электрод при защите от источника постоянного тока); Кл1– электрический ключ цепи защищаемого элемента; Кл2 – электрический ключ цепи протектора (инертного электрода); Кл3 – ключ, который переключает режим защиты от протектора (правое положение) или защиты от внешнего источника тока; Rм1, Rм2, Rм3 – магазины сопротивлений; мА1 и мА2 – миллиамперметры; ИПТ – источник постоянного тока; V1 – милливольтметр для измерения потенциалов электродов; Кл4 и Кл5 – электрические переключатели для замеров потенциалов электродов; V2 – вольтметр для измерения напряжения на источнике постоянного тока
49

Порядок выполнения работы.
Сначала милливольтметром (V1) измеряют потенциалы анода и катода при разомкнутых ключах (Кл1) и (Кл2), их потенциалы отождеств-
ляются со стационарными
Eст ан
,
Eст кт
. Далее при полностью введенном
максимальном сопротивлении магазина (Rм1) замыкают ключ (Кл1) и дожидаются установления минимальной величины тока коррозии, измеряют
величины потенциалов анода
E раб ан
и катода
E раб кт
.
Путем дальнейшего
уменьшения сопротивления магазина (Rм1) устанавливают новую постоянную силу тока и измеряют рабочие потенциалы анода и катода до тех пор, пока сопротивление магазина (Rм1) не станет равным нулю (необходимо не менее 5÷6 значений потенциалов и при определенных значениях тока коррозии). Данные заносят в таблицу 1.
При замкнутом ключе (Кл1) и сопротивлении магазина (Rм1=0) вновь получают значения рабочих потенциалов электродов короткозамкнутого макроэлемента при максимальном токе (скорости коррозии), от которого и производят защиту.
Поворотом ключа (Кл3) в правое положение, подключают протектор. При разомкнутом ключе (Кл2) измеряют величину потенциала метал-
ла-протектора и записывает ее значение (отождествляется с
E |
ст |
|
|
пр |
|
). При
полностью введенном максимальном сопротивлении магазина (Rм2) замыкают ключ (Кл2), в цепи протектора появляется ток, который показывает миллиамперметр (мА2). В цепи коррозионного элемента ток уменьшается. Выждав некоторое время до установления постоянных значений
тока в обеих цепях, замеряют потенциалы всех трех электродов Eанраб ,
E раб кт
и
E раб пр
, записывают величины токов. Уменьшая сопротивление (Rм2),
задают новое значение силы тока в цепи протектора и замеряют ток в коррозионном элементе. Вновь замеряют величины потенциалов при установившихся токах до тех пор, пока сила тока в коррозионном элементе не станет равной нулю, что соответствует отсутствию тока коррозии в короткозамкнутом коррозионном макроэлементе (или величину остаточного тока коррозии при сопротивлении магазина Rм2 = 0, при максимальном токе протектора). Таких замеров должно быть 5 ÷ 6 при разных величинах тока в цепи протектора. Экспериментальные данные заносят в таблицу 1. Во время опытов ячейка должна стоять неподвижно, т.к. малейшее колебание раствора приводит к уменьшению поляризации электродов и соответственно изменяются все электрохимические параметры элемента.
50
