
Коррозия лабы
.pdf
идет преимущественно с катодным контролем, поэтому наиболее эффективно замедлять коррозию будут катодные ингибиторы. В кислых средах они могут увеличивать торможение катодной реакции – повышать перенапряжение выделения водорода (соли As, Bi, некоторые органические замедлители) и уменьшать площадь действующих катодных участков путем экранирования, за счет образования пленки (неорганические и органические замедлители). В последнем случае возможно одновременное распространение пленки и на анодные участки; это вызывает увеличение торможения анодного процесса и повышение омического сопротивления системы, что также тормозит коррозионный процесс.
Ингибиторы наиболее часто применяют для борьбы с коррозией в системах с ограниченным объемом раствора: кислотной коррозии в процессах травления, при которых требуется удалить с изделия окалину или ржавчину с минимальными потерями самого металла, а также металлов и сплавов в процессе переработки нефти, в системах оборота воды и растворах электролитов.
Одним из методов изучения механизма действия ингибиторов является снятие поляризационных (анодных и катодных) кривых. Торможение ингибитором одной из стадий коррозионного процесса вызывает увеличение поляризации. Чем выше эффективность действия ингибитора, тем выше поляризуемость соответствующего электрохимического процесса.
Цель работы – исследование эффективности и механизма действия ингибиторов на коррозию сталей в растворах серной кислоты.
Работа состоит из определения потерь массы стальных образцов в растворах с ингибиторами и без них, а также анализа экспериментально полученных реальных анодных и катодных поляризационных кривых, снятых на аналогичных стальных образцах в кислоте с ингибитором и без него.
Сравнение поляризационных кривых, полученных для данного металла в растворе с замедлителем и без него, позволяет выяснить, какой процесс преимущественно тормозится при введении данного замедлителя.
Экспериментальная часть
Часть 1. Испытания проводят на стальных образцах одной марки. Марку стали (низколегированная или углеродистая сталь), кислоту (H2SO4, Н3РО4, HCl), ее концентрацию, ингибитор (соли As, Bi, катапин, тиомочевина, ЧМ, ПБ-5, уротропин, уротропин + KBr и др.) и его концентрацию указывает преподаватель.
В два стеклянных стакана наливают кислоту с замедлителем и без
81

него. Шесть образцов для коррозионных испытаний зачищают наждачной бумагой, обезжиривают оксидом магния, сушат и взвешивают на аналитических весах с точностью до 0,0001 г. Затем образцы подвешивают на изолированных проволочках в стаканы с исследуемыми растворами (по три образца в стакан). После 1,5÷2 ч выдержки образцы извлекают из кислоты, промывают водой, протирают фильтровальной бумагой, сушат и взвешивают на аналитических весах. Результаты записывают в табл. 1.
Таблица 1
Параметры защиты с помощью ингибитора
Материал электрода (марка стали) ………… Термообработка ……….
Электролит …………. Температура электролита ………… °С. Поверхность образца, м2: в стакане №1 …….; в стакане №2 …….. Длительность испытания………………. час.
Электролит |
№ |
Поверхность, |
|
Масса g , г |
|
Э , |
γ%, |
||||||||||
|
Квес , |
||||||||||||||||
|
|
|
|
образца |
|
|
см2 |
|
|
до |
после |
г/м2 час |
% |
% |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По убыли веса образцов для каждого из них определяется отрица- |
|||||||||||||||
тельный весовой показатель коррозии |
|
|
|
|
|
||||||||||||
Квес , г/м2∙час по уравнению (8.1): |
|||||||||||||||||
|
|
|
|
|
К |
|
|
g |
4 |
|
|
|
|
|
|||
|
|
|
|
|
вес |
S |
10 |
|
, |
|
|
|
(8.1) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где |
g |
– убыль веса образца, г; |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
S |
– рабочая (смоченная электролитом)поверхность образца, см2; |
|
|||||||||||||||
|
– время проведения коррозионных испытаний, час. |
|
|
||||||||||||||
|
|
Глубинный показатель коррозии металла П, мм/год, в растворах без |
|||||||||||||||
и с ингибитором |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
П |
Kвес 8,76 |
, |
|
|
|
|
(8.2) |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
d Ме |
|
|
|
|
|
|
||
где d Ме – плотность металла, г/см3.
Эффективность действия замедлителя (в процентах) вычисляют по уравнению
где
К вес
, К
вес
Э% |
Квес |
Квес |
Ин |
100% , |
(8.3) |
|
Квес |
|
|||
|
|
|
|
|
Ин – отрицательные весовые показатели коррозии образцов
без ингибитора и с ингибитором в электролите.
Действие замедлителя может характеризоваться защитным эффектом γ%
82
γ%
|
К |
|
|
|
|
вес |
|||
|
||||
|
|
|||
|
|
|
||
|
К |
|
|
|
|
вес Ин |
|||
100%
.
(8.4)
Часть 2. Электрохимические исследования.
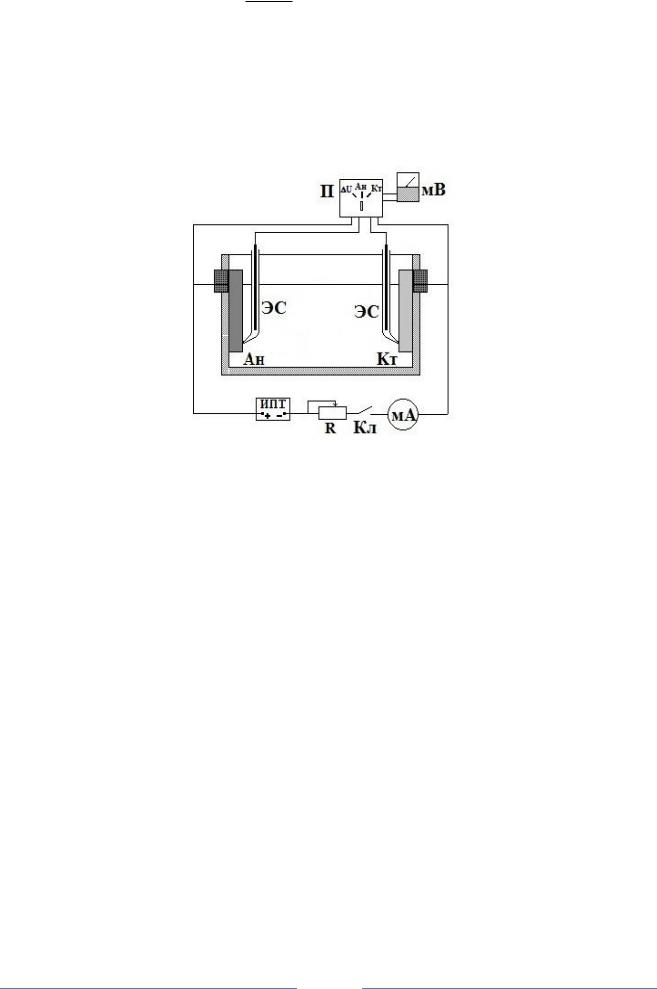
Электрохимические коррозионные исследования стальных образцов проводятся в тех же растворах на установке, схема которой приведена на рис.1.
Рис. 1. Электрическая схема установки
Ан – анод, Кт – катод, ЭС – электрод сравнения, Кл – ключ замыкания, П – переключатель измерения потенциалов, мА – миллиамперметр, мВ – милливольтметр, ИПТ – источник постоянного тока, R – магазин сопротивлений
Предварительно подготовленные 2 одинаковых образца (как в части 1) помещают в ячейку, наливают определенное количество кислоты без замедлителя и после пятиминутной выдержки измеряют начальные потенциалы электродов (Кл в разомкнутом состоянии) в данном растворе с помощью милливольтметра.
Замыкают цепь, включают стабилизированный источник постоянного тока, устанавливают в цепи ток, равный 1,0 мА, и через 1 минуту измеряют потенциалы анода, катода и записывают их в табл. 2.
Таблица 2
Изменения потенциала анода и катода от плотности тока
Поверхность катода
Sкт
……….. см2; Поверхность анода
Sан
…………. см2
Ток |
Потенциал като- |
Потенциал ано- |
Плотность тока |
K |
|
П, |
||||
вес , |
||||||||||
I , |
да Eкт , B |
да Eан , B |
j, мА/cм2 |
|
мм/год |
|||||
2 |
|
|||||||||
мА |
|
|
|
|
|
|
г/м · час |
|
||
по ЭС |
по НВЭ |
по ЭС |
по НВЭ |
анода |
катода |
|
||||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
83

Последовательно увеличивают силу тока в цепи 2,0;3,0; 4,0; 5,0; 7,0;
10,0; 20,0; 30,0; 50,0; 75,0; 100,0 мА, измеряя и записывая каждый раз по-
сле минутной выдержки потенциалы катода, анода.
После окончания измерений кислоту выливают в бутыль для слива кислот, электрохимическую ячейку промывают водой. Затем образцы вновь готовят (как в части 1) и производят аналогичные измерения в кислоте с ингибитором.
Во время опытов наблюдают за состоянием поверхности электродов и за раствором, отмечая сравнительную интенсивность выделения водорода, потемнение поверхности образца и накопление шлама.
Потенциал металла по отношению к нормальному водородному
электроду EМнвэe рассчитывают
Eнвэ Мe
по формуле:
E E хсэ , Мe нас
(8.5)
где
EМe
– потенциал металла, измеренный относительно хлорсеребряного
электрода сравнения;
E хсэ нас
– потенциал хлорсеребряного электрода сравнения, залитого насы-
щенным раствором KCl.
По полученным данным на одной диаграмме строят зависимости
E |
кт |
j |
к |
и |
E |
ан |
j |
а |
(реальные анодные и катодные поляризационные |
|
|
|
|
кривые с ингибитором и без), по ним следует оценить сдвиг исходного стационарного коррозионного потенциала (при разомкнутом ключе) под действием ингибитора. А также, на основании данных графиков определяются поляризуемости процессов коррозии, на какую из стадий подействовал ингибитор.
Для реальных электродов вследствие их термодинамической неустойчивости в агрессивной среде, происходит явление саморастворения, то есть генерирования собственного тока коррозии, поляризационные кривые для реальных металлов будут отличаться от идеальных кривых.
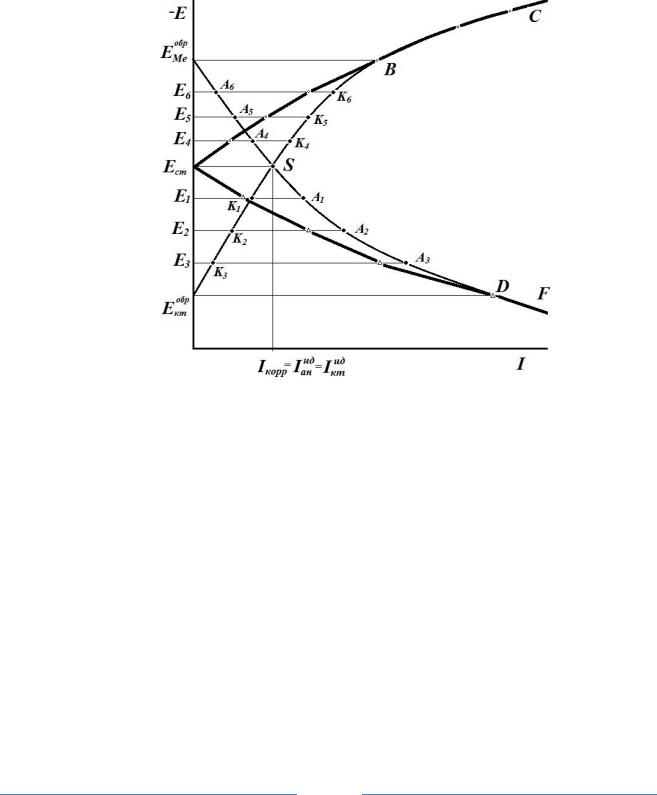
При замыкании двух идеальных электродов (протекания двух идеальных процессов) в системе устанавливается максимальный ток Iмax коррозии (локализуется внутренний ток саморастворения
Iанид =Iктид = Iкор) и единый компромиссный потенциал Ест (который имеет какое-то среднее значение между Еобркт и ЕобрМе). Точка S – точка пересечения [Еобркт SB] – идеальной катодной и [ЕобрМе SD] – идеальной анодной поляризационных кривых (рис.2).
Из этих идеальных поляризационных кривых графическим способом можно построить реальные поляризационные кривые. На прак-
84
тике поляризационные кривые получаются экспериментально при поляризации нашего электрода от внешнего источника постоянного тока или с помощью потенциостата.
Допустим, что в растворе находится реальный электрод, на котором самопроизвольно протекает коррозионный процесс, то есть его нужно рассматривать как систему короткозамкнутых элементов АнКт. В этом случае начальный потенциал такого электрода будет Ест
– единый компромиссный потенциал системы.
Рис. 2. Идеальные [ЕобрМе SDF] – анодная, [Еобркт SBC] – катодная и реальные [Ест DF] – анодная, [Ест BC] – катодная поляризационные кривые
коррозионного процесса
1. При анодной поляризации системы потенциал электрода будет смещаться в положительном направлении, до значения Е1 положительнее Ест, при этом в системе появится внешний анодный ток, величина которого будет соответствовать разности идеального анодного и катодного токов.
При потенциале Е1 Iктид = [Е1 К1] , Iанид = [Е1А1]. Тогда Iанвнеш = Iанид -Iктид = [А1К1] – ток внешней анодной поляризации. Заполяризуем систему до Е2 Iктид=[Е2К2], Iанид = [Е2А2], то появится внешний ток Iанвнеш [А2К2].
85

При потенциале Е3 Iктид = [Е3К3]; |
Iанид =[Е3А3], Iанвнеш =[А3К3]. |
Если систему заполяризовать анодно до обратимого потенциала |
|
катодного процесса Ектобр, то Iктид |
= 0 , Iанвнеш = Iанид . |
Изменения величины внешнего тока в зависимости от общего потенциала электрода и будут реальной поляризационной кривой.
Если продолжать систему поляризовать анодно положительнее Ектобр, то все токи реальной анодной поляризационной кривой совпадут с токами идеальной анодной поляризационной кривой, т.к. Iктид = 0.
1. При построении реальной катодной поляризационной кривой при любом значении потенциала отрицательнее чем Ест величины токов внешней катодной поляризации будут равны разности идеальных катодных и анодных токов Iктвнеш = Iктид - Iанид .
При потенциале Е4 |
Iанид |
= [Е4А4], |
Iктид = [Е4К4] |
в системе появится |
внешний катодный ток Iктвнеш = Iктид - Iанид = [K4A4]. |
|
|||
При потенциале Е5 |
Iанид |
= [Е5А5], |
Iктид = [Е5К5] |
Iктвнеш =[К5А5]. |
При потенциале Е6 |
Iанид |
= [Е6А6] |
Iктид = [Е6К6] |
Iктвнеш = [К6А6] |
При потенциале равному ЕМеобр обратимому потенциалу для анодного
процесса Iанид = 0 Iктвнеш = Iктид – Iанид = Iктид.
При более положительных потенциалах, чем ЕМеобр идеальная катодная поляризационная кривая будет совпадать с реальной катодной поляризационной кривой.
Нетрудно видеть, что вначале реальные и идеальные кривые существенно отличаются друг от друга, но при значительных плотностях тока стремятся сблизиться, а при достижении значений обратимых потенциалов анодного Еан = ЕМеобр и катодного Ект= Ектобр они сливаются (отрезки ВС и DF). На этих участках и исследуем механизм электрохимических реакций по данным реальных поляризационных кривых.
Наиболее достоверные данные получаются для тех коррозионных систем, в которых не образуется на поверхности металла малорастворимых соединений. Например, процесс коррозии металлов в концентрированных растворах кислот протекает в основном с водородной деполяризацией и обильное выделение водорода обескислораживает раствор, кислород не поступает к корродирующей поверхности и не участвует в катодном процессе. Тогда анодная реакция ионизации металла и катодная реакция выделения водорода протекают с контролем по стадии переноса электрона, и поляризационные зависимости описываются уравнением Тафеля,
86

η = а + b∙lg(j) |
(8.6) |
на полулогарифмических зависимостях это будут линейные участки.
Рис. 3. Поляризационные кривые, поясняющие эффективность действия ингибитора:
А1 и А2– анодные поляризационные кривые; К1 и К2– катодные поляризационные; А1 и К1– кривые при отсутствии ингибитора; А2 и К2– в присутствии ингибитора
Из построенного графика |
E |
к |
lg( j |
к |
) |
и |
E |
а |
lg( j |
а |
) |
(рис.3.) экстраполя- |
|
|
|
|
|
|
цией линейных (тафелевских) участков поляризационных кривых до точки их пересечения, находят потенциалы коррозии Eкор1 и Eкор2 , а из вели-
чин
Kвес
lg( jкор ) , рассчитывают плотности тока коррозии jкор1 и |
j |
|
j |
кор2 |
корИн , |
||
– скорость коррозии металла, для раствора без ингибитора |
и с инги- |
||
битором.
|
|
|
|
A |
4 |
|
K |
j |
|
Ме |
|
||
вес |
|
10 |
, |
|||
|
кор |
|
z F |
|
||
|
|
|
|
|
|
где jкор – плотность тока коррозии данного металла, А/см2; AМе – атомный вес металла, г;
z – изменение валентности металла; F – число Фарадея, 26,8 А·час/г-экв.
(8.7)
Используя значения
jкор1
и
jкорИн
, можно оценить эффективность ин-
гибитора и найти Э% – по формуле (8.3),защитный эффект γ% – по форму-
ле (8.8)
87

γ%
jкор |
100% |
|
jкорИн |
||
|
.
(8.8)
На основании поляризационных кривых стали в кислоте с замедлителем и без него определяют механизм действия замедлителя и его влияние на электродные реакции.
По полученным экспериментальным и расчетным данным проводят обсуждение результатов и пишут выводы об эффективности действия ингибитора при коррозии стали в кислоте.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.Каков механизм действия адсорбционных и пленочных ингибито-
ров?
2.Анодные ингибиторы, непосредственно тормозящие переход ионов металла в раствор (стадию ионизации металла).
3.Анодные ингибиторы, способствующие формированию пассивных пленок на анодных участках поверхности металла.
4.Окислительные ингибиторы, механизм действия. В чем достоинства и опасность использования окислительных ингибиторов?
5.Замедлители вторичного действия – анодные ингибиторы кроющего
типа.
6.Катодные ингибиторы, тормозящие реакцию ионизации кислорода.
7.Катодные ингибиторы, экранирующие площадь катодной поверхно-
сти.
8.Катодные ингибиторы, повышающие перенапряжение катодного процесса.
9.Органические ингибиторы.
10.Летучие ингибиторы, механизм действия и области применения.
ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ ЗАЩИТНОГО ПОТЕНЦИАЛА МЕТАЛЛА КОНСТРУКЦИИ И ПАРАМЕТРОВ ЭЛЕКТРОХИМИЧЕСКОЙ КАТОДНОЙ ЗАЩИТЫ
Лабораторная работа № 9
Одним из распространенных способов защиты от коррозии металлических конструкции, находящихся в почве, морской, пресной воде или в технологических средах является электрохимическая катодная защита. Катодная поляризация осуществляется или посредством электрического
88

подсоединения к конструкции более отрицательного металла, который разрушается в ходе эксплуатации (протекторная защита), или же с помощью внешнего источника тока, с использованием дополнительного анода и самой конструкции, подключаемой катодом.
Цель катодной поляризации – достижение равновесного (обратимого) потенциала металла конструкции, когда прекращается его разрушение.
Следовательно защитным потенциалом корродирующей системы является теоретически рассчитанный равновесный (обратимый) потенциал металла, который будет подвергаться анодному разрушению.
E |
обр |
E |
защ |
– это и будет условие полной электрохимической защиты. |
|
ан |
Ме |
||||
|
|
Теоретическое значение защитного потенциала может быть рассчитано термодинамическим путем, так как оно соответствует величине обратимого (равновесного) потенциала, когда устанавливается равновесие между металлом и его ионами в тонком слое электролита, непосредственно примыкающего к поверхности защищаемого металла.
Например, для железа в кислой среде для реакции |
|
|||||
|
2 |
|
0 |
|
(9.1) |
|
Fe 2e Fe |
, E |
0,44B |
||||
|
|
|||||
зависимость обратимого потенциала железа от концентрации соответствующих ионов описывается уравнением Нернста
E |
обр |
|
E |
0 |
|
|
R T |
ln |
a |
Fe2 |
|
|
|
|
|
||||||||
Fe2 |
/ Fe |
Fe2 |
/ Fe |
n F |
a |
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Fe |
|
, где Е0 =-0.44В
(9.2)
Расчет по этой формуле может быть выполнен только после опреде-
ления концентрации (активности |
a |
Fe 2 ) ионов железа в тонком приэлек- |
|
|
тродном слое электролита. Однако надежных методов определения таких поверхностных концентраций нет.
В нейтральных (например, коррозия в морской воде или подпочвенная коррозия) и слабощелочных средах анодная реакция будет начинаться
со следующего равновесного состояния: |
|
|
|
|
|
|
|
|
|
||||||||
|
Fe 2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(9.3) |
|
2 |
O 2e |
Fe(OH) |
2 |
|
2H |
, |
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
и уравнение обратимого потенциала этой реакции вычисляется так: |
|||||||||||||||||
обр |
0 |
|
|
|
R T |
|
aFe(OH )2 aH2 |
|
|
|
|||||||
EFe(OH )2 / Fe EFe(OH )2 / Fe |
|
|
|
|
ln |
|
|
|
|
|
|
, |
(9.4) |
||||
n F |
|
|
a |
Fe |
a2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H 2O |
|
|
|
|
при aFe=1 , aFe(OH)2=1, t = 25 0 C и aH2O= 1 |
|
|
|
|
|
|
|
|
|
||||||||
|
Eобр |
E0 |
|
|
0,059 pHS |
|
|
(9.5) |
|||||||||
|
Fe(OH )2 / Fe |
|
Fe(OH )2 / Fe |
|
|
|
|
|
|
|
|
|
|
|
|
||
где рНs– величина рН в тонком слое электролита, определяется поверхностной концентрацией (активностью) протонов водорода.
Равновесная концентрация ионов железа в нейтральных и щелочных
89

растворах может быть определена, если известно значение pHS приэлектродного слоя, а не в объеме раствора.
Для определения стандартного потенциала реакции (9.3) воспользуемся следующим. Равновесие системы определяется произведением рас-
творимости |
ПРFe(OH )2 гидрооксида железа (II) при наличии осадка Fe(OH)2 |
|||||
на поверхности металла |
|
|
|
|
|
|
|
ПР |
a |
|
a |
2 |
(9.6) |
|
|
|
||||
|
Fe(OH)2 |
Fe2 |
(OH ) . |
|
||
Отсюда активность ионов железа |
aFe2 |
ношения с использованием Kw= aн топротолиза воды.
определяется из следующего соот-aOH =10-14 моль/л – константа ав-
|
|
|
|
ПР |
|
ПР |
a |
2 |
|
|
|
|
|
|
H |
||||
a |
|
|
|
|
Fe(OH )2 |
|
Fe(OH )2 |
|
|
Fe2 |
|
a |
2 |
(Kw) |
2 |
|
|||
|
|
|
|
||||||
|
|
|
|
(OH ) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
,
(9.7)
тогда величину защитного потенциала для железа можно рассчитать, исходя из уравнения (9,8)
E |
защ |
E |
0 |
|
2,303 R T |
lg(ПР |
) |
2,303 R T |
lg(Kw) |
2,303 R T |
|
|
|
|
|
||||||||
Fe |
Fe2 / Fe |
|
|
|
|
||||||
|
|
|
2 |
F |
Fe(OH )2 |
|
F |
|
F |
||
|
|
|
|
|
|
|
|
||||
pH
(9.8)
0 |
B , ПРFe(OH )2 |
=1,65·10 -15. |
По справочным данным значение EFe2 / Fe = –0,44 |
Kw |
= 10 |
-14 |
. |
|
|
|
|||
|
|
|
||
|
Подставив все значения, получим формулу для расчета защитного |
|||
потенциала железа в нейтральной и щелочной среде |
|
|||
|
|
|
EFeзащ ( 0,047 0,059 pHS ) . |
(9.9) |
|
Применение этого уравнения так же проблематично, так как |
pHS – |
||
это |
pH |
приэлектродного слоя, а не объема электролита, хотя методически |
||
в настоящее время можно определить |
pHS |
приэлектродного слоя, исполь- |
зуя микрокапилярные (зондовые) электроды.
В нейтральных средах, например в морской воде, pHS определяется жесткостью воды, то есть присутствием ионов магния (реже кальция в почвах), когда на поверхности металла при катодной защите образуется не только гидрокcид железа, но и гидрокcид магния Mg(OH)2.
Выразим активность ионов железа через активность ионов магния. Для магния ПРMg(OH)2 aMg2 aOH2 , так как aOH – активность ионов OH- для
железа и магния равны, получим уравнение расчета защитного потенциала для железа
EFeзащ EFe0 2 /Fe |
2,303RT |
lg(ПРFe(OH) 2 |
/ ПРMg(OH)2 ) |
2,303RT |
lgaMg 2 .(9.10) |
|
|
||||
|
2F |
|
2F |
||
90
