
Коррозия лабы
.pdf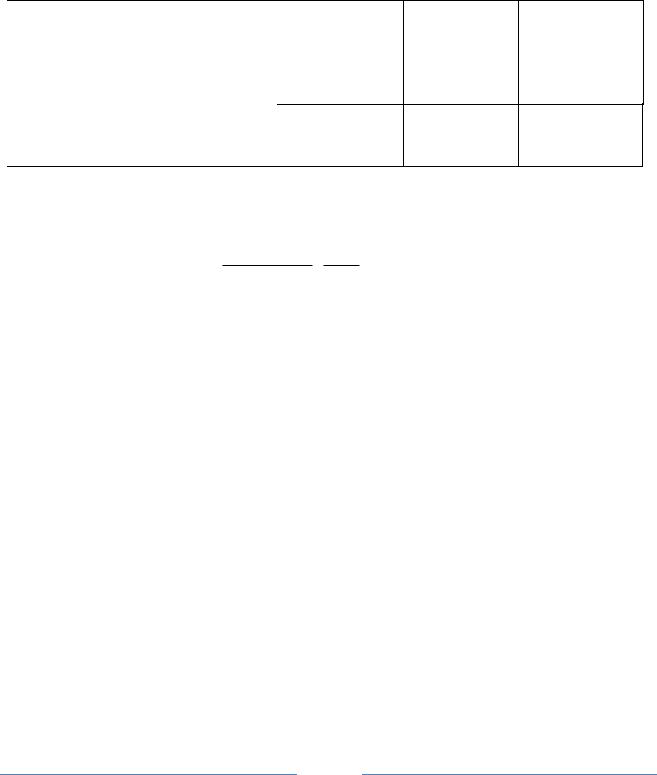
Цепь замыкают и от протектора или внешнего источника постоянного тока проводится катодная поляризация защищаемого металла - анода (путем уменьшения сопротивления Rм) до величины защитного потенциала, определенного в части 1. Записывают значения тока в цепи протектор- металл (схема 4а) или тока и напряжения в цепи металлвспомогательный электрод (схема 4б) при использовании источника постоянного тока. Данные сводят в таблицу 3.
Таблица 3
Параметры протекторной и катодной защиты
Значение потенциала, |
Сила то- |
Скорость раз- |
|
|
В |
ка, А |
рушения про- |
|
|
|
тектора П , |
|
|
|
мм/год |
|
|
|
|
на ме- |
на протек- |
|
|
талле |
торе |
|
|
|
|
|
|
Расход протектора,
K пр, вес
кг/м2 год
Удельный расход электро-
энергии W , кВт·ч/м2·год
По величине силы тока в цепи протектора можно рассчитать ско-
рость коррозии протектора |
|
|
|
|
|
|
|
|
|||
Kвес пр, г/м2·час |
|
|
|
||||||||
|
K |
|
|
I |
|
|
A |
10 |
4 |
|
|
|
|
|
Ме |
, |
(9.12) |
||||||
|
|
|
|
|
|
|
|||||
|
|
вес |
Sан пд ис |
z F |
|
|
|||||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
I |
пр |
|
|
|
|
|
где I – сила тока на протекторе |
кор ), А; |
|
|
|
|
||||||
|
|
|
|
|
|||||||
Sан – рабочая (смоченная электролитом) поверхность протектора, см2; |
|||||||||||
|
Ме – атомный вес металла протектора, г; |
|
|
|
|
||||||
A |
|
|
|
|
|
|
|
|
|
|
|
z |
– изменение валентности в анодной электрохимической реакции; |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
F – число Фарадея, 26,8 А·час/г-экв.
пд – коэффициент полезного действия протектора (эта величина зависит от металла (сплава) и выбирается из данных табл.2);ис – коэффициент использования протектора (он равен 0,95 ÷ 0,98).
Глубинный показатель |
коррозии металла протектора |
П , мм/год |
||||
(проницаемость): |
|
|
|
|
|
|
|
K |
8,76 |
|
|
||
П |
вес |
|
|
, |
(9.13) |
|
dМе |
||||||
|
|
|
||||
где
d Ме
– плотность металла протектора, г/см3.
Расход протектора, K пр, кг/м2 год, можно рассчитать с учетом его непроизводительных потерь:
101

K |
8,76 K |
|
. |
|
вес |
||||
пр |
|
|
(9.14)
Срок службы протекторов Т (в годах) – это время, через которое необходимо производить замену протекторов, определяется по формуле:
Т |
М QMe пд ис |
, |
|
8760 Iпр |
|||
|
|
(9.15)
где М – масса протектора (кг); 8760 – среднее число часов в году (час/год);
Iпр |
|
защищаемый металл, А; |
|
– сила тока в цепи протектор – |
|||
QMe |
|
|
|
– теоретическая токоотдача металла протектора (А∙час/кг); |
|||
QMe |
1000 |
, |
|
qMe |
|
||
|
|
|
|
(9.16)
где qMe – электрохимический эквивалент металла протектора, г/А∙час. Удельный расход электроэнергии (W , кВт·ч/м2·год) при катодной
защите с наложением внешнего тока рассчитываем по формуле:
W
Iвнешн V 8,76 |
4 |
Sан. |
10 |
|
,
(9.17)
где Iвнешн – сила тока от источника постоянного тока, А;
V – напряжение на внешнем источнике постоянного тока при достижении защитного потенциала, В;
Экспериментальные и расчетные данные приводятся в сводной таблице 3
Отчет по работе должен состоять из введения, методики эксперимента, экспериментальных результатов, обсуждения результатов, выводов и списка использованной литературы.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1.При каких условиях достигается полная электрохимическая защита?
2.Способы расчета защитного потенциала металлоконструкции.
3.Как экспериментально можно определить pHs-приэлектродного слоя электролита в процессе коррозии металла?
4.Каким образом можно найти значение защитного потенциала в морской воде?
5.Что такое пд – коэффициент полезного действия протектора и ис
–коэффициент использования протектора?
102

6.В каких случаях полная электрохимическая защита становится экономически невыгодной и когда она практически недостижима?
7.Что такое перезащита и чем она вызвана?
8.Какие электроды сравнения используются для измерения потенциалов металлоконструкции в почве и морской воде?
9.Как влияет влажность почвы и наличие в ней микроорганизмов на величину защитного потенциала металла?
10.Напишите реакции, протекающие на электродах в Вашем случае коррозионных испытаний.
ОПРЕДЕЛЕНИЕ РАДИУСА ДЕЙСТВИЯ КАТОДНОЙ ЗАЩИТЫ ПО РАСПРЕДЕЛЕНИНЮ ПОТЕНЦИАЛА НА ЗАЩИЩАЕМОМ МЕТАЛЛЕ
Лабораторная работа № 10
Электрохимическая коррозия металлических конструкций возникает при наличии на их поверхностях энергетически неоднородных участков в электропроводящих средах, к которым относится и водопроводная вода.
Энергетическая неоднородность обусловлена: искажениями в кристаллической решетке, местными напряжениями в металле, включениями легирующих и примесных металлов, не одинаковой аэрацией отдельных участков поверхности и различной температурой. Даже спектрально чистый металл в электропроводящей жидкости может корродировать электрохимически.
Электропроводность водопроводной воды обусловлена содержанием в ней различных ионов, хотя и в очень малых концентрациях (ПРИЛОЖЕНИЕ 1, табл.7).
Таким образом, процесс электрохимической коррозии сводится к протеканию, по крайней мере, двух сопряженных реакций: окислению металла с образованием продуктов коррозии и восстановлению катодного деполяризатора. Отсюда следует, что движущим фактором электрохимической коррозии является электродвижущая сила (ЭДС), равная разности равновесных потенциалов (обратимых) для катодной и анодной реакций. Корродирующая поверхность металла приобретает при очень малых омических сопротивлениях среды стационарный (компромиссный) потенциал, величина которого зависит от поляризуемости электродных реакций и находится между EМобре и Eохобр .
Поляризуемость – dE / dI показывает, как изменяется сопротивления электрод-
103

ной реакции при изменении тока коррозии системы – это сопротивление электродной реакции в установившемся коррозионном процессе. Чем больше поляризуемость электродных реакций, тем меньше ток коррозии.
1. Анализ процесса коррозии на примере медных трубок (холодильников) в водопроводной воде
В технической водопроводной воде (ПРИЛОЖЕНИЕ 1, табл. 7) содержатся примеси: хлоридов, хлоратов, нитратов, нитритов, сульфидов, железа, а также растворенный кислород. Показатель pH воды составляет от 6,7 до 8,1.Теоретически все указанные примеси могут принимать участие в процессекоррозии меди, но по-разному, так как имеют различные значения редокспотенциалов.
Замеры установившегося (компромиссного) стационарного потенциала ECuстац меди в водопроводной воде показали, что в большинстве случаев (при
отсутствии перемешивания раствора) он находится в интервале +0,23 ÷
+0,30 В по НВЭ.
Следовательно, на участках металлического образца, которые имеют
стационарные потенциалы |
стац |
положительнее обратимых (равновесных) по- |
ECu |
тенциалов для реакций окисления (растворения) металла ECuобр , будет протекать
коррозионный процесс.
На аноде, то есть на меди, с точки зрения термодинамики в первую очередь должен идти процесс с самым отрицательным равновесным потенциалом. Ввиду низкой (~ 10 -6 г-ион/л) концентрации сульфидов в воде, говорить об образовании фазового осадка CuS или Cu2S не имеет смысла. Следовательно, воз-
можными анодными реакциями на меди в водопроводной воде будут: |
||||||||
|
|
|
|
, E |
o |
0,471B |
|
|
2Cu H |
O 2e Cu |
O 2H |
, |
|||||
|
|
|||||||
2 |
2 |
|
|
|
|
|
||
E |
обр |
|
E |
o |
|
RT |
2,303lg a |
|
|
0,471 0,059pH. |
|
|
|
|
|||||||
|
o |
|
|
|
|
|||||
Cu / Cu |
|
|
|
F |
|
H |
|
|||
|
2 |
|
|
|
|
|
|
|
||
(10.1)
При рН=6,7 |
E |
обр |
|
|
0,471 0,059 6,7 |
0,075B |
||||||||||||
|
|
|
|
|||||||||||||||
Cu / Cu o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
Cu H |
|
O 2e CuO 2H |
, E |
0,570 B. |
|||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При рН= 6,7 |
|
ECuобр/ Cuo 0,57 0,059 6,7 0,174 B |
||||||||||||||||
В некоторых условиях может присоединяться и процессы: |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, E |
0 |
0,609 B |
|
Cu 2H |
|
|
O 2e Cu(OH) |
|
2H |
||||||||||||
|
2 |
2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
При рН= 6.7 |
E |
обр |
|
|
|
0,609 0,059 6,7 0,212B |
||||||||||||
|
|
|
|
|||||||||||||||
|
Cu /Cu(OH)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
- |
|
, E |
0 |
0,137B. |
|||||||
|
|
|
Cu Cl |
e CuCl |
|
|||||||||||||
(10.2)
(10.3)
(10.4)
Eобр |
Eo |
RT |
2,303 lg |
1 |
, |
|
|
||||
Cu / CuCl |
|
F |
aCl |
||
|
|
||||
104
При концентрации ионов Cl- (по данным анализа водопроводной воды ПРИЛОЖЕНИЕ 1 табл.7) 2,08÷3,1 мг/л или 5,7∙10-4÷8,8∙10-4 моль/л
E |
обр |
0,137 |
RT |
2,303lg a |
4 |
0,328B, |
|
|
0,137 0,059lg 8,8 10 |
||||
Cu / CuCl |
|
F |
Cl |
|
|
|
|
|
|
|
|
|
|
Последние реакции образования Сu(ОН)2 и CuCl термодинамически возможны, но протекают не всегда, а только при очень интенсивном подводе деполяризаторов.
Но все-таки оставлять без внимания ионы S2- и Сl- не следует, так как они обладают провоцирующими свойствами, стимулирующими точечную и язвенную коррозию.
Основными продуктами коррозии медных трубок должны быть Cu2O и CuO. В какой-то мере это подтверждает цвет гидратированных оксидов на медных трубках: коричнево-красный Cu2O и черный CuO.
Рис.1 Диаграмма коррозии меди в водопроводной воде:
1– катодная поляризационная кривая ионизации кислорода ( реакция 10,5); 2– анодная по-
ляризационная кривая процесса 2Cu Cu |
O (реакция 10,1); 3– анодная поляризационная |
2 |
|
кривая процесса Cu CuO(реакция 10,2); 4–анодная поляризационная кривая процесса
Cu Cu(OH ) |
|
(реакция 10,3); 5– суммарная анодная кривая на меди (пунктир); E |
стац |
– |
|
|
|
|
|
|
2 |
Cu |
|
|
стационарный потенциал меди; 6– предельный ток диффузии кислорода Iдифпр .
Относительно природы катодных процессов (учитывая состав воды) можно предположить, что термодинамически первоочередными реакциями будут реакции восстановление гипохлорита до хлорида. Однако концентрация СlO- ничтожно мала (~ 10 -6 моль/л). Кроме того, гипохлорит в циркулирующей воде участвует в реакции окисления Fe(OH)2 до Fe(OH)3 и восстанавливается.
105

Близким по потенциалу к реакции ионизации кислорода является восстановление ионов NO3- до азота. Однако, по причине малой (~ 10-5 г-ион/л) концентрации NO3- в воде, существенного вклада в процесс коррозии не вносит.
Таким образом, при значениях |
pH = 6,7 ÷ 8,1 на катоде преимущественно |
||||||||
идет процесс ионизации кислорода: |
|
|
|||||||
|
|
|
|
|
|
|
обр |
|
|
O |
|
2H |
|
O 4e 4OH |
, E |
0,401B |
, при рН = 6,7 |
||
2 |
2 |
|
|
||||||
|
|
|
|
О 2 |
|
||||
E |
обр |
|
0,401 |
RT |
2,303 lg a |
1,23 0,059 рН 0,835 В. |
|
|
|||||
|
/ OH |
|
||||
O |
|
F |
OH |
|
||
|
2 |
|
|
|
|
|
(10.5)
и возможный суммарный процесс коррозии меди запишется: |
|
2Cu 1/2O2 Cu2O, |
(10.6) |
2Cu O2 2CuO, |
(10.7) |
Тогда диаграмма коррозии должна иметь вид, представленный на рис. 1.
2.Определение защитного потенциала меди
вводопроводной воде.
Всоответствии с теоретическими положениями катодной защиты,
чтобы погасить процесс коррозии нужно сдвинуть потенциал конструкции (металла) от компромиссного до обратимого потенциала самого отрицательного
из возможных анодных процессов,
2Cu
то есть до |
E |
обр |
реакции |
||||
Cu |
|
||||||
|
|
||||||
1/2O |
2 |
Cu |
2 |
O. |
|||
|
|
|
|
|
|
||
В таких условиях реакции окисления меди протекать не будут, и вся поверхность металла будет работать как единый катод, на котором пойдет процесс восстановления кислорода. Сопряженный ему анодный процесс может протекать на протекторе при протекторной защите или на инертном вспомогательном электроде при электрохимической защите внешним током.
Значение pH при катодной поляризации (в отсутствии анодной реакции) повышается примерно на 1 единицу и может достигать 8,5 ÷9,0.То есть, равновесный потенциал реакции (10.1) сместится до–0,035 В при pH 8,5
и до –0,060 В при pH = 9,0.
Для защиты меди необходимо установить на них компромиссный потенциал на ~50 мВ отрицательнее обратимого (равновесного) потенциала реакции окисления меди до Сu2О.
Таким образом, целесообразно применять величину защитного по-
тенциала E защ = –100 мВ по шкале нормального водородного электрода. Cu
Если использовать хлорсеребряный электрод сравнения, то защитный потенциал относительно его должен иметь значение ~ –300 мВ . При использовании цинкового электрода сравнения, который более практичен и удобен в ра-
106

боте, защитный потенциал должен составлять +540 ÷ +560 мВ , так как установившейся потенциал цинка в водопроводной воде по хлорсеребряному элек-
стац |
= –840 ÷ –860 мВ . |
|
троду сравнения равен EZn |
|
|
|
защ |
полной защиты не будет. Если |
При потенциалах меди положительнее ECu |
||
потенциалы отрицательнее |
защ |
|
ECu , то коррозионные процессы будут подавле- |
||
ны, и вся поверхность будет работать как целый единый катод, на котором пойдет процесс восстановления кислорода по реакции (10.5).
В случае применения протекторной защиты в качестве протектора используют сплавы магния с алюминием, цинком и марганцем (сплавы МЛ-4, МЛ-5, МЛ-6 или МП). Они имеют достаточно высокий коэффициент полезного действия, который достигает 65 %. Около 35 % металла идет на саморастворе-
ние. Растворение магния на протекторе происходит по реакции |
||
|
Mg2 , если |
pH не превысит 10 единиц. |
Mg 2e |
||
Для меди можно использовать катодную защиту с помощью внешнего источника постоянного тока. Защищаемая металлоконструкция подключается к отрицательному полюсу источника тока через амперметр, а положительный полюс соединяют с графитовыми анодами, обернутыми стеклотканью, бельтингом или хлопчатобумажной тканью. На графитовых анодах будет протекать процесс окисления воды с образованием кислорода. Одновременно с
этим будет происходить подкисление прианодного слоя |
|
|||
|
|
|
|
|
H2O 2e 2H |
1/2O2. |
(10.8) |
||
|
||||
Параллельно на катоде (на поверхности меди) |
будет идти процесс |
|||
ионизации кислорода (10,5), сопровождающийся подщелачиванием прикатодного слоя электролита.
То есть суммарный процесс электролиза не приводит к изменению pH среды и ее состав не меняется.
Параметрами электрохимической защиты наиболее часто являются степень защиты, а также катодная поляризация, которая адекватна значению защитного потенциала. Режим защиты определяется прежде всего силой тока (плотностью тока на 1 м2 поверхности) и напряжением, необходимым дл защиты объекта. Оба эти фактора определяют расход электроэнергии за год эксплуатации установки защиты. Важное значение имеет равномерность распределения потенциала по длине защищаемой конструкции. Чем равномернее распределен катодный потенциал, тем надежнее защита от коррозии. Равномерность в свою очередь зависит от мест катодного токоподвода (мест контактирования проводника от отрицательного полюса источника тока с конструкцией) и расположения графитовых анодов количества точек катодного токоподвода.
107

Цель работы:
1. Определение характера распределения потенциала по длине защищаемой конструкции в зависимости от мест катодного токоподвода и мест расположения графитовых анодов и химического состава воды (среды).
2. Определение плотности тока (мА/м2) для обеспечения защитного потенциала на защищаемой конструкции.
3.Нахождение условий наиболее равномерного распределения защитного потенциала на защищаемой конструкции.
4.Определение расхода протектора за год на м2 защищаемой конструкции.
5.Определение расхода электроэнергии за год эксплуатации установки катодной защиты.
(3адания выдаются преподавателем).
Экспериментальная часть
В качестве защищаемой конструкции можно взять стержень (трубку) из любого металла длиной около 100 см (медь, сталь, алюминий или сплавы металлов – по заданию преподавателя), которую помещаем в ванну, представляющую собой длинную узкую емкость, наливаем водопроводную воду или водный раствор электролита.
Для измерения потенциалов вдоль защищаемой металлоконструкции используют 2 изолированных электрода из того же металла (для медной трубы – 2 медных электрода) один из электродов касается поверхности в различных точках, а второй электрод, расположенный максимально близко к поверхности трубки, но не касающийся ее (помещенный в сепаратор), будет электродом сравнения. Поэтому измеряются под током защиты величины поляризации на различных участках поверхности – отклонение потенциала от компромиссного значе-
ния
Eстац
Cu
.
Для определения величин потенциалов поверхности медной трубки относительно потенциала нормального водородного электрода необходимо замерить потенциалы каждого из 2-х измерительных медных электродов и потенциалы на различных участках поверхности трубки в отсутствии внешнего тока относительно стандартного хлорсеребряного электрода сравнения (все они должны быть примерно одинаковыми). Потенциал медной трубки, пересчитанный на шкалу нормального водородного электрода – это компромиссный потенциал коррозии
меди в данном электролите (
Eстац
Cu
на коррозионной диаграмме рис.1).
Из приведенного выше анализа коррозионного процесса для меди в нейтральных растворах (водопроводная вода или водные растворы солей, не содержащие ионов хлора) целесообразно применять величину защитного потен-
108

циала
Eзащ
Cu
=–100
мВ
по водородной шкале.
Порядок работы.
Замерить потенциалы каждого из 2-х измерительных медных электродов и потенциалы на различных участках поверхности трубки в отсутствии внешнего тока относительно стандартного хлорсеребряного электрода сравнения.
Соединить катодный токоподвод от точки дренажа (К) и токоподвод от источника постоянного тока (или протектора) через миллиамперметр. Варианты подсоединения представлены на рис. 2, 4, 6, 8.
Металл (сплав) протектора и катодные плотности тока задаются преподавателем. Сила тока на защищаемую конструкцию рассчитывается по формуле
где
S зк
|
I jкт S зк |
, |
jкт |
– катодная плотность тока, А/м2; |
|
– поверхность, защищаемой конструкции, м2.
(10.9)
Установив постоянный ток, замеряют потенциал защищаемой конструкции в точках, указанных на рис. 2, 4, 6, 8. Значения замеренных потенциалов пересчитывают на шкалу нормального водородного электрода и заносят в табл. 1.
Таблица 1
Величины значения потенциалов по поверхности защищаемой конструкции
Электролит ___________________; Протектор _______________________
|
Точки |
1 |
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Раст., |
5 |
|
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
75 |
80 |
85 |
90 |
95 |
|
|
см |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I , |
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 0 (цепь разомкнута) |
|
|
|
|
|
|
|
||||||
|
мА |
|
Соответствующие значения потенциала ECu относительно н. в. э., мВ |
|
|
|||||||||||||||||
|
|
|
|
|
||||||||||||||||||
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I , |
|
|
|
|
|
|
I= |
(протектор, электролит) |
|
|
|
|
|
|
|
||||||
|
мА |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
109
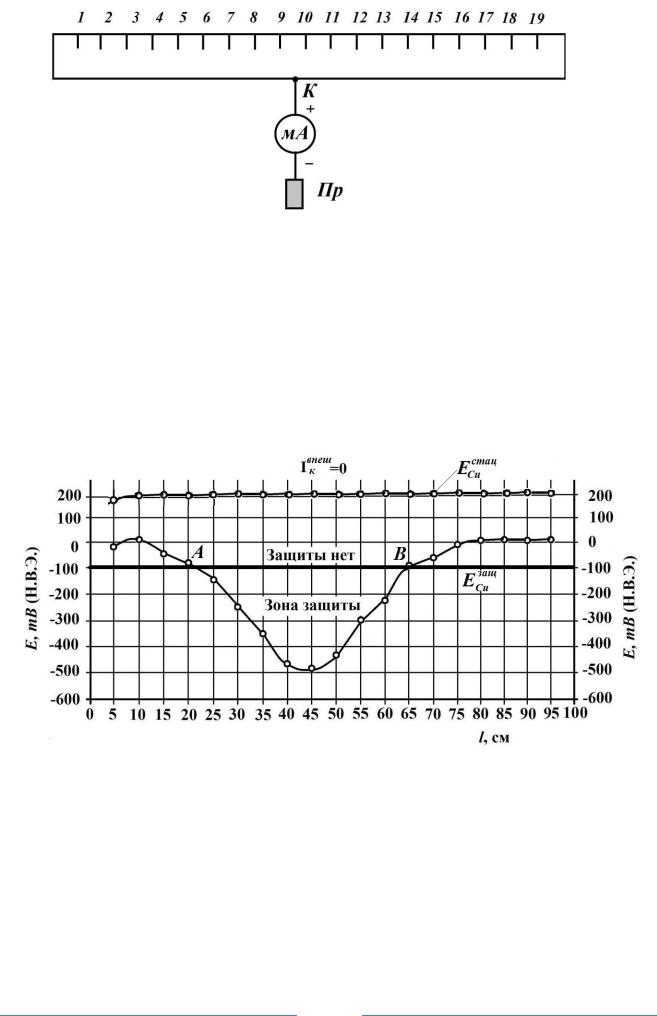
Рис. 2. Схема защиты с помощью протектора
Пр –протектор; К – общий катодный токоподвод ( точка дренажа); мА – миллиамперметр;
Цифрами обозначены точки замера потенциала по поверхности трубки, расстояние между которыми 5 см.
Строят график распределения потенциала на защищаемой конструкции (рис. 3, 5, 7). Замеряется напряжение на внешнем источнике постоянного тока.
Рис. 3. Распределение потенциала по длине трубки при протекторной защите
По данным рис. 3 длина трубки, находящейся под протекторной защитой L= [AB] = 45 см. Радиус действия протекторной защиты равен половине длины отрезка [AB]= 45/2 = 22,5 см.
110
