
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
1. Галогенирование ароматических соединений
Схема и механизм галогенирования аренов
Общая схема реакции может быть представлена следующим образом:
![]()
Иногда вместо галогена используются гипогалогенные кислоты:
![]()
При иодировании используются окислители или хлориод.
В качестве катализаторов процесса галогенирования чаще всего используют кислоты Льюиса (FeCl3 и др.), концентрированную серную кислоту, иод.
Галогенирование аренов протекает как реакция электрофильного замещения атома водорода.
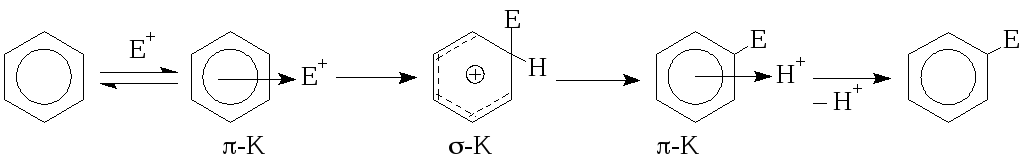
Электрофильными частицами (Е+) обычно являются галоген-катион, поляризованный комплекс галогена с кислотой Льюиса и поляризованная молекула галогена, а в случае гипогалогенных кислот — катион HlgOH2+ или галоген-катион. Их образованию способствуют катализаторы или растворитель.
Механизм образования электрофильных частиц зависит от взятого катализатора и других условий проведения реакции.
1. Катализ кислотами Льюиса. В промышленности чаще всего реакцию проводят в присутствии галогенида железа (III), который, как правило, получают прямо в реакционной массе при добавлении в нее железа.

При хлорировании аренов в этих условиях электрофильной частицей является хлорид-катион. При бромировании (а также и иодировании) в присутствии FeBr3 и других малоактивных кислот Льюиса, образование катиона галогена идет в незначительной степени, а основной атакующей частицей является поляризованный комплекс, например:


Аналогично протекает катализ другими кислотами Льюиса.
2. Катализ серной кислотой:
![]()

3. Катализ иодом:
![]()
При использовании каталитических количеств иода арены хлорируются, так как образуется катион Сl+, а при соотношениях близких к эквимолекулярным образуется I+ и идет иодирование.
4. Каталитическое влияние растворителя. Роль электрофильной частицы может выполнять и поляризованная молекула галогена.
![]()
Степень ее поляризации зависит от полярности растворителя. В связи с этим галогенирование активных субстратов (ароматических аминов, фенолов, полиалкилбензолов типа мезитилена, нафталина, и т. п.) молекулярным хлором и бромом возможно и без катализатора. В воде при комнатной температуре амины и фенолы образуют тригалогенпроизводные.

Однако в неполярном растворителе при низкой температуре (–70 °С) даже при избытке галогена получаются лишь монозамещенные фенолы. Бромирование фенолов в этом случае идет исключительно в о-положение. Для получения монозамещенных первичных аминов их предварительно ацилируют по аминогруппе.

Влияние основных технологических факторов на процесс галогенирования аренов
Направление и скорость реакции, а также выход целевого продукта зависят от строения субстрата, природы галогена, правильного выбора катализатора, а также от кислотности среды, растворителя, температуры и концентрации реагентов.
Как и в других реакциях электрофильного замещения на направление и скорость реакции галогенирования большое влияние оказывает строение субстрата. Электронодонорные заместители в ароматическом кольце (заместители I рода, исключая галогены) стабилизируют -комплекс, ускоряют процесс и направляют галоген в орто- и пара-положение, электроноакцепторные — дестабилизируют -комплекс, замедляют процесс и направляют галоген в мета-положение (исключением являются галогены — орто- и пара-ориентанты).
Влияние заместителей в субстрате на скорость галогенирования проявляется сильнее, чем в других реакциях электрофильного замещения в аренах. Ниже приведены относительные скорости бромирования аренов формулы PhZ:
|
Z= |
OH |
> |
OCH3 |
> |
NHAc |
> |
CH3 |
> |
H |
> |
Cl |
> |
NO2 |
|
|
1011 |
|
109 |
|
108 |
|
102 |
|
1 |
|
0,1 |
|
10–6 |
При проведении галогенирования необходимо учитывать кислотность среды. В сильно кислой среде гидрокси- и аминогруппы, а также пиридиновый азот в гетероциклах протонируются, скорость реакции резко уменьшается, а замещение может пойти и в мета-положение, наоборот в щелочной среде активность фенола возрастает на несколько порядков:

Активность электрофильной частицы в большой степени зависит от природы галогена и катализатора.
Природа галогена настолько сильно влияет на скорость реакции, что практическое значение имеют в основном реакции хлорирования и бромирования аренов.
Прямое фторирование не используется вследствие очень высокой экзотермичности процесса. Наоборот, иодирование идет медленно и требует активации. Кроме этого эта реакция обратимая, поэтому ее часто проводят в присутствии окислителей, которые реагируют с иодоводородом и смещают равновесие в сторону образования продукта. Возможно, они окисляют также молекулярный иод до I+, увеличивая его электрофильность и скорость реакции:
![]()
![]()
Удачный подбор катализатора может обеспечить не только высокую скорость, но и селективность процесса. Наоборот отсутствие его приводит к изменению механизма реакции. Так, например, при бромировании хлорбензола в присутствии хлорида алюминия или ацетата таллия (III) получается почти исключительно пара-изомер:

При хлорировании хлорбензола в газовой фазе без катализатора при температуре 450—600 °С образуется преимущественно мета-изомер.
Растворитель влияет на скорость реакции, не только активируя галоген, но и сольватируя субстрат и промежуточные соединения. Согласно теории Хьюза-Ингольда, полярные растворители ускоряют реакции, в которых -комплекс поляризован больше, чем реагенты (бромирование фенола в воде), а неполярные или малополярные — реакции, в которых, наоборот, -комплекс менее поляризован, чем исходные реагенты (хлорирование бензола в присутствии катализатора).


Следует учитывать также чисто технологические соображения (токсичность, взрыво-, пожароопасность, агрессивность и т.д.). Так, наличие воды в реакционной массе при галогенировании аренов приводит к образованию соответствующей галогеноводородной кислоты, которая вызывает коррозию оборудования.
Чем выше концентрация реагирующих веществ, тем быстрее идет реакция. Однако в промышленных процессах, как правило, один из реагентов взят в избытке, поэтому от изменения его концентрации скорость реакции не зависит. Необходимо помнить также, что даже в кинетической области реакции галогенирования могут иметь первый, второй и даже третий порядок в зависимости от того, какая стадия процесса является лимитирующей (образование электрофильных частиц, образование -комплекса, и др.). Например, скорость галогенирования аренов гипогалогенными кислотами пропорциональна кислотности среды (первый порядок), которая отвечает за концентрацию электрофильных частиц.
Температура галогенирования арена, как и в других процессах, сильно влияет на скорость реакции. Повышение температуры на 10 °С увеличивает скорость реакции в 2—3 раза (температурный коэффициент 2—3). Даже незначительное повышение температуры может существенно ускорить реакцию и привести к полигалогенированию. Поэтому галогенирование производных бензола ведут при невысоких температурах (20—80 °С и ниже). Резкое изменение температуры может привести к изменению направления реакции.

В этой связи выбор температуры галогенирования в большинстве случаев зависит от строения субстрата, природы галогена, а также от задач реакции, поэтому она может быть самой разной (от –70 до 300 °С).
Реакция хлорирования в ядро, как правило, протекает быстро и с выделением большого количества тепла (–Н298 = 120 кДж/моль), поэтому в большинстве случаев реакционную массу охлаждают. Тепловой эффект бромирования значительно меньше, в этих случаях ее подогревают. Эндотермическая реакция иодирования всегда идет при нагревании. Таким образом, для достижения желаемого результата реакционную массу охлаждают или нагревают, строго выдерживая заданную температуру процесса.
