
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
4. Алкилирование по атому азота (n-алкилирование)
В качестве алкилирующих агентов используют алкил- и арилгалогениды, непредельные соединения, спирты, эфиры, эпоксисоединения, диалкилсульфаты, эфиры аренсульфокислот. Поэтому чаще всего N-алкилирование (арилирование) можно рассматривать как реакции нуклеофильного замещения (SN2, SNAr и др.) или нуклеофильного присоединения (AN). Особенности рассматриваемого процесса в большой степени зависят от используемого реагента.
Алкилирование аминов галогенидами идет по схеме:
![]()
Процесс сопровождается выделением галогеноводорода, который образует аммониевые соли и затрудняет реакцию, поэтому в реакционную массу добавляют вещества, связывающие кислоту. Ими могут быть сам амин, карбонаты натрия, калия, кальция или щелочь. Например, при получении N-бензиланилина (производство диазолина) для этих целей используют гидрокарбонат натрия:

Повышение нуклеофильности субстрата (амина, амида) существенно влияет на скорость реакции алкилирования. В данном случае активность субстрата, также, как и его pKa, увеличивается от сульфамида до третичного амина:
–SO2NH2 < –CONH2 < ArNH2 < C5H5N < NH3 < RNH2 < R2NH < R3N
Алифатические амины и аммиак алкилируются легко, но процесс сопровождается полиалкилированием, что объясняется образованием более активного нуклеофила, чем исходный амин (см. главу 3 «Замена атома галогена на аминогруппы»):

Тем не менее, реакцию широко используют в химико-фармацевтической промышленности, т.к. многие лекарственные препараты выпускаются в виде четвертичных аммонийных солей:

Алкилирование ароматических аминов идет труднее, чем алкиламинов, но селективнее. Это объясняется тем, что нуклеофильность их в большей степени зависит от заместителей в ядре, чем от заместителей, находящихся у атома азота. Так, п-толуидин более нуклеофилен, чем вторичный амин N-метиланилин:
![]()
Активность вторичного жирноароматического амина выше, чем ариламина, но не настолько, как в алифатическом ряду. Поэтому используя низкие температуры, избыток субстрата и другие приемы, можно получать смешанные аминосоединения с высоким выходом:
![]()
Амиды карбоновых и сульфоновых кислот, нуклеофильность которых очень низкая, алкилируются намного труднее, чем амины, но зато селективно, что позволяет синтезировать чистые первичные и вторичные амины (см. главу 3, «Замена атома галогена на аминогруппы»).
Алкилирующий агент также влияет на скорость реакции. Быстрее всего реагируют аллильные, бензильные, метильные и первичные галогениды (см. механизм SN2).
Как правило, алкилгалогенид является более простой молекулой, но в ряде случаев он является структурной основой лекарственного вещества, например, в производстве тримекаина:

При использовании полигалогенида можно избирательно заместить более хорошо уходящий или более активный галоген:

Ниже приведены примеры замещения более активного галогена:

Условия реакции зависят от строения и свойств, как субстрата, так и галогенида. Так, при взаимодействии алкилгалогенидов с аминами температура реакции обычно до 100 °С. Активированные арилгалогениды в процессах арилирования реагируют с аминами примерно при 150 °С. В большинстве случаев реакцию можно вести при атмосферном давлении в аппарате с обратным холодильником.
Однако при работе с низкокипящими веществами, такими, как метил- и этилхлориды (CH3Cl, C2H5Cl), которые значительно дешевле соответствующих бромидов и иодидов, алкилирование ведут в автоклавах, что является основным недостатком этого метода.
![]()
N-Алкилирование галогеноспиртами и эпоксисоединениями применяется в синтезе противоопухолевых препаратов. Для введения этанольного остатка в аминогруппу используют водный раствор этиленхлоргидрина:
![]()
![]()

Однако наряду с N-алкилированием идет и О-алкилирование.
Поэтому вместо этиленхлоргидрина часто используют окись этилена. Температура алкилирования обычно ниже 100 °С:

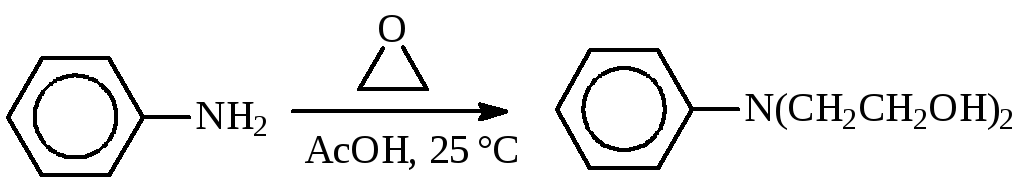
Смесь окиси этилена с воздухом взрывается, поэтому алкилирование ведут при полном отсутствии воздуха, что достигается продувкой аппарата азотом.
Диметилсульфат широко применяется для N-алкилирования:

Механизм реакции SN2. В мягких условиях (водный раствор, низкая температура) используется лишь одна метильная группа диметилсульфата. Для полного использования диметилсульфата необходимо проводить алкилирование при температуре около 100 °С в щелочной среде.
К достоинствам диметилсульфата можно отнести высокую реакционную способность, относительную дешевизну и возможность проводить метилирование органических соединений, используя повышенные температуры при атмосферном давлении (для сравнения, температура кипения метилиодида ниже 40 °С). Серьезным недостатком диметилсульфата является его высокая токсичность.
Метиловые эфиры аренсульфокислот имеют достоинства диметилсульфата, но менее токсичны, поэтому их использование в качестве N-метилирующего средства в ряде случаев является более рациональным. Обычно процесс ведут начиная при 25—26 °С и заканчивая при 70 °С:

Непредельные соединения также нередко используются в качестве алкилирующего агента в синтезе лекарственных соединений. Механизм реакции обычно рассматривают как нуклеофильное присоединение (AN) по -связи:
![]()
При получении диазолина используется активный метилакрилат, что позволяет при необходимости ввести в молекулу амина сразу два радикала:
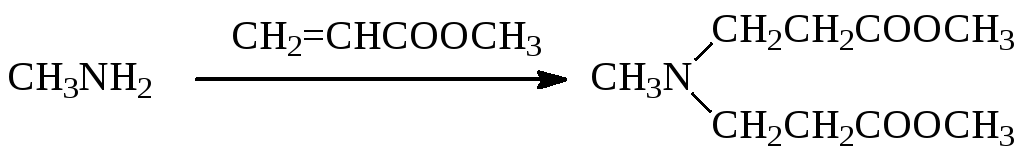
Даже слабые нуклеофилы — амиды карбоновых кислот — алкилируются непредельными соединениями:
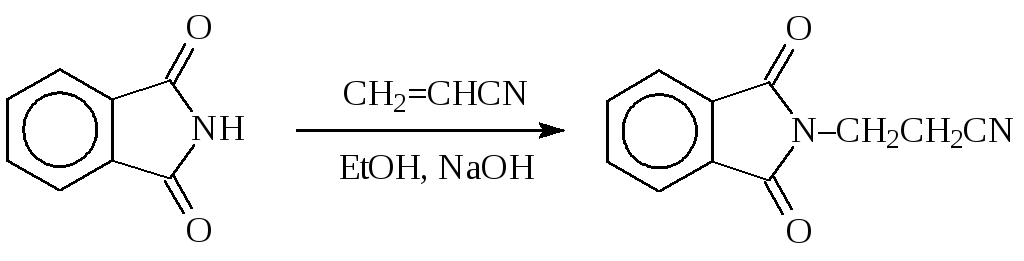
Спирты в качестве N-алкилирующих агентов обычно используют в реакциях с ароматическими аминами.
В жидкой фазе процесс проводят в присутствии минеральных кислот в автоклавах под давлением выше 3 МПа, температуре 180—220 °С и в течение до 10 часов.
Так получают диметиланилин из анилина, метилового спирта и серной кислоты (при использовании метилиодида — 125 °С, 1 МПа, 10 час).

Каталитическая роль кислоты заключается в протонировании спирта и образовании хорошо уходящей группы. Вода либо вытесняется нуклеофилом (SN2-механизм), либо отщепляется, образуя карбокатион, который реагирует с ароматическим амином (SN1-механизм):

Природа минеральной кислоты заметно влияет на скорость протекания реакции. Однако чаще всего используют более дешевые серную и соляную кислоты.
В паровой фазе алкилирование ароматических аминов спиртами проводят при температуре 300—400 °С в присутствии окиси алюминия в качестве катализатора.
N-Алкилирование простыми эфирами осуществляют в газовой фазе при температуре 250—350 °С. Смесь паров амина и эфира пропускают через слой катализатора (Al2O3, ThO2, TiO2, ZrO2).
Практический интерес представляет реакция анилина с метиловым эфиром, который является побочным продуктом в производстве метилового спирта:
![]()
5. О-Алкилирование (получение простых эфиров)
В качестве алкилирующих агентов гидроксигруппы могут быть использованы алкил(арил)галогениды, непредельные соединения, спирты, эфиры серной и сульфокислот.
Алкил(арил)галогениды широко применяются для О-алкилирования (арилирования). При этом используется реакция Вильямсона или реакция гидроксисоединений с галогенидами в присутствии щелочей:
![]()
![]()
Большой интерес представляют доступные и дешевые метил- и этилхлориды. Алкилирование ими ведут в автоклавах под давлением, поскольку эти вещества имеют низкую температуру кипения.
Так, метилирование гидрохинона проходит при нагревании водного раствора его натриевой соли с хлористым метилом при температуре 100 °С и давлении 2 МПа:

Галогениды часто бывают сложными соединениями, а в ряде случаев их структура сложнее гидроксисоединения.
Примеры О-алкилирования (арилирования):
-
Алкилирование фенола 1,2-дибромэтаном проводят в водно-щелочной среде при кипении реакционной массы:
![]()
-
Бензгидрол алкилируют β-диметиламиноэтилхлоридом при 80 °С в щелочной среде:

-
п-Хлорфеноксиуксусную кислоту синтезируют из п-хлорфенола и хлоруксусной кислотой в щелочной среде:

О-Алкилирование используют для временной защиты гидроксильных групп их тритилированием — образованием трифенилметиловых (тритильных) эфиров. Чаще всего он применяется в синтезе сахаров, нуклеозидов и глицеридов.
Тритилгалогенид очень объемистая молекула и реагирует, в основном, с первичными спиртами. Реакцию проводят, нагревая спирт с рассчитанным количеством тритилхлорида в пиридине. С первичными спиртами она завершается за 1 час при 100 °С.
Тритиловые эфиры устойчивы к действию щелочей и других нуклеофильных агентов, но гидролизуются в кислой среде. «Снимают» тритильную защиту, как правило, кипячением в 80 %-ой уксусной кислоте.

Таким образом, например, можно защитить первичные гидроксилы глицерина получив моно- и дитритиловые эфиры
Непредельные соединения для О-алкилирования используются реже. Так, при получении β-этоксипропионитрила используют акрилонитрил:
![]()
![]()
О-Алкилирование спиртами в присутствии минеральной кислоты используется довольно редко и применяется, главным образом, для получения симметричных диалкиловых эфиров и алкоксипроизводных нафталинового и антраценового ряда.

О-Алкилирование эфирами серной кислоты и ароматических сульфокислот имеет значительно большее значение.
Реакция метилирования спиртов и фенолов диметилсульфатом в щелочной среде, также как и в случае аминов, протекает в две стадии. Щелочь повышает нуклеофильность субстрата и нейтрализует выделяющуюся кислоту:
![]()
![]()
Первая стадия идет легко при температуре ниже 50 °С, вторая —примерно при 100 °С) и часто проводится под небольшим давлением.
При метилировании фенолов при 100 °С метильные группы диметилсульфата используются примерно на 90 %:

Метилирование пирокатехина, одно- и многоатомные спирты диметилсульфатом проводят в водном растворе NaOH при 18—20 °С с последующей выдержкой при 90—92 °С:

Недостатком метода является токсичность диметилсульфата и неполное использование метильных групп.
Алкилирование фенолов эфирами ароматических сульфокислот протекает гладко при кипячении смеси фенолята и соответствующего эфира аренсульфокислоты. В качестве растворителя используют полихлорбензол:
![]()
