
- •Направление подготовки - 240100.62 «Химическая технология»
- •Атом углерода, его особенности, валентные состояния
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •Мезомерный эффект – используется для характеристики электронного облака π –связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью концентрированной азотной кислоты с уксусным ангидридом
- •7. Нитрование разбавленной азотной кислотой
- •Глава 3. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизмах реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы (синтез простых эфиров)
- •Замена атома галогена на меркапто и алкил(арил)тиогруппы (синтез тиоспиртов и тиоэфиров)
- •Замена атома галогена на аминогруппы (синтез аминов)
- •Замена атома галогена на цианогруппу (синтез нитрилов кислот)
- •Замена атома галогена на группу -so3Na (синтез сульфокислот)
- •Замена атома галогена на группу –no2 (синтез нитросоединений)
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •Глава 5. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором (непрероывный метод)
- •2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
1. Окисление растворов бромида натрия хлором (непрероывный метод)
![]()
Выделяющийся бромистый водород поглощается раствором гидроксида натрия. Сюда же присоединяют бромные воды, образующиеся после отделения и промывки водой растворов целевых продуктов. Водные растворы солей брома подкисляют, нагревают (теплообменник 2, рис. 5) и подают сверху в насадочную колонну (3). В нижнюю часть колонны поступает газообразный хлор и острый пар.
Отогнанные пары воды, брома и не прореагировавший хлор поступают в холодильник (4), где пары воды и брома конденсируются и самотеком стекают в водоотделитель (5). После отделения воды бром через гидрозатвор сливают в сборник и возвращают на бромирование. Хлор из водоотделителя направляют в скруббер и поглощают раствором едкого натра. Для дополнительной очистки бром перегоняют на ректификационной колонне. Выход брома составляет 80—85 %.
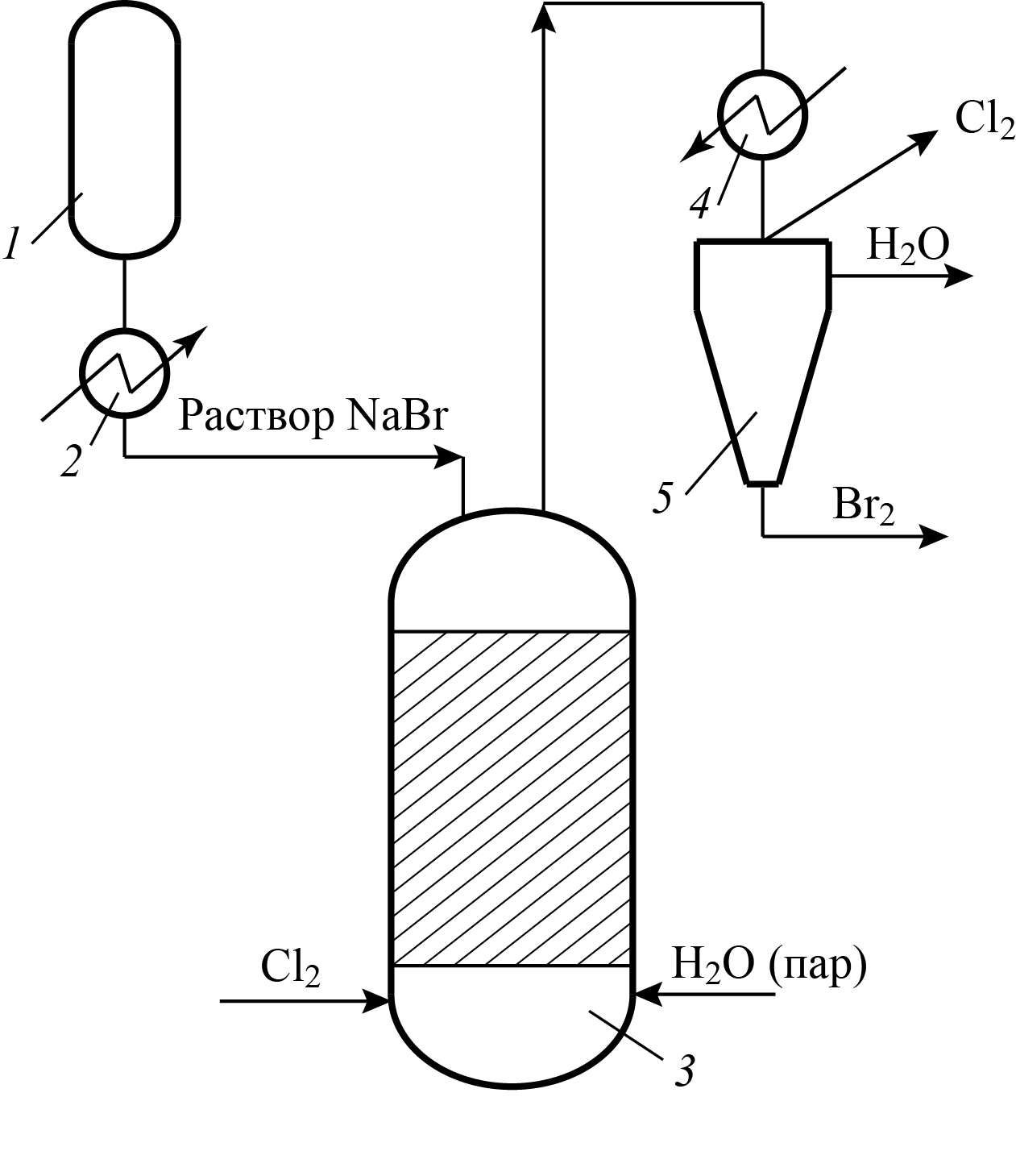
Рис. 5. Аппаратурная схема регенерации брома
1 — сборник, 2,4 — теплообменники, 3 — колонна, 5 — сепаратор
2. Окисление растворов бромида натрия гипохлоритом натрия (периодический):
![]()
Растворы NaBr загружают в реактор, из кислотоупорной стали, подкисляют соляной кислотой, нагревают, и приливают раствор гипохлорита натрия. Затем бром отгоняют в сборник. Преимущества метода — простота аппаратурного оформления, меньшая опасность при работе.
Иодирование ароматических соединений
Иодирование ароматических соединений ведут растворами иода (обычно в органических растворителях), при нагревании в присутствии окислителей (азотной кислоты, серного ангидрида и др.):
![]()

В связи с трудностью прямого иодирования в химико-фармацевтической промышленности в реакциях с активными аренами широко применяют хлорид иода. Обычно используют комплекс IСl.KCl, который получают из газообразного хлора и водного раствора иодистого калия:
![]()
Иодирование проводят в водной среде при умеренном нагревании и избытке иодирующего агента (до 50 %). Продукты реакции отделяют фильтрованием.
Регенерация иода включает: получение и выделение из отходов производства иодида натрия, который окисляют до чистого иода.

Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
-
Бромирование и хлорирование толуола. Бромирование ведут при 20 °С:

-
Бромирование о-ксилола в присутствии железа, активированного иодом, можно вести при температуре от 0 до 40 °С без изменения соотношения моно- и дибромзамещенного. В СПХФА предложен более технологичный метод бромирования стехиометрическим количеством брома в присутствии воды без катализатора. Выход в обоих случаях до 90 %:

-
Бромирование мезитилена можно вести без катализатора, однако надо учитывать, что даже в присутствии железа частично бромируются метильные группы и выход ~ 40 %:

-
Иодирование аминобензойных кислот хлоридом иода или его комплексом с хлоридом калия (синтезы рентгеноконтрастных препаратов билигност, триомбраст и др.). Реакцию обычно проводят в воде в присутствии кислоты при нагревании:

2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
Молекулярный галоген реагирует с алканами и алкиларенами по следующей схеме:
![]()
Механизм галогенирования является радикальным цепным процессом (SR), который инициируется как термически, так и облучением светом:
![]()
![]()
![]()
Реакция начинается с образования радикалов галогена. Отщепление водорода процесс эндотермический. В результате второй стадии (экзотермической) образуется алкилгалогенид и регенерируется радикал галогена. При хлорировании кинетические цепи значительно длиннее (до 104), чем при бромировании.
Тепловой эффект реакций фторирования, хлорирования, бромирования и иодирования алканов соответственно около 460, 105, 32, –50 кДж/моль. Поэтому прямое фторирование технически трудноосуществимо, хлорирование требует организации отвода тепла реакции, бромирование — подогрева реакционной массы, а иодирование алканов иодом не идет, даже при специальном инициировании реакции.
Реакционная способность исходных веществ и направление реакции гомолитического галогенирования определяется стабильностью радикалов, образующихся в процессе реакции (т. е. строением субстрата). Стабильность радикалов уменьшается в ряду бензильный, аллильный >> третичный > вторичный > первичный > метильный > винильный, фенильный:

Устойчивость радикалов зависит от делокализации свободного электрона, которая более всего выражена в бензильном (аллильном) радикале. Поэтому при галогенировании в первую очередь замещается бензильный (аллильный) атом водорода, затем — третичный, вторичный, первичный и, в последнюю очередь — винильный (фенильный).
Наибольшая селективность реакции проявляется при бромировании, наименьшая — при фторировании. С ростом температуры селективность процесса падает.
Недостатком радикально-цепного галогенирования являются низкая селективность процесса и полигалогенирование. Для получения моногалогеналканов процесс приходится вести в избытке углеводорода при малой степени превращения.
