
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
2.6. Уравнение изотермы химической реакции. Химическое сродство
Направление самопроизвольного протекания химической реакции определяется убылью соответствующего термодинамического потенциала, а глубина протекания абсолютной величиной этой убыли, т.е. максимальной полезной работой.
Преобразуем уравнение (107)
![]() (107)
(107)
к виду:
![]() .
.
Заменим дифференциалы частными приращениями:
![]() .
.
Получим уравнение
для стандартного изменения
![]() ,
когда
,
когда
![]() .
Выразив химический потенциал компонента
через его парциальное давление
,
для реакции (106) запишем:
.
Выразив химический потенциал компонента
через его парциальное давление
,
для реакции (106) запишем:
![]() .
.
После преобразований получим:
 ,
(115)
,
(115)
где – исходные (или неравновесные) парциальные давления реагирующих веществ.
Так как при
:
![]() ,
то
,
то
 .
(116)
.
(116)
Аналогично для
реакции, протекающей при
![]() ,
,
![]() ,
получим:
,
получим:
 ;
(117)
;
(117)
 ,
(118)
,
(118)
где
![]() – исходные (или неравновесные) концентрации
реагирующих веществ.
– исходные (или неравновесные) концентрации
реагирующих веществ.
Уравнения (115, 117) – называют уравнениями изотермы химической реакции (изотермы Вант–Гоффа), а (116, 118) – уравнениями максимальной работы химической реакции.
Абсолютные значения
изменения термодинамических потенциалов
показывают, насколько далека система
от состояния химического равновесия.
Чем меньше
,
тем ближе система к состоянию равновесия.
В предельном случае когда
![]() – в системе химическое равновесие.
Поэтому величины
,
– в системе химическое равновесие.
Поэтому величины
,
![]() или максимальную работу процесса
называют мерой химического
сродства.
или максимальную работу процесса
называют мерой химического
сродства.
На основе уравнения изотермы химической реакции можно рассчитать максимальную работу и предсказать направление самопроизвольного протекания химической реакции. Напомним, что если
![]() ,
,
![]() ,
то
процесс протекает самопроизвольно в
сторону образования продуктов реакции;
,
то
процесс протекает самопроизвольно в
сторону образования продуктов реакции;
![]() ,
,
![]() ,
то
процесс протекает в сторону образования
исходных веществ;
,
то
процесс протекает в сторону образования
исходных веществ;
,
![]() ,
то
система находится в состоянии равновесия.
,
то
система находится в состоянии равновесия.
Для сравнительной
оценки химического сродства различных
химических реакция определяют стандартную
энергию Гиббса
![]() (энергию Гельмгольца
(энергию Гельмгольца
![]() )
или стандартное
химическое сродство
– химическое сродство реакции, протекающей
в стандартных условиях (при парциальных
давлениях реагирующих веществ
= 1):
)
или стандартное
химическое сродство
– химическое сродство реакции, протекающей
в стандартных условиях (при парциальных
давлениях реагирующих веществ
= 1):
![]() .
(119)
.
(119)
Аналогично для реакции, протекающей при :
![]() .
(120)
.
(120)
Для идеальных
растворов в уравнении изотермы химической
реакции константу равновесия выражают
с помощью мольных долей (
).
Для реальной газовой смеси – с помощью
фугитивностей (![]() )
(уравнение 121), а для реальных растворов
– с помощью термодинамических активностей
(
)
(уравнение 121), а для реальных растворов
– с помощью термодинамических активностей
(![]() )
(122).
)
(122).
 ,
(121)
,
(121)
 .
(122).
.
(122).
2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
В качественной форме смещение равновесия описывается принципом Ле-Шателье: если на систему, находящуюся в устойчивом равновесии оказать внешнее воздействие, то равновесие сместится в направлении процесса, течение которого ослабляет влияние произведенного воздействия.
Пусть химическая реакция (106) протекает в идеальной газовой фазе. Тогда при стандартная максимальная работа химической реакции:
![]() .
(119)
.
(119)
Максимальная работа процесса в соответствии с уравнением Гиббса–Гельмгольца:
![]() .
(85)
.
(85)
Продифференцируем уравнение (119) по температуре:
![]() .
(123)
.
(123)
Подставим в
уравнение (85) вместо
![]() и
и
![]() их значения из (119) и (123), получим:
их значения из (119) и (123), получим:
![]() .
.
Преобразуем:
![]() .
(124)
.
(124)
Аналогично при :
![]() .
(125)
.
(125)
Уравнения (124) и (125) называют уравнениями изобары и изохоры химической реакции. Они характеризуют влияние температуры на константу химического равновесия.
Уравнения изобары
и изохоры позволяют спрогнозировать
изменение константы химического
равновесия при изменении температуры.
Знак производной, стоящей в левой части
уравнений, а, следовательно, и направление
изменения
![]() при изменении
определяется знаком теплового эффекта
химической реакции. Если:
при изменении
определяется знаком теплового эффекта
химической реакции. Если:
![]() – для эндотермической
реакции константа химического равновесия
возрастает с увеличением температуры.
Химическое равновесие смещается в
сторону увеличения выхода продуктов
реакции (
);
– для эндотермической
реакции константа химического равновесия
возрастает с увеличением температуры.
Химическое равновесие смещается в
сторону увеличения выхода продуктов
реакции (
);
![]() – для экзотермической
реакции
убывает с увеличением температуры.
Химическое равновесие смещается в
сторону уменьшения выхода продуктов
реакции (
);
– для экзотермической
реакции
убывает с увеличением температуры.
Химическое равновесие смещается в
сторону уменьшения выхода продуктов
реакции (
);
![]() – температура не
влияет на
.
– температура не
влияет на
.
Разделим переменные в уравнении изобары
![]() .
(126)
.
(126)
1.
Проинтегрируем в небольшом температурном
интервале, считая, что
![]() не зависит от температуры:
не зависит от температуры:
![]()
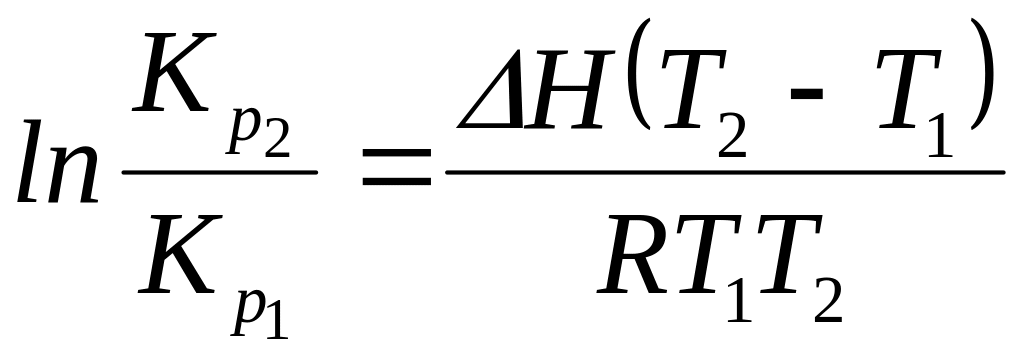 .
(127)
.
(127)
Применяя уравнение
(127), можно рассчитать средний тепловой
эффект реакции
,
если известны значения констант
равновесия в узком интервале температур
или рассчитать
![]() ,
если известно
,
если известно
![]() и средняя величина теплового эффекта
реакции в интервале температур от
и средняя величина теплового эффекта
реакции в интервале температур от
![]() до
до
![]() .
.
ЛЕКЦИЯ 8
2. Проинтегрируем уравнение изобары (126) в неопределенных пределах (от абсолютного 0 до ) с учетом температурной зависимости :
![]() .
.
где
![]() – тепловой эффект реакции при абсолютном
нуле температур.
– тепловой эффект реакции при абсолютном
нуле температур.
 .
.
В результате получим:
 ,
(128)
,
(128)
где
![]() – константа интегрирования.
– константа интегрирования.
Для расчета константы равновесия необходимо определить численное значение . Для конденсированных систем в области температур, прилегающих к абсолютному нулю, эта задача была решена на основе тепловой теоремы Нернста.
Конденсированными называют системы, не изменяющие своего агрегатного состояния при охлаждении до абсолютного нуля (кристаллические вещества).
С помощью III закона термодинамики можно показать, что для реакций, протекающих в конденсированных системах константа интегрирования в уравнении (128) равна нулю. Тогда
 .
.
Для реакций,
протекающих в идеальной газовой фазе
![]() .
На основе тепловой теоремы Нернста–Планка
получено следующее уравнение для
константы интегрирования:
.
На основе тепловой теоремы Нернста–Планка
получено следующее уравнение для
константы интегрирования:
![]() ,
,
где
![]() – химическая постоянная вещества;
– химическая постоянная вещества;
![]() – стехиометрический
коэффициент.
– стехиометрический
коэффициент.
Суммирование проводится по всем газообразным веществам, принимающим участие в реакции.
Например:
![]() ;
;
![]() .
.
Тогда для газообразных систем уравнение для константы равновесия имеет вид:
 .
.
