
- •Общие указания
- •Глава 1
- •1.1. Органические топлива
- •1.1.1. Состав топлив
- •1.1.2. Характеристики топлив
- •1.1.3. Разновидности горения
- •1.1.4. Основные стадии гетерогенного горения
- •1.1.5. Фазы горения
- •1.1.6. Скорость горения
- •1.2. Расчет процессов горения
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Глава 2
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики
- •2.4. Свойства рv – и Тs – диаграмм
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •2.6. Термодинамические циклы
- •Глава 3
- •3. Реальные газы
- •3.1. Отличия реальных газов от идеальных
- •3.2. Устройство pv – диаграммы реального газа
- •3.3. Области pv- диаграммы
- •3.4. Таблицы водяного пара
- •3.5. Определение параметров влажного насыщенного пара
- •3.6. Диаграммы водяного пара
- •3.7. Расчет процессов изменения состояния реального газа (водяного пара)
- •Изохорный процесс ( )
- •Изобарный процесс ( )
- •Изотермический процесс ( )
- •3.9. Паросиловые установки
- •Глава 4 конвективный теплообмен
- •4.1. Математическая формулировка задачи конвективного теплообмена
- •4.2. Краевые условия при решении задач конвективного теплообмена (условия однозначности)
- •4.3. Решение задач конвективного теплообмена на основе теории подобия
- •4.4. Приведение системы дифференциальных уравнений к безразмерному виду
- •4.5. Теоремы подобия
- •4.6. Физический смысл критериев гидромеханического и теплового подобия
- •4.7. Критериальные уравнения конвективного теплообмена
- •4.8. Методика решения задач конвективного теплообмена на основе теории подобия
- •4.9. Выбор определяющих размеров и величин
- •Семестровая работа №1 топливо, газовые смеси и теплоемкость
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •Исходные данные
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №2 термодинамические процессы и циклы с газообразным рабочим телом
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •I. Расчет термодинамических процессов, составляющих цикл
- •II. Расчет прямого цикла 1-2-3-4-5-1
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №3 термодинамические процессы водяного пара
- •Указания к выполнению семестровой работы
- •Исходные данные
- •Методика расчета семестровой работы
- •1. Расчет адиабатного процесса 1-2
- •2. Расчет изобарного процесса 2-3
- •3. Расчет процесса 3-4
- •4. Расчет изобарного процесса 4-5
- •5. Расчет изобарного процесса 5-6
- •6. Расчет изобарного процесса 6-1
- •7. Расчет цикла
- •Контрольные вопросы
- •Основная литература
- •Семестровая работа №4 конвективный теплообмен и интенсификация теплопередачи
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы № 4
- •1. Определяем коэффициент теплоотдачи
- •2. Определяем коэффициент теплоотдачи
- •3.Определяем термические сопротивления
- •4. Определяем коэффициент теплопередачи
- •5. Вычисляем плотность теплового потока
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Приложения
- •Свойства горючих
- •Формулы средних (в интервале 0...Т, к) изохорных массовых
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Физические параметры воды на линии насыщения при давлении 101325 Па (760 мм.Рт.Ст.)
- •Физические параметры сухого воздуха при давлении
- •Оглавление
1.2. Расчет процессов горения
Основные цели расчета процесса горения сводятся к определению следующих величин:
определение потребного количества окислителя для полного сжигания 1кг горючего;
определение количества и состава продуктов сгорания;
определение температуры конца сгорания продуктов сгорания;
определение теплосодержания (энтальпии) продуктов сгорания.
1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
Расчет ведут обычно на 1 кг рабочей массы сжигаемого топлива. В основу положены уравнения баланса, использование которых можно понять на примере окисления горючих элементов, входящих в состав рабочей массы топлива.
Рассмотрим стехиометрические реакции окисления горючих веществ, входящих в состав горючего.
Окисление водорода рабочей массы топлива:
2H2 + O2 = 2H2O (1.1)
4кг H2 +32кг O2 = 36кгH2O
1кг H2+ 8кг O2 = 9кгH2O
Из
этого уравнения следует, что каждый
килограмм сжигаемого водорода требует
8 кг кислорода, при этом образуется 9 кг
воды. Если в рабочей массе сжигаемого
топлива содержится Hp
% водорода, то для окисления водорода,
входящего в 1 кг такого топлива, необходимо
иметь массу кислорода (в кг), равную
![]() .
.
Аналогично можно определить потребное количество кислорода для окисления углерода и серы:
С + O2 = СO2 (1.2)
12кг С + 32кг O2 = 44кг СО2
1кг С + 8/3кгO2 = 11/3кгСО2
S + O2 = SO2 (1.3)
32кг S + 32кгO2 = 64кг SО2
1кг S + 1кг O2 = 2кг SО2
Если вычесть уже содержащийся в топливе кислород, то его потребность (в кг) на каждый килограмм сжигаемого топлива выразится соотношением:
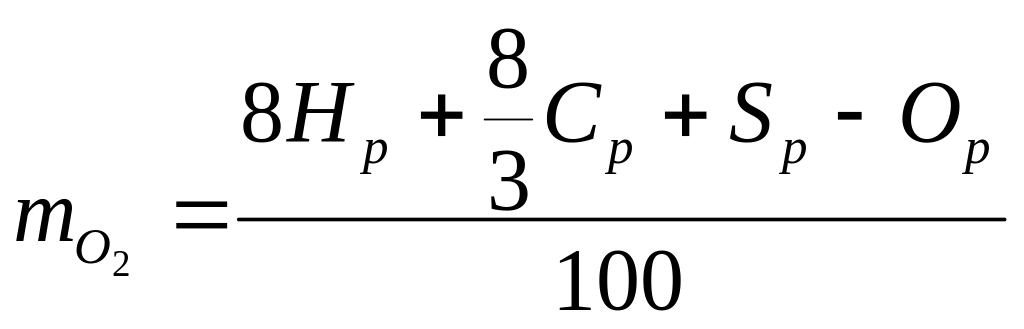 кгкислорода/кгтоплива.
кгкислорода/кгтоплива.
В этом соотношении сумма величин, стоящих в числителе, показывает потребное количество кислорода, необходимое для полного окисления рабочей массы горючих элементов топлива. Рабочая масса кислорода Ор горючего входит в состав горючего в виде соединений и участвует в реакции окисления, поэтому она вычитается.
1.2.2. Определение массы воздуха для сжигания 1кг топлива
Массовая доля кислорода в воздухе составляет 0,23. Поэтому количество воздуха, теоретически необходимое для сжигания 1 кг топлива, будет равно
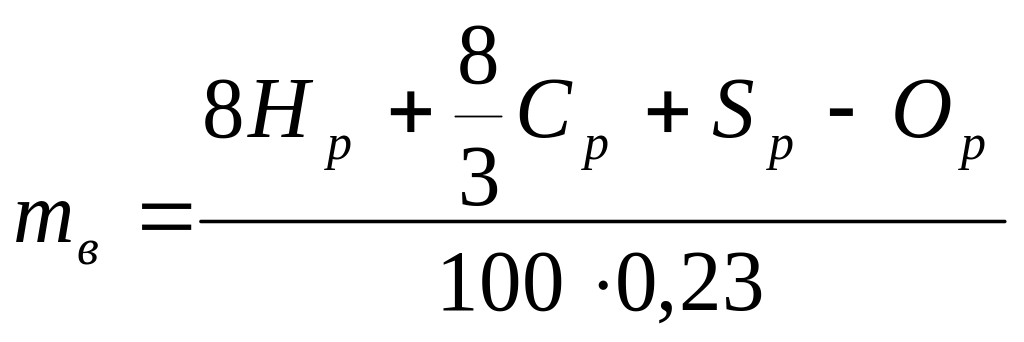 ,
кгвоздуха/кгтоплива.
,
кгвоздуха/кгтоплива.
1.2.3. Коэффициент избытка воздуха
В действительности подаваемое количество воздуха отличается от теоретически необходимого. Из-за несовершенства процессов смесеобразования в энергетических установках, где стремятся максимально полно использовать энергию топлива, приходится подавать воздух в количествах, превышающих теоретически необходимое. В печах безокислительного нагрева металла, чтобы поддержать восстановительную атмосферу печи, воздуха подают меньше, то есть сознательно идут на недожег топлива.
Отношение
действительно поданного воздуха (![]() )
к его теоретически необходимому
количеству (
)
к его теоретически необходимому
количеству (![]() )
представляет собой коэффициент избытка
воздуха (
)
представляет собой коэффициент избытка
воздуха (![]() ):
):
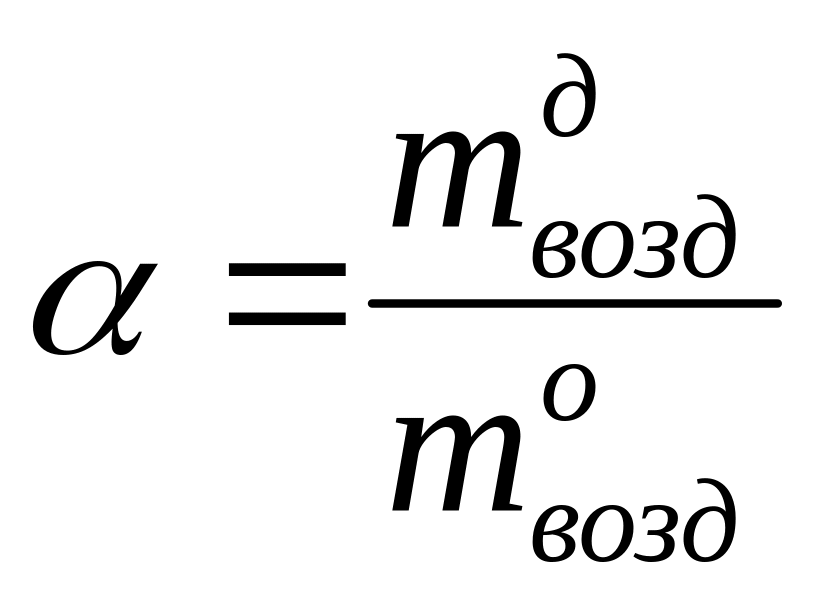 .
.
При
сжигании древесины
![]() ;
углей -
;
углей -
![]() ;
при сжигании газа и мазута
;
при сжигании газа и мазута
![]() ;
в дизелях минимальные значения
близки к 1,3; карбюраторные двигатели
работают в диапазоне значений
от 0,8 до 1,2 (в зависимости от режима работы
и конструкции двигателя).
;
в дизелях минимальные значения
близки к 1,3; карбюраторные двигатели
работают в диапазоне значений
от 0,8 до 1,2 (в зависимости от режима работы
и конструкции двигателя).
Различают три вида топливных смесей, в зависимости от значения .
При
![]() смеси
называются бедными
(окислителя в зону реакции подается
больше, чем требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
SO2,
N2,
О2.
смеси
называются бедными
(окислителя в зону реакции подается
больше, чем требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
SO2,
N2,
О2.
При
![]() смеси
называются стехиометрическими
(окислителя в зону реакции подается
столько, сколько требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
SO2,
N2.
смеси
называются стехиометрическими
(окислителя в зону реакции подается
столько, сколько требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
SO2,
N2.
При
![]() смеси
называются богатыми
(окислителя в зону реакции подается
меньше, чем требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
СО, С, N2.
смеси
называются богатыми
(окислителя в зону реакции подается
меньше, чем требуется для полного
сгорания горючего). В продуктах сгорания
таких смесей содержатся следующие
элементы: Н2О,
СО2,
СО, С, N2.
