
- •Общие указания
- •Глава 1
- •1.1. Органические топлива
- •1.1.1. Состав топлив
- •1.1.2. Характеристики топлив
- •1.1.3. Разновидности горения
- •1.1.4. Основные стадии гетерогенного горения
- •1.1.5. Фазы горения
- •1.1.6. Скорость горения
- •1.2. Расчет процессов горения
- •1.2.1. Определение потребного количества окислителя для полного сжигания 1кг горючего
- •1.2.2. Определение массы воздуха для сжигания 1кг топлива
- •1.2.3. Коэффициент избытка воздуха
- •1.2.4. Определение количества и состава продуктов сгорания
- •1.2.5. Определение состава продуктов сгорания
- •1.2.6. Определение температуры конца сгорания
- •1.2.7. Упрощенная форма уравнения теплового баланса
- •Глава 2
- •2.1. Основные понятия и определения термодинамики
- •2.2. Параметры состояния системы
- •2.3. Первый закон термодинамики
- •2.4. Свойства рv – и Тs – диаграмм
- •2.5. Термодинамические процессы идеальных газов
- •2.5.1. Политропный процесс
- •Вывод уравнения политропного процесса
- •Соотношения между параметрами состояния в политропном процессе
- •Определение изменения внутренней энергии
- •Определение изменения энтальпии
- •Определение изменения энтропии
- •Определение теплоты, подводимой (отводимой) в ходе политропного процесса
- •Определение работы расширения в ходе политропного процесса
- •2.5.2. Частные случаи политропного процесса
- •2.5.3. Изохорный процесс
- •2.5.4. Изобарный процесс
- •2.5.5. Изотермический процесс
- •2.5.6. Адиабатный процесс
- •2.5.7. Графическое изображение процессов
- •2.6. Термодинамические циклы
- •Глава 3
- •3. Реальные газы
- •3.1. Отличия реальных газов от идеальных
- •3.2. Устройство pv – диаграммы реального газа
- •3.3. Области pv- диаграммы
- •3.4. Таблицы водяного пара
- •3.5. Определение параметров влажного насыщенного пара
- •3.6. Диаграммы водяного пара
- •3.7. Расчет процессов изменения состояния реального газа (водяного пара)
- •Изохорный процесс ( )
- •Изобарный процесс ( )
- •Изотермический процесс ( )
- •3.9. Паросиловые установки
- •Глава 4 конвективный теплообмен
- •4.1. Математическая формулировка задачи конвективного теплообмена
- •4.2. Краевые условия при решении задач конвективного теплообмена (условия однозначности)
- •4.3. Решение задач конвективного теплообмена на основе теории подобия
- •4.4. Приведение системы дифференциальных уравнений к безразмерному виду
- •4.5. Теоремы подобия
- •4.6. Физический смысл критериев гидромеханического и теплового подобия
- •4.7. Критериальные уравнения конвективного теплообмена
- •4.8. Методика решения задач конвективного теплообмена на основе теории подобия
- •4.9. Выбор определяющих размеров и величин
- •Семестровая работа №1 топливо, газовые смеси и теплоемкость
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •Исходные данные
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №2 термодинамические процессы и циклы с газообразным рабочим телом
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы
- •I. Расчет термодинамических процессов, составляющих цикл
- •II. Расчет прямого цикла 1-2-3-4-5-1
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Семестровая работа №3 термодинамические процессы водяного пара
- •Указания к выполнению семестровой работы
- •Исходные данные
- •Методика расчета семестровой работы
- •1. Расчет адиабатного процесса 1-2
- •2. Расчет изобарного процесса 2-3
- •3. Расчет процесса 3-4
- •4. Расчет изобарного процесса 4-5
- •5. Расчет изобарного процесса 5-6
- •6. Расчет изобарного процесса 6-1
- •7. Расчет цикла
- •Контрольные вопросы
- •Основная литература
- •Семестровая работа №4 конвективный теплообмен и интенсификация теплопередачи
- •Указания к выполнению семестровой работы
- •Методика расчета семестровой работы № 4
- •1. Определяем коэффициент теплоотдачи
- •2. Определяем коэффициент теплоотдачи
- •3.Определяем термические сопротивления
- •4. Определяем коэффициент теплопередачи
- •5. Вычисляем плотность теплового потока
- •Контрольные вопросы
- •Основная литература
- •Дополнительная литература
- •Приложения
- •Свойства горючих
- •Формулы средних (в интервале 0...Т, к) изохорных массовых
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Термодинамические свойства пара и воды в состоянии насыщения (по давлению)
- •Физические параметры воды на линии насыщения при давлении 101325 Па (760 мм.Рт.Ст.)
- •Физические параметры сухого воздуха при давлении
- •Оглавление
2.3. Первый закон термодинамики
Закон сохранения и превращения энергии является наиболее общим универсальным законом природы, применяемым ко всем явлениям и процессам.
Этот закон формулируется так: «Энергия изолированной системы, при любых происходящих в ней процессах, не меняется; энергия не уничтожается и не создается».
В термодинамике первое начало обычно записывают так (применительно к 1кг массы):
q = Δu + l (2.6)
или в дифференциальной форме:
dq = du +dl. (2.7)
Таким образом, в общем случае тепло, подводимое к системе, расходуется как на изменение энергии, так и на совершение работы.
2.4. Свойства рv – и Тs – диаграмм
Если воспользоваться системой координат рv, то величину работы можно определить графически.
Нетрудно
видеть (рис. 2.1), что элементарная площадка
аbcd = рdv
= dl,
а площадь АВСD
=
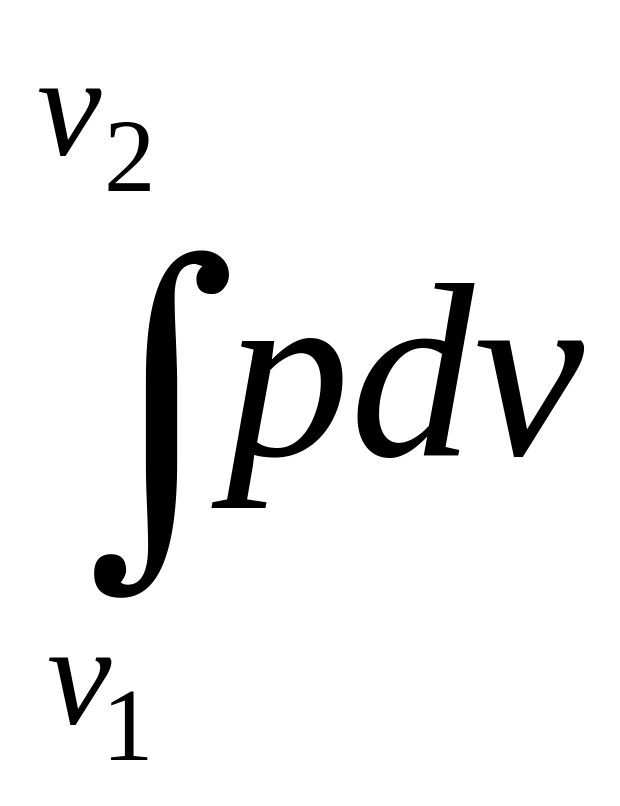 =
l.
Таким
образом, в системе координат рv
работа, совершенная в ходе процесса,
численно равна площади, ограниченной
кривой процесса, осью абсцисс и крайними
ординатами.
=
l.
Таким
образом, в системе координат рv
работа, совершенная в ходе процесса,
численно равна площади, ограниченной
кривой процесса, осью абсцисс и крайними
ординатами.
Из-за этого свойства рv- диаграмму называют рабочей диаграммой.
Теплота, подведенная (отведенная) в ходе элементарного обратимого процесса, может быть вычислена при использовании уравнений (2.4) и (2.5):
dQ = TdS или dq = Tds. (2.8)
Для всего процесса:
Q
=
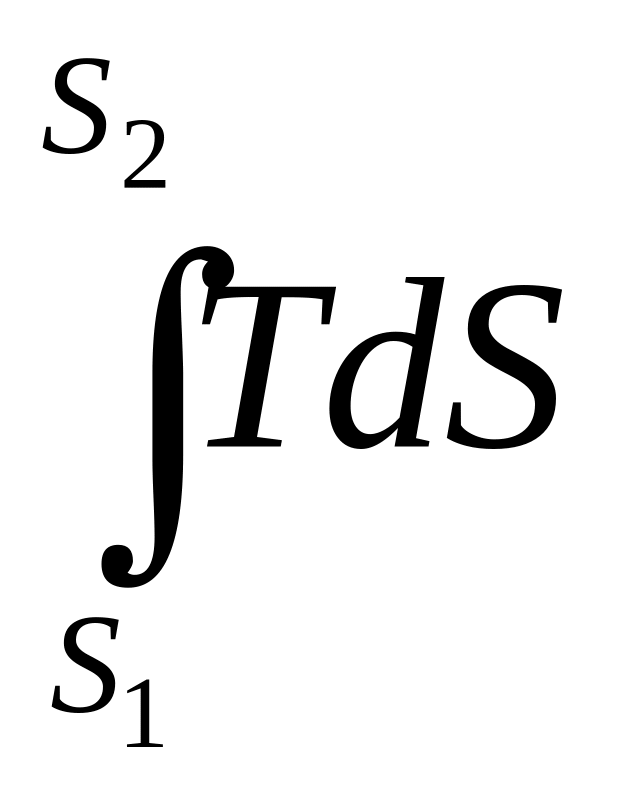 или
q
=
или
q
=
![]() .
(2.9)
.
(2.9)
Взаимосвязь между Т и S в разных процессах различна. Поэтому количество теплоты (как и работы) зависит не только от начального и конечного состояний системы, но и от вида процесса.
Решение интегралов (2.9) можно осуществить графическим путем, если воспользоваться диаграммой ТS. Нетрудно видеть (рис. 2.2), что элементарная площадка аbcd = Tds = dq, a площадь АВСD = = q.
Таким образом, в системе координат ТS площадь, ограниченная кривой процесса, осью абсцисс и крайними ординатами, численно равна подведенной (отведенной) теплоте. Поэтому ТS- диаграмму иначе называют тепловой.
T
а
d
b
c
T
A
B
C
D
P








B


b
p
c

C
а
d
A
D
ds
S
dv
V

Рис. 2.1 Рис. 2.2
2.5. Термодинамические процессы идеальных газов
Ранее было введено понятие «термодинамический процесс», без которого невозможно вести речь о работе, теплоте, теплоемкости, первом законе термодинамики и т.д. Протекание термодинамических процессов обеспечивает функционирование тепловых двигателей, компрессоров, различных пневматических приспособлений и т.п.
В ходе термодинамического процесса осуществляется в общем случае энергетическое взаимодействие термодинамической системы и окружающей среды, сопровождающееся изменением параметров состояния системы. Классический аппарат технической термодинамики позволяет проводить анализ обратимых процессов. Поэтому последующее изложение будет относиться к указанным процессам. Анализ термодинамических процессов существенно упрощается, если принять, что при их протекании теплоемкость тела, образующего систему, величина постоянная.
Рассмотрение термодинамических процессов начнем с политропного процесса, которым пользуются для аппроксимации реальных процессов.
