
- •1. Назначение и свойства фосфатного покрытия
- •Ускоренное и холодное фосфатирование
- •Механизация процесса фосфатирования
- •Глава XV контроль качества гальванических покрытий
- •Требования к гальваническим покрытиям
- •Контроль по внешнему виду
- •Обезжиривание органическими растворителями
- •Химическое обезжиривание
- •Электрохимическое обезжиривание
- •12 Обезжиривание венской известью
- •Химическое травление
- •Электрохимическое травление
- •Декапирование
- •Хромпик 50 г/л
- •Химическое полирование
- •Декапирование и промывки
- •§ 32. Оксидирование магния и его сплавов
- •§ 33. Фосфатирование металлов
- •Контрольные вопросы
- •Глава X гальванопластика
- •§ 34. Основные технологические операции
- •§ 9. Химическое и электрохимическое полирование
- •Глава III защитно-декоративные покрытия
- •§ 10. Меднение
- •Глава V окраска металлов1
- •1. Способы окраски металлов
- •Метод нагрева при низкой температуре
- •Глава VI
- •Химическое и электрохимическое обезжиривание
- •Едкий натр №он 50 г/л
- •2. Обезжиривание с применением ультразвука
- •7 Мнгпитострикциоиный преобразователь; 5 — обмотка возбуждения электрических
- •Декапирование
- •Матирование
- •Промывка
- •1. Общие сведения
- •Фосфатирование черных металлов
- •Фосфатирование цветных металлов
- •Глава XXIII
- •Общие сведения
- •Общие сведения
- •Классификация лакокрасочных материалов
Контрольные вопросы
Глава X гальванопластика
§ 34. Основные технологические операции
Гальванопластика служит для получения точных металлических копий путем электроосаждения металла и применяется при изготовлении бесшовных труб сложного профиля, пресс- форм, матриц для тиснения бумаги, кожи, печатных схем, фольги, сеток, различных деталей сложного профиля, скульптуры, медалей, ювелирных изделий и др.
Основные технологические операции в гальванопластике сводятся к следующим: 1) изготовление металлических или неметаллических форм; 2) нанесение проводящего слоя (для неметаллических форм); 3) нанесение разделительного слоя (для металлических форм); 4) электрохимическое осаждение металла; 5) отделение форм от полученных копий и окончательная обработка последних.
Формой, на которую осаждают металл, может быть как копия с оригинала, так и сам оригинал. Последнее встречается очень редко из-за порчи оригинала при электроосаждении. Существуют два метода изготовления форм. Форма может быть «негативной» копией с какого-либо оригинала, тогда осажденный слой металла станет «позитивным» и будет полностью соответствовать оригиналу. Во втором случае оригинал может отсутствовать, а форма готовится путем непосредственной обработки материала по чертежу.
Формы изготавливаются из различных материалов: металлов, пластмасс, восковых композиций, гипса и т. д. Основные требования, предъявляемые к формам, — сохранять точный отпечаток оригинала и химически не взаимодействовать с электролитом.
При использовании неметаллических форм необходимо нанести проводящий слой. Проводящий слой получают путем химического восстановления металлов из водных растворов. Разработаны способы получения пленок меди, никеля, серебра, золота и других металлов. В некоторых случаях применяют графитирование. !
При использовании металлических форм наносят разделительный слой, чтобы легче отделить копию от металлической формы. Разделительными слоями могут служить пленки из окислов и солей некоторых металлов, нанесенных химическим способом. В зависимости от металла, из которого изготовлена форма, наносят сульфидные, оксидные, хроматные и другие пленки.
Для «затяжки» формы металлом по проводящему слою применяют слабокислые медные и никелевые электролиты.
§ 9. Химическое и электрохимическое полирование
Для придания блеска поверхности обрабатываемых деталей применяется химическое и электрохимическое полирование, сглаживающее микрошероховатости, предотвращающее травление металла с помощью образующейся хроматной окисной пленки. Наибольший блеск поверхности достигается при минимальной толщине оксидной пленки, защищающей металл от травящего действия раствора. В результате полирования улучшается не только декоративная отделка поверхности деталей,
Рис.
6. Зависимость силы тока от напряжения
при электрополировании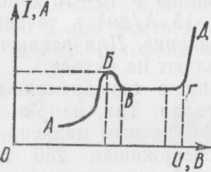
Применяя электрохимическое полирование для чистовой обработки деталей, можно уменьшить шероховатость поверхности. При электрохимическом полировании обрабатываемая деталь служит анодом. При этом эффективность процесса зависит не только от состава электролита, режима электролиза и шероховатости, но и от величины анодной поляризации.
На рис. 6 участок кривой АБ соответствует нормальному растворению анода с теоретическим выходом по току. Скорость диффузии продуктов анодного растворения в этой области больше, чем скорость растворения. По мере приближения к точке Б разница между ними уменьшается. На участке БВ скорость растворения становится больше скорости диффузии, что приводит к накоплению продуктов анодного растворения на поверхности анода. В результате этого наблюдается повышение сопротивления и падение тока. Предельный ток, соответствующий участку ВГ, характеризует образование пассивной пленки на аноде, при этом ток остается постоянным, а напряжение падает. При достижении соответствующего напряжения на кривой ГД начинается выделение газообразного кислорода.
В зависимости от состава электролита и обрабатываемого металла электрополирование осуществляют при режимах, соответствующих различным участкам кривой сила тока — напряжение. Так, полирование меди в фосфорной кислоте ведут в режиме предельного тока и с достаточно широким диапазоном напряжения. В результате контроль за полированием меди в фосфорной кислоте удобнее осуществлять по напряжению на электролизере или по потенциалу анода_ а не по плотности тока. Полирование меди, стали, алюминия в фосфатных элек
тролитах, содержащих хромовый ангидрид, происходит при режиме, соответствующем второму подъему кривой, и сопровождается выделением кислорода. Так как в этом случае процесс полирования осуществляется в широком диапазоне плотностей тока, режим электролиза контролируется по плотности тока. Электрохимическое полирование целесообразно использовать для деталей с малой шероховатостью.
Основным компонентом электролитов является ортофосфорная кислота. В табл. 13 приведены составы электролитов для полирования углеродистых, низколегированных и коро- зионно-стойких сталей, никеля, латуни и алюминия. Режим полирования следующий: анодная плотность тока —25—50 А/дм2,
Таблица 13
Состав
универсальных электролитов для
электрополирования (%)
Компоненты
электролита
Полируемый
металл
Углеродистые
сталь,
никель
Коррозионно-
стойкая
сталь
Алюминии
Медь,
латунь
Ортофосфорная
кис
65
40
40-50
70—75
лота
Серная
кислота
15
40
35-45
—
Хромовый
ангидрид
6
3
3-5
6-8
Вода
14
17
10-12
17—24
температура раствора — 20—40 °С для никеля и меди, а для железа и алюминия —70—80 °С; время процесса 2—10 мин.
Для электрополирования меди и алюминия рекомендуются более простые двухкомпонентные электролиты, содержащие 1000—1200 г/л Н?Р04 с добавкой бутанола (10—100 мл/л) или моноэтаноламина (40—50 мл/л). При электрохимическом полировании катод должен быть химически устойчив, поверхность катода — в несколько раз больше анодной, что облегчает регулирование процесса по напряжению.
Химическое полирование имеет не только преимущества (менее трудоемко, чем электрохимическое и механическое), но и недостатки: небольшой срок службы растворов, трудность и даже невозможность корректирования, меньший блеск по сравнению с электрохимическим. Химическое полирование применяется .в тех случаях, где механическое полирование затруднено, а поверхность детали не требует зеркального блеска (детали сложной формы и малых размеров).
Наиболее распространенным в промышленности раствором химического полирования является следующий состав для полирования меди и латуни (масс, доли, %):
/’^МЛ^\АЛ/ЖАЛД»'\АА/1Щ/ 8
мм 42
М М I 1 42
I I 42
г Г 427
Температура раствора — 20 30 °С, продолжительность обработки — 5—10 мин.
Для электрополирования стали предложены новые электролиты на основе фосфорной и серной кислот с добавкой органических соединений, в качестве которых используются ингибиторы коррозии БА-6, БА-12 и ПБ-5. Преимуществом этих электролитов является отсутствие соединений хрома, что упрощает их корректирование. Практический интерес может иметь электролит следующего состава (масс, доли, %) и режима работы:
65
15
5
15
.
. 25-30
.
. 50-60
Серная кислота
Триэтаноламин
Вода
Анодная плотность тока, А/дм2 . . Температура электролита, °С . . . .
Наиболее высокое качество полирования в электролитах с добавками органических соединений можно получить при обработке коррозионно-стойких сталей.
В результате электрохимического полирования поверхность металла покрывается пассивирующей пленкой. Эта пленка должна быть предварительно перед нанесением гальванического покрытия удалена для обеспечения прочного сцепления покрытия с основой. Удаление пленки осуществляется в 5 %-ном растворе НС1. Если электрохимическое полирование является заключительной отделочной операцией, то стальные детали, после промывки в воде, обрабатывают в течение 15—20 мин при 60—70°С в 10 %-ном растворе едкого натра. Такая обработка повышает их стойкость против коррозии.
Электрохимическое полирование меди и ее сплавов осуществляется в растворах фосфорной кислоты с добавками хромового ангидрида или органических соединений. Благодаря добавлению хромового ангидрида хорошее качество полирования достигается в большом диапазоне плотностей тока, что дает возможность полировать почти все медные сплавы, за исключением латуни ЛС59 и бронзы КМц, на поверхности которых появляются матовые пятна из-за небольшого травления. Оптимальный состав электролита следующий: 1000—1200 г/л фосфорной кислоты и 100—150 г/л хромового ангидрида. Электролиз ведут при анодной плотности тока 15—50 А/дм2 и температуре 18—30 °С в течение 3—10 мин. Накопление в растворе небольшого количества меди улучшает качество полирования, но из- за накопления ионов трехвалентного хрома усложняется работа по обезвреживанию содержащих хром промышленных стоков. К недостаткам фосфорнокислого электролита относятся большой съем металла и небольшая интенсивность сглаживания микрошероховатости. Для предотвращения перетравливания и повышения интенсивности блеска поверхности металла в электролит добавляют алифатические спирты, в особенности бутило
вый и амиловый. Органические добавки не должны подвергаться анодному окислению или катодному восстановлению с образованием продуктов, неблагоприятно сказывающихся на ходе электролиза. Рекомендуется следующий состав электролитов и режим электролизов (табл. 14).
Таблица 14
Номер
раствора
800-1300
80-100
18—30
15—50
1000-1300
80-100
40-50
18-30
15-50
п-Бутиловый спирт, мл/л Триэтаноламин, мл/л Температура, °С
Анодная плотность тока, А/дмг
Контрольные вопросы
Каковы виды механической подготовки поверхности деталей?
Чем отличаются процессы шлифования и крацевания от процесса полирования?
Из чего изготавливаются круги при шлифовании и полировании?
Каким способом удаляют смазочные масла с деталей?
В чем отличие химического обезжиривания в щелочи от электрохимического?
Почему нельзя травить черные металлы в кислотах без введения добавок ингибиторов коррозии?
Можно ли травить медь в серной кислоте?
Чем отличается процесс травления от активации?
На какую штангу завешивается деталь при электрохимическом полировании?
Какие компоненты входят в состав раствора для электрополирования деталей из меди и медных сплавов?
В чем заключается разница химического полирования от электрополирования?
В чем заключается техника безопасности при обезжиривании и травлении?
