
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •3. Равновесия. Стабильное и метастабильное равновесие. Виды равновесий. Равновесия статическое и динамическое. Физическое равновесие. Фазовые равновесия. Фазовые диаграммы. Диаграмма воды.
- •1. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Развитие представлений о строении атома. Составные части атома – ядро, (протоны, нейтроны), электроны их заряд и масса. Понятие о масс-спектрометрии.
- •2. Металлическая связь. Кластеры.
- •3. Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные св-ва растворов. Законы Генри, Рауля, Вант-Гоффа.
- •2. Ковалентная связь. Основные положения теории отталкивания валентных электронных пар (овэп), теории валентных связей (твс). Гибридизация. Полярная и неполярная ковалентная связь.
- •3. Фазовые диаграммы двухкомпонентных систем. Фракционная перегонка.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2.Степень ионности и ковалентности связи. Природа связи в кс.
- •3.Растворы электролитов. Сильные и слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда.
- •2. Эффективные заряды атомов в молекулах. Электрический момент. Постоянные и наведенные диполи. Дисперсионное, ориентационное и индукционное взаимодейтсвие.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •3. Соли, основные свойства. Гидролиз солей. Примеры.
- •1.Химия как наука о веществах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •2. Изолированные и неизолированные системы. Функции состояния, уравнения состояния. Работа теплота и энергия. Температура. Внутренняя энергия.
- •3. Амфотерность. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Теплота и температура. Основные понятия и фундаментальные законы химии.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. 3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
- •3. Электродные потенциалы. Электродные потенциалы металлов и факторы, влияющие на их величину. Понятие о стандартных потенциалах. Стандартный (нормальный) водородный потенциал.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •3. Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нернста. Расчет Энергии Гиббса окисл-восст процессов по эдс гальванического эл-та
- •3Первичные и вторичные источники химической информации.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нерста. Расчет энергии Гиббса окислительно-восстановительных процессов по эдс гальванического элемента.
- •2.Цепные реакции. Тепловой и разветвленно-цепной взрывы.
- •3.Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные свойства растворов. Законы Генри, Рауля, Вант-Гоффа.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния ē квантовыми числами. Атомные орбитали. Принцип наименьшей энергии. Принцип Паули. Правило Хунда.
- •2. Энергия Гиббса и направление хим. Реакции.
- •2. Физическое равновесие. Фазовые равновесия. Понятие о фазовых диаграммах. Фазовая диаграмма воды.
- •3. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •1.Периодический закон и его значение для неорганической химии. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Кислоты и основания. Кислотно-основные свойства по Аррениусу, Бренстеду-Лоури и Льюису.Амфотерность.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя и энергия. Химическая форма энергии. Смеси и вещества. Анализ и синтез. Теплота и температура.
- •2.Водородная связь. Вандерваальсово взаимодействие. Размеры атомов и ионов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Основные положения электронной теории валентности Косселя-Льюиса. Ионный и ковалентный характер связи. Формулы Льюиса.
- •2.Цепные реакции. Тепловой и разветвлено-цепной взрывы. Примеры.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису. Примеры.
- •1. Квантово механическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2. Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
- •1.Температура
- •3 Равновесия. Обратимые и необратимые реакции. Константа равновесия. Условия смещения хим. Равновесия. Примеры. Хим. Равновесие и катализ.
- •1. Размеры атомов и ионов. Ионный, ковалентный, металлический и вандерваальсов радиусы.
- •2. Функции состояния системы. Энтальпия. Правила термохимии. Закон Гесса.
- •3. Идеальные и неидеальные растворы. Коллигативные св-ва растворов.
3. Равновесия. Стабильное и метастабильное равновесие. Виды равновесий. Равновесия статическое и динамическое. Физическое равновесие. Фазовые равновесия. Фазовые диаграммы. Диаграмма воды.
Равновесия. Система считается находящейся в положении равновесия, если все воздействия на эту систему компенсируются другими или отсутствуют вообще. Виды равновесий: Статистическое -> механическое, и Динамическое -> термодинамическое, химическое и т.п.
Химическое равновесие — положение, в котором химическая реакция протекает в той же степени, как и обратная реакция, и в результате не происходит изменения количества каждого компонента.
Фазовое равновесие — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия. Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества. Фазовые равновесия могут быть стабильными и метастабильными. Те и другие являются локально устойчивыми, т. е. устойчивыми по отношению к малым возмущениям параметров состояния -т-ры, давления, состава (концентраций компонентов). Мета-стабильные фазовые равновесия отличаются тем, что они неустойчивы к нек-рым конечным изменениям этих параметров, ведущим, в частности, к переходу к другим фазам. Напр., пересыщенный р-р или переохлажденный расплав неустойчивы по отношению к кристаллич. фазе. Поскольку метастабильное состояние системы локально устойчиво, переход к стабильному состоянию требует преодоления нек-рого активационного барьера и протекания процесса зародышеобразования
Фа́зовая диагра́мма — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме. На фазовых диаграммах однокомпонентных систем поля, по правилу фаз, соответствуют однофазным состояниям, линии, разграничивающие их — двухфазным, точки пересечения линий — трёхфазным (эти точки называют тройными точками).
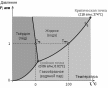
Двухфазные линии, как правило, либо соединяют две тройные точки, либо тройную точку с точкой на оси ординат, отвечающую нулевому давлению. Исключение составляет линия жидкость-газ, заканчивающаяся в критической точке. При температурах выше критической различие между жидкостью и паром исчезает.
БИЛЕТ 2.
1. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
ГЭ – это химический источник тока, к-рый состоит из металлических элеткродов, опущенных в р-ры элеткролитов и соединных в замкнутую электрическую цепь. ЭДС – разность потенциалов на катоде, содержащем восстановитель и аноде, содержащем окислитель, соответствующая свободной энергии окислительно-восстановительной реакции. (Пару Ме + р-р его соли называют электродом. Разность потенциалов на гранцие Ме – р-р называют электродным потенциалом)
Электрохимическая р-я – хим превращение которое происходит под действием эл тока в электр. ячейке (электролизере) при электролизе.
Электрохимическая реакция, протекающая в гэ является ОВР, принципиальное отличие:
1) процессы окисления и восст. пространственно разделены
2)происходит в двойном электрическом слое на электродах связанных металлическим проводником.
Электрод, на котором происх окисл - анод, в гэ А(-), в элеткролизере А(+), электрода на котором восстановление – катод, в гэ К(+) , в электролизере К(-)
3) при протекании хим реакции поддерживается эдс.
!!! Потенциал анода меньше потенциала катода, это необходимое условие протекание электрохимической реакции.
ТИПЫ ГЭ:
1.Хим гэ. полуэлементы состоят из металиических электродов, опущненных в р-ры их собственных солей. (гэ Даниэля-Якоби, (-) Zn | ZnSO4 || CuSO4 | Cu (+) )
2. Концентрационные гэ состоят из двух электродов из одинаковых Ме, но опущенных в р-ры солей разной концентрации. ( (-)Ag | Ag+c1 || c2Ag+ | Ag (+)
Электрохимический ряд напряжений металлов получен путем сравнения потенциала Ме с потенциалом Н2. Потенциал металла, измеренный при стандартных условиях относительно стандартного водородного электрода сравнения наз. стандартным электродным потенциалом.
Стандартный водородный электрод – электрод сравнения. Схема гальв эл-та с помощью которого были получены потенциалы Ме: (-) Zn | ZnSO4 || 1M H2SO4 | H2, Pt (+)
В ряду напряжения металлов <– усиление активности, уменьшение потенциала. 1) Чем левее Ме в ряду напряжений, тем он активнее (легче окисляется и труднее восст); 2) от Mg до H - Ме средней активности, вытеснят водород из перегретого пара, а Mg и Al из гор воды; 3) после водорода малоакт Ме, которые не вытесняют водород из воды и даже из кислот при высоких t. 4) каждый Ме (начиная с Mg) вытесняет все последующие из р-ров солей (щ и щ-з Ме не вытесняют т к реагируют сначала с водой из р-ра) 5) с кислотами-окислителями реаегируют все Ме (кроме золота и платины), но водород при этом не выделяется.
Обратимый (равновесный) электродный потенциал устанавливается в том случае, когда Ме в равновесси с собственными ионами. Обратимый процесс можно провести в обратном направлении если приложить эдс больше эдс гэ.
Необратимый (неравновесный) потенциал – который возникает в гэ сост из разных эл-тов. В отличие от обратимого хим реакция протекает и в неработающем эл-те.
Виды обратимых электродов: 1) электроды первого рода – Ме электроды, опущенные в р-ры собств солей и водородные электроды. 2) второго рода – Ме покрытые труднораств соед (солью, оксидом, гидроксидом) и опущенные в р-р эл-та, имеющий общий ион с труднораств соед (хлорсеребряный электрод Ag ,AgCl | KCl ; каломельный электрод Hg, H2Cl2 | KCl (каломель H2Cl2 ) )
Ионселективные электроды – электроды, потенциал которых зависит от одного иона в р-ре.
2. Ионная связь. Ненаправленность и ненасыщенность ионной связи. Степень окисления атомов в молекуле. Поляризуемость ионов и их взаимное поляризующее действие. Влияние степени поляризации ионов на свойства веществ.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара практически полностью переходит к атому с большей электроотрицательностью. Образуется между типичными металлом и неметаллом. Наиболее типичные соеднинения с ионной связью - это тв неорганические соли (в т ч и комплексные), существующие в виде ионных кристаллов. Идеальной «стопроцентной» ионной связи как правило не существует. Ненаправленность связи определяется тем, что каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению.
Под ненасыщаемостью понимается что два разноименных заряда притянувшиеся друг к другу сохранют способность электростатически взаимодействовать с другими ионами. Т е к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относит размерами противоположных ионов и тем сто силы притяжения должны преобладать над силами отталкивания.
Степень окисления – условный заряд, который возник бы у атома элемента, если бы электроны валентных пар были бы не стянуты, а полностью переданы атому более электроотрицательного элемента.
Поляризация ионов. Ионная связь возникает между атомами элементов с сильно различающейся электроотрицательностью, которые в результате электронных переходов превращаются в противоположнозаряженные ионы. Электростатическое воздействие на частицу вызывает смещение в ней электрических зарядов, называемой поляризацией. (влияние ионов друг на друга, которое приводит к деформации электронной оболочки иона) Наибольшее смещение испытывают электроны внешнего слоя. Под действием одних и того электрического поля разлиные ионы деформируются в разной степени. Иначе говоря поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром. Тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размера иона, т к внешние электроны удаляются все дальше от ядра. Превращение атома в катион всегда приводит к уменьшению его размеров. Кроме того избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков. Анионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, ослаблению связи их с ядром => поляризуемость анионов значительно выше поляризуемости катионов. Поляризующая способность ионов т.е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемой им электрическое поле=> больше поляризующая способность. Поляризующая способность ионов одинакового заряда и аналогичного электронного строения падает с увеличением ионного радиуса. Анионы обладают меньшей поляризующей способностью чем катионы.
Таким образом анионы (в сравнении с катионами) характеризуются сильной поляризуемостью и слабой поляризующей способностью, поэтому при взаимодействии разноименных ионов поляризации в соновном подвергается анион. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Это сказывается на диссоциации солей в водных растворах. Так хлорид бария является сильным элеткролитом и практически полностью диссоциирует, тогда как хлорид ртути почти не диссоциирует на ионы. Это объясняется сильным поляризующим действием иона Hg2+.
