
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •3. Равновесия. Стабильное и метастабильное равновесие. Виды равновесий. Равновесия статическое и динамическое. Физическое равновесие. Фазовые равновесия. Фазовые диаграммы. Диаграмма воды.
- •1. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Развитие представлений о строении атома. Составные части атома – ядро, (протоны, нейтроны), электроны их заряд и масса. Понятие о масс-спектрометрии.
- •2. Металлическая связь. Кластеры.
- •3. Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные св-ва растворов. Законы Генри, Рауля, Вант-Гоффа.
- •2. Ковалентная связь. Основные положения теории отталкивания валентных электронных пар (овэп), теории валентных связей (твс). Гибридизация. Полярная и неполярная ковалентная связь.
- •3. Фазовые диаграммы двухкомпонентных систем. Фракционная перегонка.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2.Степень ионности и ковалентности связи. Природа связи в кс.
- •3.Растворы электролитов. Сильные и слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда.
- •2. Эффективные заряды атомов в молекулах. Электрический момент. Постоянные и наведенные диполи. Дисперсионное, ориентационное и индукционное взаимодейтсвие.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •3. Соли, основные свойства. Гидролиз солей. Примеры.
- •1.Химия как наука о веществах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •2. Изолированные и неизолированные системы. Функции состояния, уравнения состояния. Работа теплота и энергия. Температура. Внутренняя энергия.
- •3. Амфотерность. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Теплота и температура. Основные понятия и фундаментальные законы химии.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. 3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
- •3. Электродные потенциалы. Электродные потенциалы металлов и факторы, влияющие на их величину. Понятие о стандартных потенциалах. Стандартный (нормальный) водородный потенциал.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •3. Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нернста. Расчет Энергии Гиббса окисл-восст процессов по эдс гальванического эл-та
- •3Первичные и вторичные источники химической информации.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нерста. Расчет энергии Гиббса окислительно-восстановительных процессов по эдс гальванического элемента.
- •2.Цепные реакции. Тепловой и разветвленно-цепной взрывы.
- •3.Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные свойства растворов. Законы Генри, Рауля, Вант-Гоффа.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния ē квантовыми числами. Атомные орбитали. Принцип наименьшей энергии. Принцип Паули. Правило Хунда.
- •2. Энергия Гиббса и направление хим. Реакции.
- •2. Физическое равновесие. Фазовые равновесия. Понятие о фазовых диаграммах. Фазовая диаграмма воды.
- •3. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •1.Периодический закон и его значение для неорганической химии. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Кислоты и основания. Кислотно-основные свойства по Аррениусу, Бренстеду-Лоури и Льюису.Амфотерность.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя и энергия. Химическая форма энергии. Смеси и вещества. Анализ и синтез. Теплота и температура.
- •2.Водородная связь. Вандерваальсово взаимодействие. Размеры атомов и ионов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Основные положения электронной теории валентности Косселя-Льюиса. Ионный и ковалентный характер связи. Формулы Льюиса.
- •2.Цепные реакции. Тепловой и разветвлено-цепной взрывы. Примеры.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису. Примеры.
- •1. Квантово механическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2. Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
- •1.Температура
- •3 Равновесия. Обратимые и необратимые реакции. Константа равновесия. Условия смещения хим. Равновесия. Примеры. Хим. Равновесие и катализ.
- •1. Размеры атомов и ионов. Ионный, ковалентный, металлический и вандерваальсов радиусы.
- •2. Функции состояния системы. Энтальпия. Правила термохимии. Закон Гесса.
- •3. Идеальные и неидеальные растворы. Коллигативные св-ва растворов.
2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл Для химической реакции изменение энтропии аналогично изменению энтальпии. Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. Энтропия зависит от:
Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
Изотопного состава (H2O и D2O).
Молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
Строения молекулы (н-C4H10, изо-C4H10).
Кристаллической структуры (аллотропии) – алмаз, графит.
стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру TΔS количественно оценивает эту тенденцию и называется энтропийным фактором. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
В изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Энтропия равна нулю только у идеального кристалла при абсолютном нуле (третий закон термодинамики).
3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
Состояние системы, когда в ней протекает 2 проитвоположнонаправленных процесса с одинаковой скоростью называется хим равновесием.
при постоянной Т отношение произведения равновесных концентраций продуктов реакции в степенях стехиометрических коэффициентов к произведению равновесных конц исх в-в в степенях стехиометричесикх коэффициентов есть величина постоянная и назыв константой равновесия данной реакции. Зависит только от температуры.
Физический смысл константы равновесия: показывает полноту протекания р-ии (∆G показывает глубину протекания)
Кр –> ∞ - необратимая, Кр=0 – не реагирует, ∆G = -RTlnKравн
Равновесные концентрации исх в-в – концентрация в-ва, не прореагир. к моменту равновесия.
Равновесные концентрации продуктов р-ии – та концентрация в-в, кот образовались к моменту равновесия.
Равновесный закон действующих масс: отношения произведения молярных концентраций продуктов к произведению молярных концентраций реагентов взятых в степенях равных стехиометрическим коэффициентам есть величина постоянная при данной температуре =Kр.
Факторы, влияющие на смещение равновесия:
Концентрация: увеличение концентрации исходных веществ ускоряет прямую реакции и смещает равновесии вправо (в сторону продуктов реакции), увеличение концентрации продуктов реакции увеличивает объем образовавшейся реакции и смещает равновесие влево.
Давление: если давление повышается, то равновесие смещается в сторону уменьшения объема реагирующей смеси, и если давление понижается то равновесие смещается в сторону увеличения объема реагирующей смеси.
Температура: при повышении температуры возрастает скорость как прямой так и обратной реакций, но в большей степени ускоряются эндотермические реакции, характеризующиеся большей величиной энергии активации.
Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказать какое либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, которое уменьшит указанное воздействие.
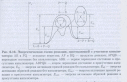
Катализ – явление изменения скорости реакции под действием катализаторов. В присутствии катализатора меняется путь, по которому проходит суммарная реакция, образуются другие переходные состояния, с иными энергиями активации, а поэтому изменяется и скорость химической реакции. Катализатор увеличивет скорость как прямой так и обратной химической реакции, поэтому на смещние химического равновесия он не
влияет.
Билет 17
1Основные виды хим. связи. Количественные характеристики хим. связи: длина связи м\у атомами, энергия связи, валентные углы. Электронная теория валентности Льюиса-Косселя. Ионный и ковалентный характер связи.
Химическая связь – состояние взаимодействующих атомов, характеризующееся минимумом энергии.Ковалентная – связь осуществляемая за счет образования электронной пары, принадлежащей обоим атомам(Н2, С12). Ионная – связь осуществляемая за счет электростатического притяжения между ионами(NaCl). Водородная – это связь между полож. заряженным атомом водорода и отрицательно заряженным атомом другой молекулы. Металлическая – связь когда валентные электроны металлов слабо связаны со своими ядрами и могут легко отрываться от них.Энергией связи называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль. Например, энергия связи Н—Н в молекуле водорода равна 436 кДж/моль. Если в молекуле несколько одинаковых связей, то, очевидно, для разрушения каждой следующей потребуется различная энергия и в таком случае говорят о средней энергии связи. Величина энергии химических связей в большинстве соединений колеблется в пределах 100-1000 кДж/моль. Энергия связи в ряду однотипных молекул постепенно изменяется. Например, энергия связи Н-Г в ряду гало-геноводородов HF, HC1, HBr, HI уменьшается с 565,7 кДж/моль у HF, до 294,7 кДж/моль у HI. Зная энергию связей в молекуле, можно судить также о ее реакционной способности и производить различные термохимические расчеты.Длиной связи называют среднее расстояние между ядрами, отвечающее минимуму энергии системы.
В ряду аналогичных по составу молекул длины связей также изменяются закономерно. Например, в ряду HF, НС1, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна 0,091; 0,127; 0,141; 0,160 нм. В молекулах, близких по химической природе, одного гомологического ряда, длины связей между ядрами элементов мало различаются и могут считаться практически постоянными (например, длины связей С - С в предельных углеводородах и т. д.).
Кроме того, на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, межъядерные расстояния уменьшаются. Так, длина связи С—С равна 0,154 нм, С = С - 0,135 нм и С ≡ С - 0,121 нм.
Валентные углы- это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°.Электронная теория валентности Льюиса-КосселяВ 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.2.Изолированные неизолированные сис-мы. Функции состояния, уравнения состояния. Работа, теплота, энергия. Температура. Внутренняя энергия.Термодинамические системы могут быть открытыми и закрытыми. Открытые системы обмениваются с окружающей средой и веществом, и энергией. Закрытые системы делятся на неизолированные и изолированные. Неизолированные системы не обмениваются с окружающей средой веществом, но обмениваются энергией. Изолированные системы не обмениваются ни веществом, ни энергией.Энтальпия(H)- термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц,энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении..Энтропия (S) – термодинамическая функция состояния, которая является мерой беспорядка, хаотичности, неупорядоченности в системе. Энтропия имеет размерность энергии, деленной на температуру. Выражают в [ДЖ/моль*кельвин]. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
Энергия Гиббса(G)- называемая также изобарно-термическим потенциалом или свободной порцией при постоянном давлении. G связана с H,S,T: G=H-TS. Если реакция осуществляется при постоянных P и Т, то ∆G=∆H-T∆S. При постоянстве температуры и давления хим.реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается. При низких температурах самопроизвольно могут протекать экзотермические реакции, а при высоких – реакции сопровождающиеся влечение энтропии.Внутренняя энергия(U) – энергия межмолекулярных внутримолекулярных взаимодействий. Она складывается из кинетической и потенциальной энергий частиц. Кинетическая- энергия поступательного, колебательного и вращательного движения частиц. Потенциальная - обусловлена силами притяжения и отталкивания, дейст. между частицами. U зависит от состояния в-ва. Энергия – мера способности совершать работу или передавать тепло.Температура-- свойство, определяющее направление перехода теплоты от одного объекта к другому.Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
Передача теплоты –передача энергии, вызываемая разностью температур между системой и ее окружением или между одной системой и другой системой.Работа - форма передачи энергии от одной системы к другой или от системы к ее окружению.
Функции состояния связаны между собой математическими соотношениями – уравнениями состояния.
Уравнение состояния идеального газа:
PV=nRT
Уравнение Ван дер Ваальса:
