
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •3. Равновесия. Стабильное и метастабильное равновесие. Виды равновесий. Равновесия статическое и динамическое. Физическое равновесие. Фазовые равновесия. Фазовые диаграммы. Диаграмма воды.
- •1. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Развитие представлений о строении атома. Составные части атома – ядро, (протоны, нейтроны), электроны их заряд и масса. Понятие о масс-спектрометрии.
- •2. Металлическая связь. Кластеры.
- •3. Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные св-ва растворов. Законы Генри, Рауля, Вант-Гоффа.
- •2. Ковалентная связь. Основные положения теории отталкивания валентных электронных пар (овэп), теории валентных связей (твс). Гибридизация. Полярная и неполярная ковалентная связь.
- •3. Фазовые диаграммы двухкомпонентных систем. Фракционная перегонка.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2.Степень ионности и ковалентности связи. Природа связи в кс.
- •3.Растворы электролитов. Сильные и слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда.
- •2. Эффективные заряды атомов в молекулах. Электрический момент. Постоянные и наведенные диполи. Дисперсионное, ориентационное и индукционное взаимодейтсвие.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •3. Соли, основные свойства. Гидролиз солей. Примеры.
- •1.Химия как наука о веществах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •2. Изолированные и неизолированные системы. Функции состояния, уравнения состояния. Работа теплота и энергия. Температура. Внутренняя энергия.
- •3. Амфотерность. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Теплота и температура. Основные понятия и фундаментальные законы химии.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. 3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
- •3. Электродные потенциалы. Электродные потенциалы металлов и факторы, влияющие на их величину. Понятие о стандартных потенциалах. Стандартный (нормальный) водородный потенциал.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •3. Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нернста. Расчет Энергии Гиббса окисл-восст процессов по эдс гальванического эл-та
- •3Первичные и вторичные источники химической информации.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нерста. Расчет энергии Гиббса окислительно-восстановительных процессов по эдс гальванического элемента.
- •2.Цепные реакции. Тепловой и разветвленно-цепной взрывы.
- •3.Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные свойства растворов. Законы Генри, Рауля, Вант-Гоффа.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния ē квантовыми числами. Атомные орбитали. Принцип наименьшей энергии. Принцип Паули. Правило Хунда.
- •2. Энергия Гиббса и направление хим. Реакции.
- •2. Физическое равновесие. Фазовые равновесия. Понятие о фазовых диаграммах. Фазовая диаграмма воды.
- •3. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •1.Периодический закон и его значение для неорганической химии. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Кислоты и основания. Кислотно-основные свойства по Аррениусу, Бренстеду-Лоури и Льюису.Амфотерность.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя и энергия. Химическая форма энергии. Смеси и вещества. Анализ и синтез. Теплота и температура.
- •2.Водородная связь. Вандерваальсово взаимодействие. Размеры атомов и ионов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Основные положения электронной теории валентности Косселя-Льюиса. Ионный и ковалентный характер связи. Формулы Льюиса.
- •2.Цепные реакции. Тепловой и разветвлено-цепной взрывы. Примеры.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису. Примеры.
- •1. Квантово механическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2. Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
- •1.Температура
- •3 Равновесия. Обратимые и необратимые реакции. Константа равновесия. Условия смещения хим. Равновесия. Примеры. Хим. Равновесие и катализ.
- •1. Размеры атомов и ионов. Ионный, ковалентный, металлический и вандерваальсов радиусы.
- •2. Функции состояния системы. Энтальпия. Правила термохимии. Закон Гесса.
- •3. Идеальные и неидеальные растворы. Коллигативные св-ва растворов.
3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
Сольволиз — реакция обменного разложения между растворенным веществом и растворителем.Гидролиз солей - это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды. Это обратимая реакция нейтрилизации.
-
Если соли образованы катионом сильного
основания и анионом сильной кислотой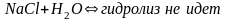 ;-
Если соли образованы катионом сильного
основания и анионом слабой кислотой
;-
Если соли образованы катионом сильного
основания и анионом слабой кислотой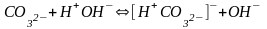 гидролиз идёт по слабому аниону, который
забирает себе ион водорода. Среда
щелочная, так как концентрация ионов
гидроксила превышена. Теперь дополняем
уравнение гидролиза теми ионами, которые
в нём не участвовали:
гидролиз идёт по слабому аниону, который
забирает себе ион водорода. Среда
щелочная, так как концентрация ионов
гидроксила превышена. Теперь дополняем
уравнение гидролиза теми ионами, которые
в нём не участвовали:
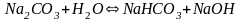 -
Если соли образованы катионом слабого
основания и анионом сильной кислотой
-
Если соли образованы катионом слабого
основания и анионом сильной кислотой
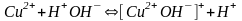
гидролиз идёт по слабому катиону, который забирает себе ион гидроксила. Среда кислая, так как концентрация ионов водорода превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
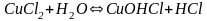
-
Если соли образованы катионами слабого
основания и анионами слабой кислоты
 гидролиз
идёт ДО КОНЦА, реакция НЕОБРАТИМА
гидролиз
идёт ДО КОНЦА, реакция НЕОБРАТИМА
Степень
гидролиза
-
это отношение числа молекул, подвергшихся
гидролизу
 к общему числу молекул в растворе
к общему числу молекул в растворе
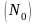 :
:
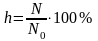
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесие процесса гидролиза.
-
Если соль образована кислотой то
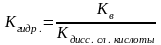
-
Если соль образована слабым основанием
то
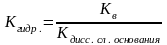
-
Если соль образована слабой кислотой
и слабым основанием то
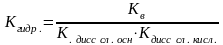
Билет 20
1.Зависимость электродных потенциалов от концентрации. Уравнение Нерста. Расчет энергии Гиббса окислительно-восстановительных процессов по эдс гальванического элемента.
Зависимость
электродного потенциала от концентраций
дает уравнение
Нернста.
![]()
Гальванические элементы – это устройства, в которых химическая энергия превращается в электрическую. В работающем элементе происходит гетерогенная, окислительно-восстановительная, токообразующая реакция. Вещества электродов (активные массы) разделены пространственно. На отрицательном электроде-аноде (А) происходит реакция окисления, а освободившиеся за счет этого электроны переходят по внешней цепи на положительный электрод-катод (К), где происходит реакция восстановления. Работа гальванического элемента, протекающая обычно в изотермических условиях, т.е. при постоянном давлении и температуре, является само произвольным процессом. Поэтому в ходе его происходит уменьшение энергии Гиббса (Δ G), равное максимальной работе элемента (Ам)
Ам = nFE0,
где Е0 – стандартная ЭДС гальванического элемента.
Ам = – ΔG,
где ΔG0 – энергия Гиббса в стандартных условиях.
–ΔG0 = nFE0,
Е0 = –ΔG0/nF .
Используя табличные значения ΔG0 для веществ - участников реакций, можно рассчитать энергию Гиббса и ЭДС для любой окислительно-восстановительной системы.
