
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •3. Равновесия. Стабильное и метастабильное равновесие. Виды равновесий. Равновесия статическое и динамическое. Физическое равновесие. Фазовые равновесия. Фазовые диаграммы. Диаграмма воды.
- •1. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Развитие представлений о строении атома. Составные части атома – ядро, (протоны, нейтроны), электроны их заряд и масса. Понятие о масс-спектрометрии.
- •2. Металлическая связь. Кластеры.
- •3. Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные св-ва растворов. Законы Генри, Рауля, Вант-Гоффа.
- •2. Ковалентная связь. Основные положения теории отталкивания валентных электронных пар (овэп), теории валентных связей (твс). Гибридизация. Полярная и неполярная ковалентная связь.
- •3. Фазовые диаграммы двухкомпонентных систем. Фракционная перегонка.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2.Степень ионности и ковалентности связи. Природа связи в кс.
- •3.Растворы электролитов. Сильные и слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда.
- •2. Эффективные заряды атомов в молекулах. Электрический момент. Постоянные и наведенные диполи. Дисперсионное, ориентационное и индукционное взаимодейтсвие.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •3. Соли, основные свойства. Гидролиз солей. Примеры.
- •1.Химия как наука о веществах и их превращениях. Место химии в системе наук. Материя. Химическая форма энергии. Смеси и вещества. Свойства материалов. Анализ и синтез.
- •2. Изолированные и неизолированные системы. Функции состояния, уравнения состояния. Работа теплота и энергия. Температура. Внутренняя энергия.
- •3. Амфотерность. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Теплота и температура. Основные понятия и фундаментальные законы химии.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. 3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
- •3. Электродные потенциалы. Электродные потенциалы металлов и факторы, влияющие на их величину. Понятие о стандартных потенциалах. Стандартный (нормальный) водородный потенциал.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •3. Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нернста. Расчет Энергии Гиббса окисл-восст процессов по эдс гальванического эл-та
- •3Первичные и вторичные источники химической информации.
- •1.Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису.
- •2.Энтропия. 2 закон термодинамики. 3 закон термодинамики.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •3Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
- •1.Зависимость электродных потенциалов от концентрации. Уравнение Нерста. Расчет энергии Гиббса окислительно-восстановительных процессов по эдс гальванического элемента.
- •2.Цепные реакции. Тепловой и разветвленно-цепной взрывы.
- •3.Типы растворов. Способы выражения концентрации. Идеальные и неидеальные растворы. Коллигативные свойства растворов. Законы Генри, Рауля, Вант-Гоффа.
- •1.Квантовомеханическое объяснение строения атома. Характеристика энергетического состояния ē квантовыми числами. Атомные орбитали. Принцип наименьшей энергии. Принцип Паули. Правило Хунда.
- •2. Энергия Гиббса и направление хим. Реакции.
- •2. Физическое равновесие. Фазовые равновесия. Понятие о фазовых диаграммах. Фазовая диаграмма воды.
- •3. Гальванические элементы. Электродвижущая сила (эдс) гэ. Электрохимический ряд напряжений металлов.
- •1.Периодический закон и его значение для неорганической химии. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
- •2.Катализ, катализаторы. Основные типы катализаторов. Принцип микроскопической обратимости. Ингибиторы.
- •3. Кислоты и основания. Кислотно-основные свойства по Аррениусу, Бренстеду-Лоури и Льюису.Амфотерность.
- •2. Энтальпия. Первый закон термодинамики. Правила термохимии. Закон Гесса.
- •3. Водородный показатель. Понятие об индикаторах. Кислотно-основное титрование. Буферные растворы.
- •1.Химия как наука о в-вах и их превращениях. Место химии в системе наук. Материя и энергия. Химическая форма энергии. Смеси и вещества. Анализ и синтез. Теплота и температура.
- •2.Водородная связь. Вандерваальсово взаимодействие. Размеры атомов и ионов.
- •3. Химическое равновесие. Константа равновесия. Химическое равновесие и катализ. Факторы, влияющие на смещение химического равновесия. Принцип Ле-Шателье.
- •1. Основные положения электронной теории валентности Косселя-Льюиса. Ионный и ковалентный характер связи. Формулы Льюиса.
- •2.Цепные реакции. Тепловой и разветвлено-цепной взрывы. Примеры.
- •3. Кислоты и основания. Кислотно-основные свойтсва по Аррениусу, Бренстеду-Лоури и Льюису. Примеры.
- •1. Квантово механическое объяснение строения атома. Характеристика энергетического состояния электрона квантовыми числами. Атомные орбитали. Принцип Паули. Правило Хунда.
- •2. Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
- •1.Температура
- •3 Равновесия. Обратимые и необратимые реакции. Константа равновесия. Условия смещения хим. Равновесия. Примеры. Хим. Равновесие и катализ.
- •1. Размеры атомов и ионов. Ионный, ковалентный, металлический и вандерваальсов радиусы.
- •2. Функции состояния системы. Энтальпия. Правила термохимии. Закон Гесса.
- •3. Идеальные и неидеальные растворы. Коллигативные св-ва растворов.
2. Факторы, влияющие на скорость химических реакций. Реакционный механизм. Переходное состояние промежуточная частица, промежуточное соединение.
Раздел химии, изучающий скорость химических реакций называется химической кинетикой.
Скорость химической реакции – число элементарных актов реакции, происходящих в единицу времени, в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций) раздела фаз. Мерой скорости хим. реакции называется количество вещества, вступившего в реакцию или образовавшегося при реакции за единицу времени в единице объема системы (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенной реакции).
V, моль·л/с

Vпрям
Vпрям=Vобратн
Vобратн
T, сек
Факторы влияющие на скорость хим реакции:
1.Температура
Правило Вант-Гоффа: при повышении t на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза.
Vt2=Vt1*γt1-t2/10 где γ – температурный коэффициент реакции.
2.Концентрация реаг.в-тв.(чем больше скорость х.р.,тембольше концентрация).
3.Площадь соприкасновения(только для тв.в-тв)чем больше площадь,тем быстрее идёт р-я.
4.Природы реагир.веществ.
5.Катализаторов– вещество, не расходующееся в результате протекания реакции, но ускоряющее р-ю.Ингибиторов-замедляющих.Промоторы-катализатор катализатора.
Зависимость скорости химической реакции от катализатора – катализатор снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, и эти стадии энергетически более доступны.
Бывают катализаторы как ускоряющие протекание реакции, так и замедляющие ее. В первом случае катализ называется положительным, а во втором - отрицательным.
Реакционный
механизм-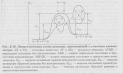
ПЕРЕХОДНОЕ СОСТОЯНИЕ (активированный комплекс), конфигурация системы атомных ядер и электронов, участвующих в элементарном акте химической реакции, в момент преодоления системой энергетического барьера, разделяющего ее начальное и конечное состояния. Теорию переходного состояния применяют для расчета скоростей химических реакций.
Промежуточная частица-
Промежут.соединение-
3 Равновесия. Обратимые и необратимые реакции. Константа равновесия. Условия смещения хим. Равновесия. Примеры. Хим. Равновесие и катализ.
Хим.равновесие-состояние системы, когда в ней протекает 2 проитвоположнонаправленных процесса с одинаковой скоростью.
Виды равновесия: 1) статическое состояние (стабильное-сущ.точка равновесия в кот.возвращается система после того,как она была выведена из нее;, нестабильное; метастабильное-сосояние неустойчивого равновесия,в кот.система может быть достаточно долгое время )
2) Динамическое равновесие подчиняется принципу Ле-Шателье: при всяком воздействии на систему, находящуюся в сост хим равновесия, в ней протекают процессы, приводящие к уменьшению этого воздействия. Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказать какое либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, которое уменьшит указанное воздействие. При постоянной Т отношение произведения равновесных концентраций продуктов реакции в степенях стехиометрических коэффициентов к произведению равновесных конц исх в-в в степенях стехиометричесикх коэффициентов есть величина постоянная и назыв константой равновесия данной реакции. Зависит только от температуры и природы реаг.в-тв. НЕ зависит-от катализатора и концентрации.
Физический смысл константы равновесия: показывает полноту протекания р-ии (∆G показывает глубину протекания)
Кр –> ∞ - необратимая, Кр=0 – не реагирует, ∆G = -RTlnKравн
Истинное равновесие неизменно во времени и наступает в соответствии с принципом микроскопической обратимости: все элементарные стадии обратимой р-ции должны быть равновесными.
Равновесные концентрации исх в-в – концентрация в-ва, не прореагир. к моменту равновесия.
Равновесные концентрации продуктов р-ии – та концентрация в-в, кот образовались к моменту равновесия.
Среди хим реакций нарялу с процессами, которые начинают протекать в одном направлении затем идут в обоих направлениях (за счет взаимодействия продуктов реакции) т.е. являются двусторонними встречаются и такие которые протекают практически односторонне до полного превращения исходных веществ,с образованием осадка,газа или воды.. Первые процессы к которым относится подавляющее большинство реакций принято называть химически обратимыми, вторые – химически необратимыми.
.
Факторы, влияющие на смещение равновесия:
Концентрация: увеличение концентрации исходных веществ ускоряет прямую реакции и смещает равновесии вправо (в сторону продуктов реакции), увеличение концентрации продуктов реакции увеличивает объем образовавшейся реакции и смещает равновесие влево.
Давление: если давление повышается, то равновесие смещается в сторону уменьшения объема реагирующей смеси, и если давление понижается то равновесие смещается в сторону увеличения объема реагирующей смеси.
Температура: при повышении температуры возрастает скорость как прямой так и обратной реакций, но в большей степени ускоряются эндотермические реакции, характеризующиеся большей величиной энергии активации.
.
Катализ – явление изменения скорости реакции под действием катализаторов. В присутствии катализатора меняется путь, по которому проходит суммарная реакция, образуются другие переходные состояния, с иными энергиями активации, а поэтому изменяется и скорость химической реакции. Катализатор увеличивет скорость как прямой так и обратной химической реакции, поэтому на смещние химического равновесия он не влияет. Ускорить р-ю с катализатором сожно,если Еактивации с катализатором будет мельше Еа. прямого пути.
Катализ:1-гомогенный-во всём объеме( 1-кисл-осн.2-ок-восст) 2-гетерогенный-на границе фаз.
При гом.и гет.катализе катализатор:сближает молекулы реагентов в пространстве, активирует связи в них,способствует образ.продукта.
Билет 30
