- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
4.2.3 Дикарбоновые кислоты
К классу дикарбоновых кислот относятся соединения, содержащие две карбоксильные группы. Дикарбоновые кислоты подразделяют в зависимости от типа углеводородного радикала:
насыщенные;
ненасыщенные;
ароматические.
Номенклатура дикарбоновых кислот аналогична номенклатуре монокарбоновых кислот (часть 2, глава 6.2):
тривиальная;
радикально-функциональная;
систематическая.
Примеры названия дикарбоновых кислот приведены в таблице 25.
Таблица 25 – Номенклатура дикарбоновых кислот
|
Структурная формула |
Название | ||
|
тривиальное |
систиматическая |
радикально-функциональная | |
|
|
щавелевая кислота |
этандиовая кислота |
– |
|
|
малоновая кислота |
пропандиовая кислота |
метандикарбоновая кислота |
|
|
янтарная кислота |
бутандиовая кислота |
этандикарбоновая-1,2 кислота |
|
|
глутаровая кислота |
пентандиовая кислота |
пропандикарбоновая-1,3 кислота |
|
|
адипиновая кислота |
гександиовая кислота |
бутандикарбоновая-1,4 кислота |
|
|
малеиновая кислота |
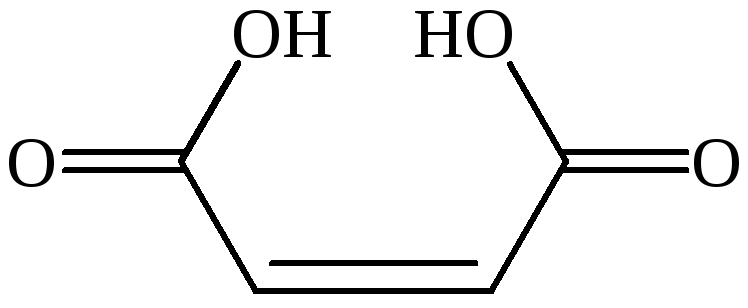
цис-бутендиовая кислота |
цис-этилендикарбоновая-1,2 кислота |
|
Продолжение таблицы 25 | |||
|
|
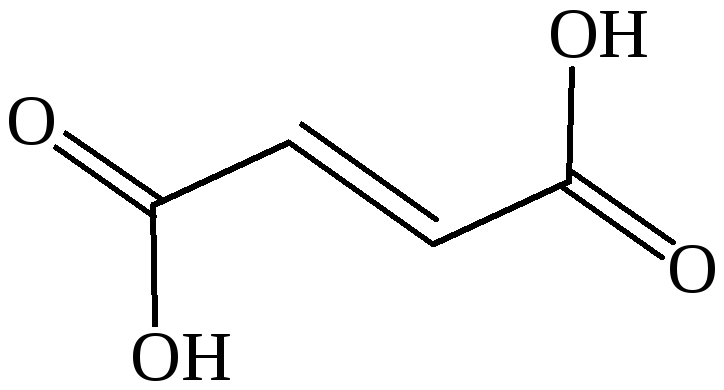
фумаровая кислота |
транс-бутендиовая кислота |
транс-этилендикар-боновая-1,2 кислота |
|
|
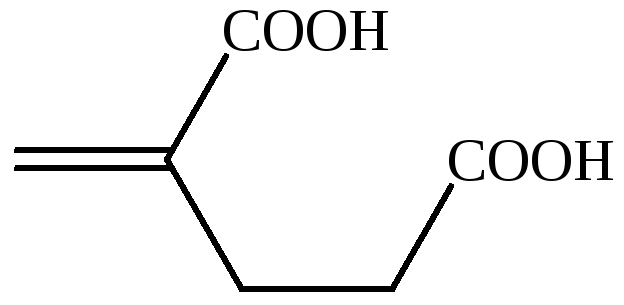
итаконовая кислота |
– |
пропен-2-дикарбоновая-1,2 кислота |
|
|
|
бутиндиовая кислота |
ацетилендикарбоновая кислота |
|
|
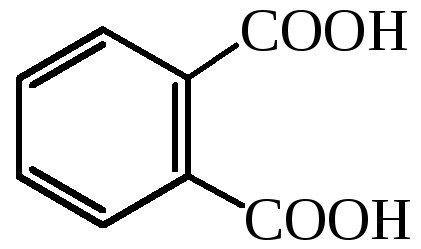
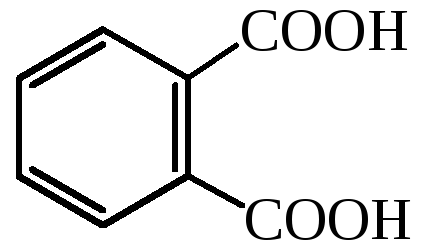
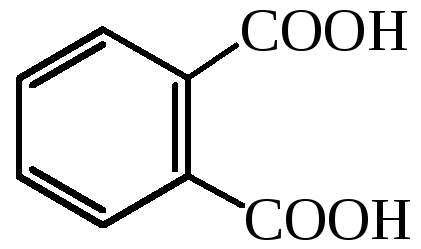
фталевая кислота |
– |
1,2-бензолдикарбоновая кислота |
|
|
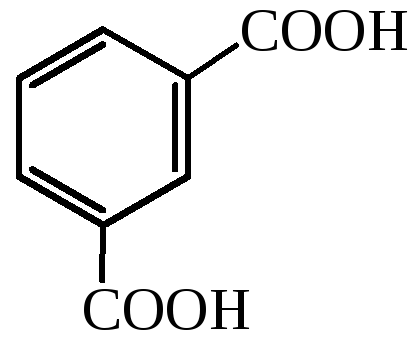
изофталевая кислота |
– |
1,3-бензолдикарбоновая кислота |
|
|
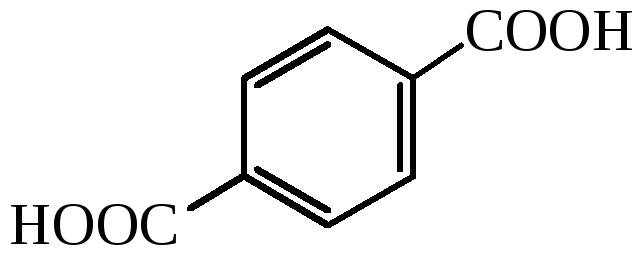
терефталевая кислота |
– |
1,4-бензолдикарбоновая кислота |
Изомерия. Для дикарбоновых кислот характерны следующие виды изомерии:
Структурная:
скелетная.
Пространственная:
оптическая.
Методы получения дикарбоновых кислот. Дикарбоновые кислоты получают с использованием тех же методов, что и в случае монокарбоновых кислот, за исключением нескольких специальных способов, применимых для отдельных кислот.
Общие способы получения дикарбоновых кислот
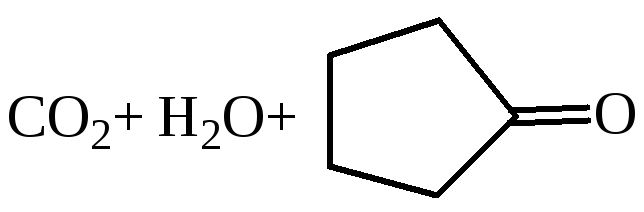
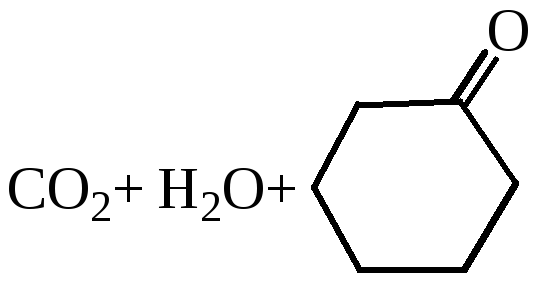
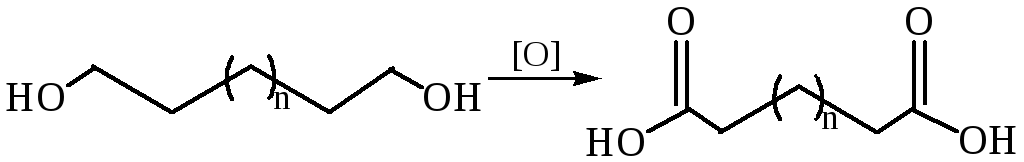
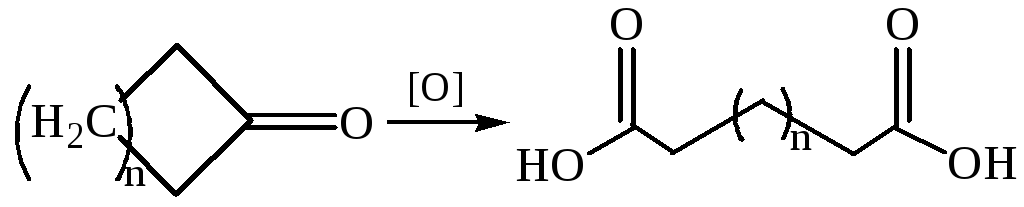
Окисление диолов и циклических кетонов:
Гидролиз нитрилов:
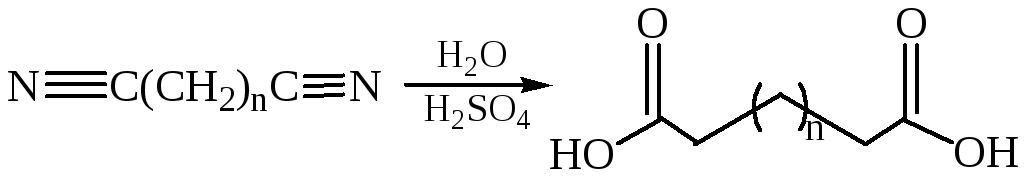
Карбонилирование диолов:
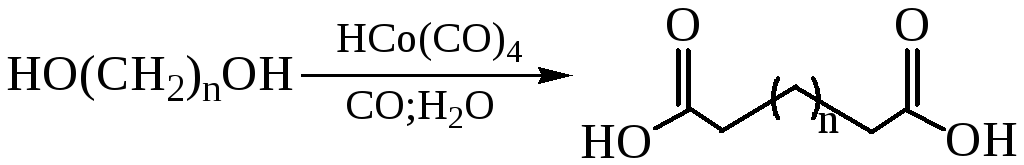
Получение щавелевой кислоты из формиата натрия сплавлением его в присутствии твердой щелочи:
![]()
Получение малоновой кислоты:
![]()
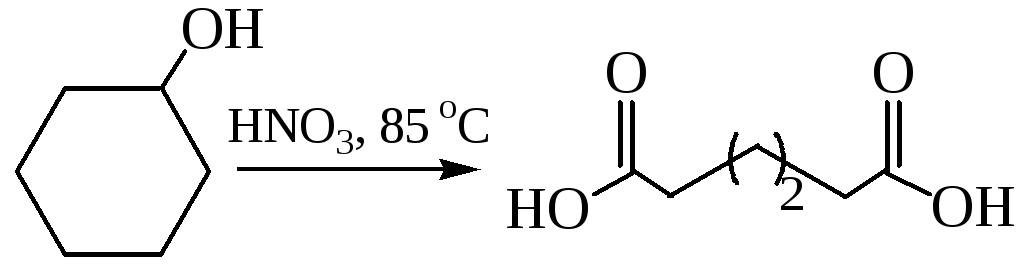
Получение адипиновой кислоты. В промышленности получается при окислении циклогексанола 50 % азотной кислотой в присутствии медно-ванадиевого катализатора:
Физические свойства дикарбоновых кислот. Дикарбоновые кислоты – твердые вещества. Низшие члены ряда хорошо растворимы в воде и лишь незначительно растворяются в органических растворителях. Растворяясь в воде, образуют межмолекулярные водородные связи. Граница растворимости в воде лежит при С6 – С7. Эти свойства кажутся вполне естественными, поскольку полярная карбоксильная группа составляет значительную часть в каждой из молекул.
Таблица 26 – Физические свойства дикарбоновых кислот
|
Название |
Формула |
Т.пл. °С |
Растворимость при 20 °С, г/100 г |
105×K1 |
105×K2 |
|
Щавелевая |
|
189 |
9 |
5400 |
5,2 |
|
Малоновая |
|
136 |
74 |
140 |
0,2 |
|
Янтарная |
|
185 |
6 |
6,4 |
0,23 |
|
Глутаровая |
|
98 |
64 |
4,5 |
0,38 |
|
Адипиновая |
|
151 |
2 |
3,7 |
0,39 |
|
Пимелиновая |
|
105 |
5 |
3.1 |
0,37 |
|
Пробковая (субериновая) |
|
144 |
0,2 |
3,0 |
0,39 |
|
Азелаиновая |
|
106 |
0,3 |
2,9 |
0,39 |
|
Себациновая |
|
134 |
0,1 |
2,6 |
0,4 |
|
Малеиновая |
|
130,5 |
79 |
1000 |
0,055 |
|
Фумаровая |
|
302 |
0,7 |
96 |
4,1 |
|
Фталевая |
|
231 |
0,7 |
110 |
0,4 |
Таблица 27 – Поведение дикарбоновых кислот при нагревании
|
Кислота |
Формула |
Ткип., °С |
Продукты реакции |
|
Щавелевая
|
|
160–180 |
СО2 + HCOOH |
|
Малоновая
|
|
140–160 |
СО2 + СН3СООН |
|
Янтарная |
|
300 |
|
|
Продолжение таблицы 27 | |||
|
Глутаровая |
|
300 |
|
|
Адипиновая |
|
300 |
|
|
Пимелиновая |
|
300 |
|
|
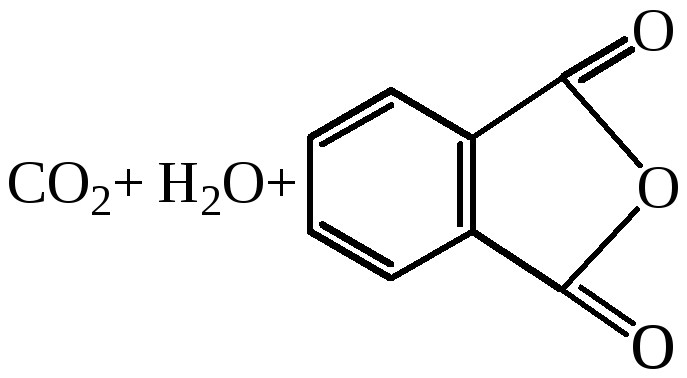
Фталевая |
|
230 |
|
Высокие температуры плавления кислот по сравнению с температурами плавления и кипения спиртов и хлоридов, по-видимому, обусловлены прочностью водородных связей. При нагревании дикарбоновые кислоты разлагаются с образованием различных продуктов.
Химические свойства. У двухосновных кислот сохраняются все общие для карбоновых кислот свойства. Дикарбоновые кислоты превращаются в соли и образуют те же производные, что и монокарбоновые (галогенангидриды, ангидриды, амиды, сложные эфиры), но реакции могут идти как по одной (неполные производные), так и по обеим карбоксильным группам. Механизм реакций образования производных тот же, что и у монокарбоновых кислот.
Двухосновные кислоты обнаруживают также ряд особенностей, обусловленных влиянием двух СООН-групп.
Кислотные свойства. У дикарбоновых кислот по сравнению с предельными одноосновными кислотами повышены кислотные свойства (средние константы ионизации, таблица 26). Причиной этого является не только дополнительная диссоциация по второй карбоксильной группе, поскольку ионизация второго карбоксила протекает значительно труднее и вклад в кислотные свойства второй константы едва заметен.
Электроноакцепторная группа, как известно, вызывает увеличение кислотных свойств карбоновых кислот, так как повышение положительного заряда на карбоксильном атоме углерода способствует усилению мезомерного эффекта р,π-сопряжения, что, в свою очередь, усиливает поляризацию связи О–Н и облегчает ее диссоциацию. Этот эффект выражен тем больше, чем ближе друг к другу расположены карбоксильные группы. Токсичность щавелевой кислоты связана, прежде всего, с ее высокой кислотностью, величина которой приближается к таковой у минеральных кислот. Учитывая индуктивный характер влияния, понятно, что в гомологическом ряду дикарбоновых кислот кислотные свойства резко убывают по мере удаления карбоксильных групп друг от друга.
Дикарбоновые кислоты ведут себя как двухосновные и образуют два ряда солей – кислые (с одним эквивалентом основания) и средние (с двумя эквивалентами):
![]()
![]()
Реакции нуклеофильного замещения. Дикарбоновые кислоты, подобно монокарбоновым, вступают в реакции нуклеофильного замещения с участием одной или двух функциональных групп и образуют функциональные производные – сложные эфиры, амиды, хлорангидриды.

За счет высокой кислотности самой щавелевой кислоты ее сложные эфиры получают без применения кислотных катализаторов.
3. Специфические реакции дикарбоновых кислот. Взаимное расположение карбоксильных групп в дикарбоновых кислотах существенно влияет на их химические свойства. Первые гомологи, в которых СООН-группы сближены, – щавелевая и малоновая кислоты – способны при нагревании отщеплять оксид углерода (IV), в результате чего удаляется карбоксильная группа. Способность к декарбо-ксилированию зависит от строения кислоты. Монокарбоновые кислоты теряют карбоксильную группу труднее, только при нагревании их солей с твердыми щелочами. При введении в молекулы кислот ЭА заместителей склонность их к декарбоксилированию возрастает. В щавелевой и малоновой кислотах вторая карбоксильная группа выступает в качестве такого ЭА и тем самым облегчает декарбоксилирование.
3.1
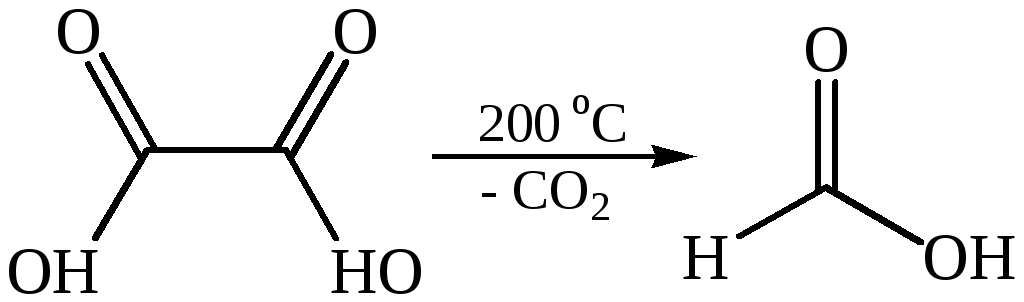
3.2
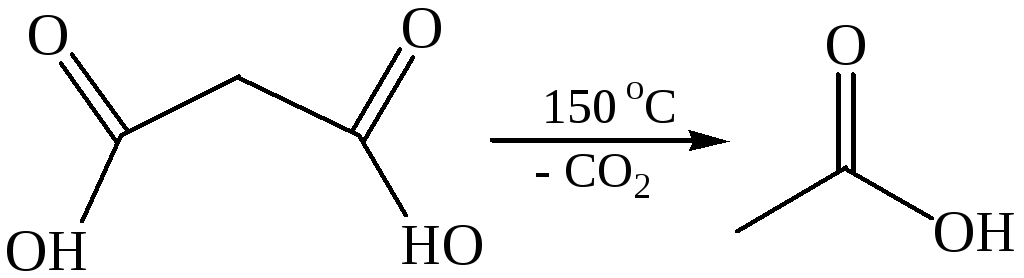
Декарбоксилирование щавелевой кислоты используется как лабо-раторный метод синтеза муравьиной кислоты. Декарбоксилирование производных малоновой кислоты является важным этапом в синтезе карбоновых кислот. Декарбоксилирование ди- и трикарбоновых кислот характерно для многих биохимических процессов.
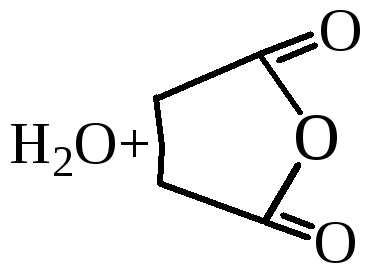
По мере удлинения углеродной цепи и удаления функциональных групп ослабевает их взаимное влияние. Поэтому следующие два члена гомологического ряда – янтарная и глутаровая кислоты – при нагревании не декарбоксилируются, а теряют молекулу воды и образуют циклические ангидриды. Такой ход реакции обусловлен образованием устойчивого пяти- или шестичленного цикла.
3.3
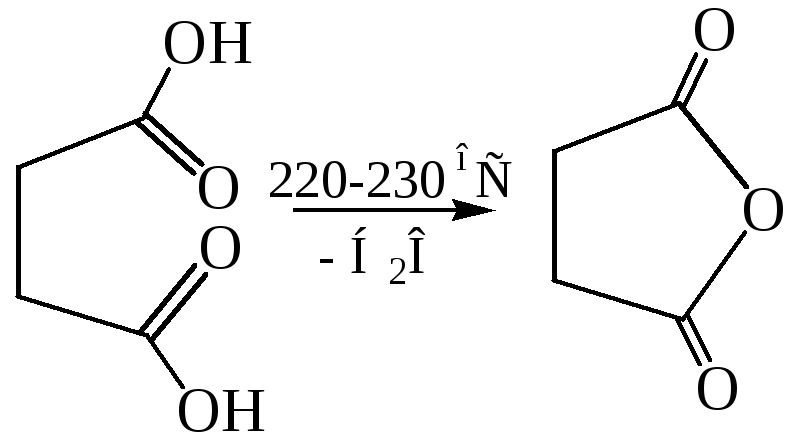
3.4 Прямой этерификацией кислоты могут быть получены ее полные эфиры, а взаимодействием ангидрида с эквимольным количеством спирта – соответствующие кислые эфиры:
3.4.1
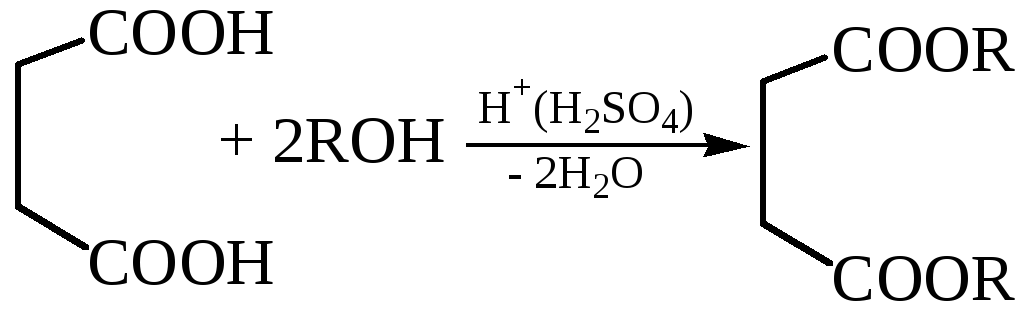
3.4.2
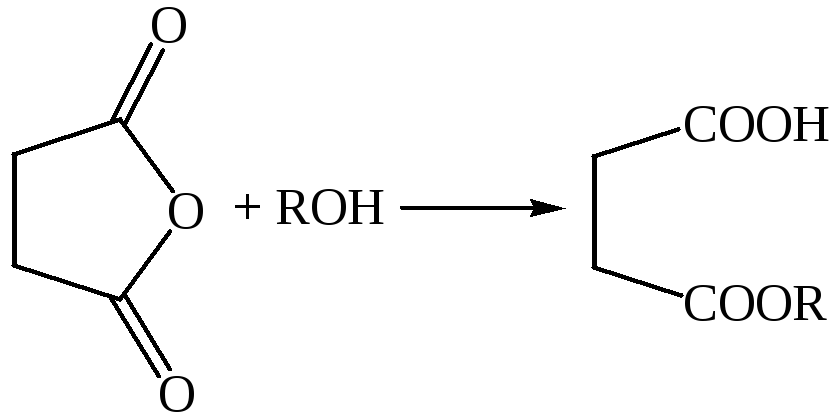
3.5 Получение имидов. Нагреванием аммонийной соли янтарной кислоты получают ее имид (сукцинимид). Механизм этой реакции такой же, как при получении амидов монокарбоновых кислот из их солей:
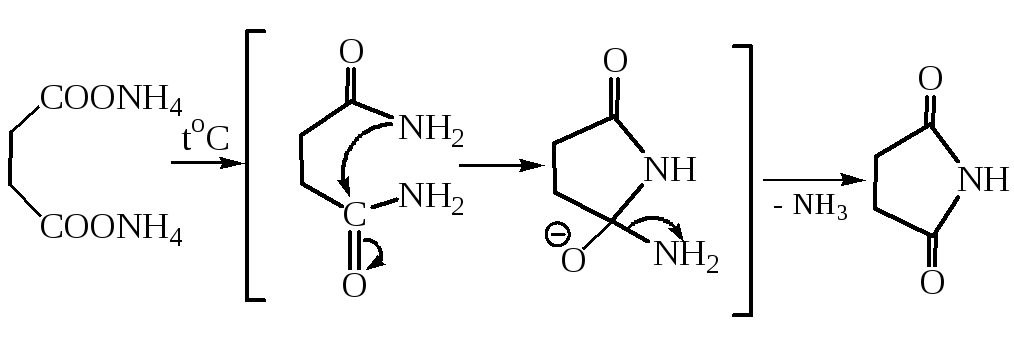
В сукцинимиде атом водорода в иминогруппе обладает значительной протонной подвижностью, что вызвано электроноакцепторным влиянием двух соседних карбонильных групп. На этом основано получение N-бром-сукцинимида – соединения, широко используемого в качестве бромирую-щего агента для введения брома в аллильное положение:
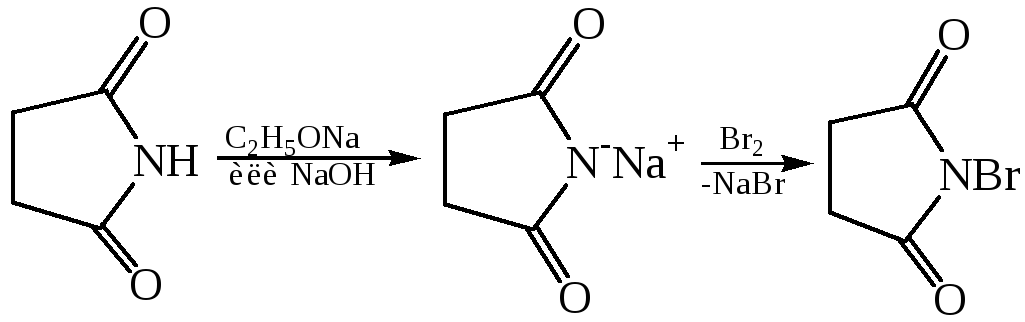
Отдельные представители. Щавелевая (этандновая) кислота НООС–СООН. В виде солей содержится в листьях щавеля, кислицы, ревеня. Соли и эфиры щавелевой кислоты имеют тривиальное название оксалаты. Щавелевая кислота проявляет восстановительные свойства:
![]()
Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. При нагревании в присутствии серной кислоты происходит декарбоксилирование щавелевой кислоты с последующим разложением образовавшейся муравьиной кислоты:
![]()
Качественной реакцией для обнаружения щавелевой кислоты и ее солей служит образование нерастворимого оксалата кальция.
![]()
Щавелевая кислота легко окисляется, количественно превращаясь при этом в диоксид углерода и воду:
![]()
Реакция настолько чувствительна, что ее используют в объемном анализе для установления титров растворов перманганата калия.
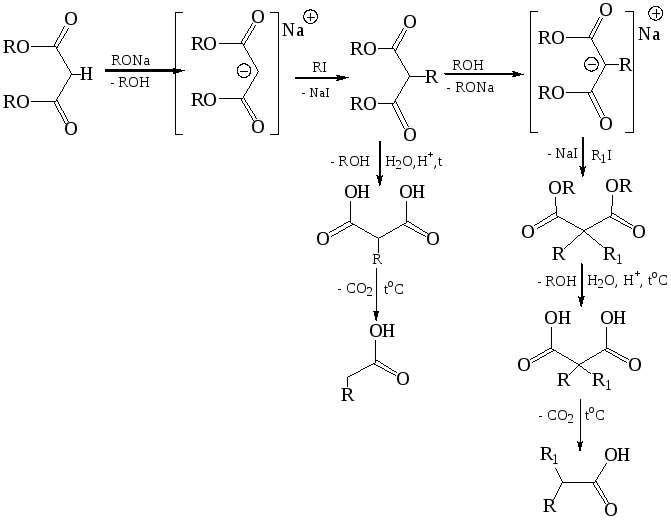
Малоновая (пропандиовая) кислота НООС–СН2–СООН. Содержится в соке сахарной свеклы. Малоновую кислоту отличает значительная протонная подвижность атомов водорода в метиленовой группе, обусловленная электроноакцепторным влиянием двух карбоксильных групп.
Водородные атомы метиленовой группировки настолько подвижны, что могут замещаться на металл. Однако со свободной кислотой это превращение невозможно, так как водородные атомы карбоксильных групп значительно подвижнее и замещаются в первую очередь.
Заместить α-водородные атомы метиленовой группы на натрий возможно, лишь защитив карбоксильные группы от взаимодействия, что позволяет сделать полная этерификация малоновой кислоты:
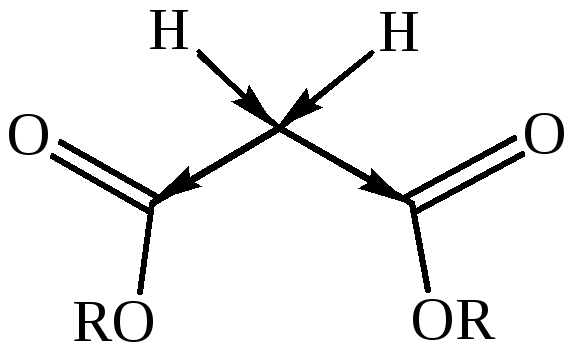
Малоновый эфир при взаимодействии с натрием, отщепляя водород, образует натрий-малоновый эфир:
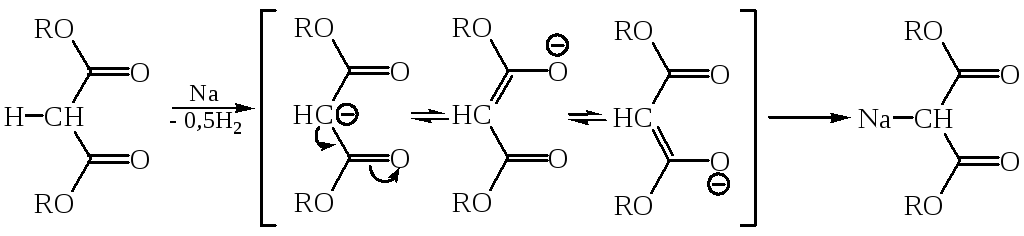
Анион Na-малонового эфира стабилизирован сопряжением НЭП атома углерода с π-электронами связей С=О. Na-малоновый эфир, как нуклеофил, легко вступает во взаимодействие с молекулами, содержащими электрофильный центр, например, с галогеналканами:
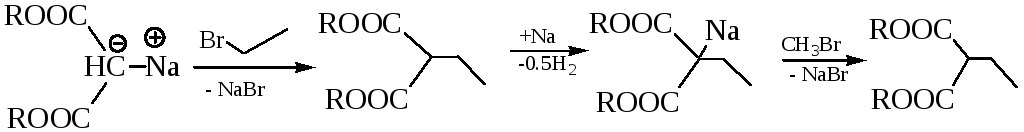
Пречисленные реакции позволяют использовать малоновую кислоту для синтеза ряда соединений:
Янтарная кислота представляет собой бесцветное кристаллическое вещество с т. пл. 183 °С, растворяется в воде и спиртах. Янтарная кислота и ее производные достаточно доступны и находят широкое применение в органическом синтезе.
Адипиновая (гександиовая) кислота НООС–(СН2)4–СООН. Представляет собой бесцветное кристаллическое вещество с т. пл. 149 °С, мало растворима в воде, лучше – в спиртах. Большое количество адипиновой кислоты идет на изготовление полиамидного волокна нейлона. Благодаря своим кислотным свойствам адипиновая кислота используется в быту для удаления накипи с эмалированной посуды. Она реагирует с карбонатами кальция и магния, переводя их в растворимые соли, и в то же время не портит эмаль, как сильные минеральные кислоты.