
- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
1. Реакции карбоновых кислот с нуклеофильными реагентами
1.1 Oбразование солей с металлами:
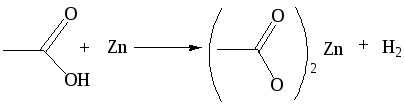
1.2 Взаимодействие с оксидами металлов:
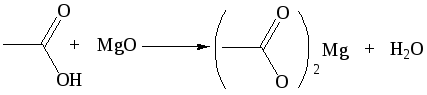
1.3 Взаимодействие с основаниями:
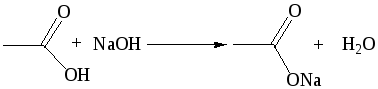
1.4 Взаимодействие с аммиаком:
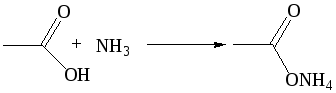
1.5 Образование галогенангидридов:
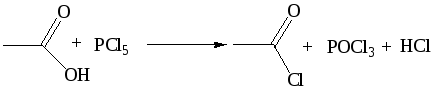
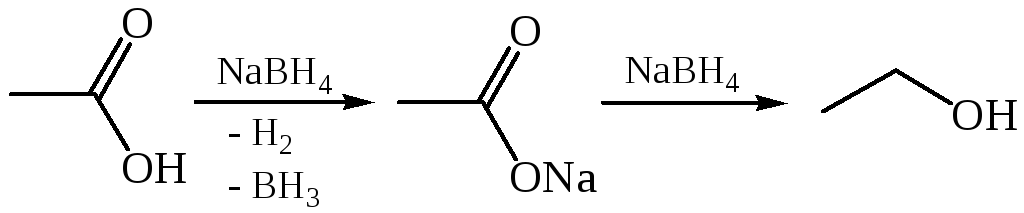
1.6 Реакции с Н-нуклеофилами (комплексными гидридами). Комплексные гидриды при взаимодействии с карбоновыми кислотами выделяют водород и образуют карбоксилаты, которые в избытке реагента и при более жестких условиях восстанавливаются до первичных спиртов:
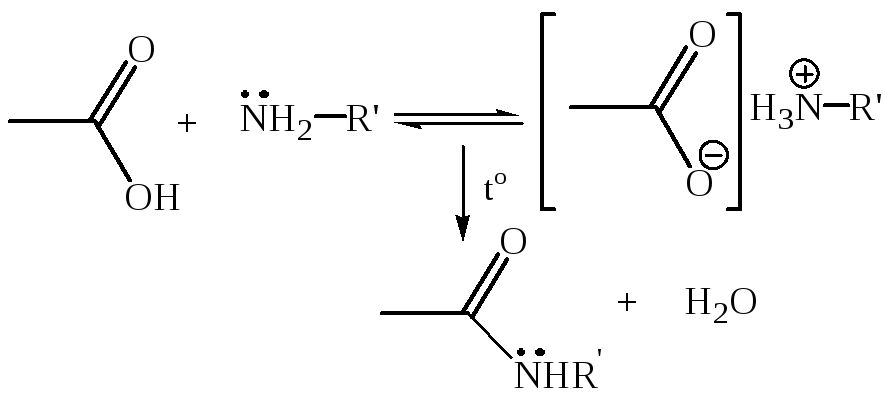
1.7 Реакции с N-нуклеофилами. N-Hуклеофилы (аммиак, амины, гидразин и др.) при взаимодействии с карбоновыми кислотами, как правило, образуют аммониевые карбоксилаты и только при повышенных температурах происходит присоединение к карбонильной группе и получаются амиды:
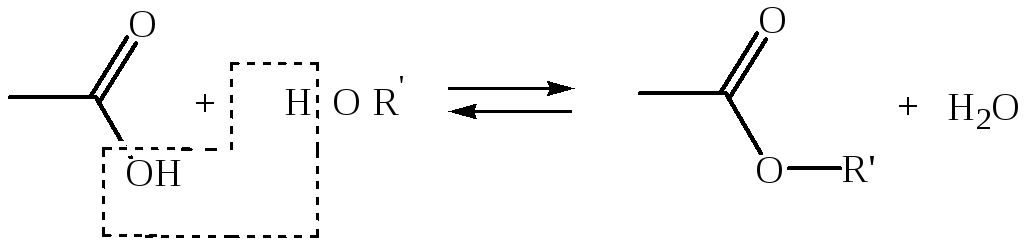
1.8 Реакции с О-нуклеофилами (реакция этерификации по Фишеру). O-Hуклеофилы нейтрального характера, например, спирты, реагируют и образуют сложные эфиры (часть 2, главы 3.1, 6.3.4):
2. Реакции с электрофильными реагентами. Карбоновые кислоты, как очень слабые нуклеофилы, взаимодействуют только с особенно сильными реагентами, присоединение происходит по кислородному атому. Для осуществления реакции с более слабыми электрофильными реагентами необходимо карбоксильную группу активировать, что осуществляется превращением ее в карбоксилат-ион. Тогда можно осуществить реакции алкилирования, ацилирования и др.
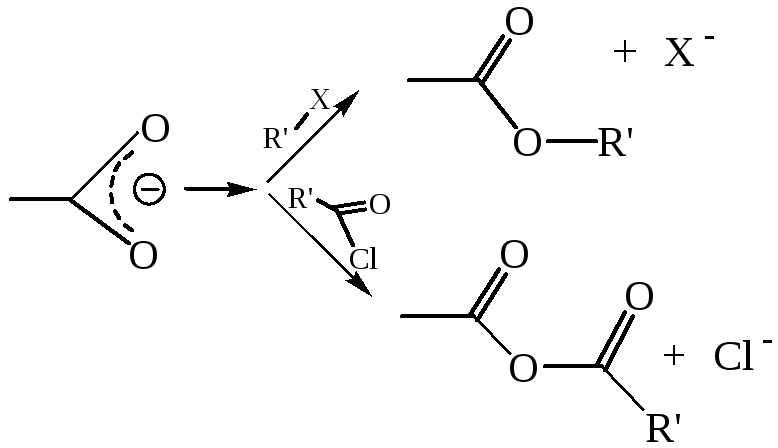
3. Реакции нуклеофильного замещения у карбоновых кислот, идут по электрофильному центру ацила и имеют одинаковый в главных стадиях механизм, который называется тетраэдрическим, характерный для всех классов функциональных производных карбоновых кислот. Реакция заключается в «передаче» ацила от субстрата к нуклеофильному реагенту, поэтому процесс называется реакцией ацилирования, а субстрат – ацилирующим агентом. По реагенту реакции ацилирования различают как гидролиз (нуклеофильный реагент – вода), алкоголиз (спирт), аммонолиз (аммиак), ацидолиз (кислота) и некоторые другие. Скорость реакций ацилирования при равных внешних условиях определяется природой субстрата (ацилирующего агента) и нуклеофила. Механизм реакций ацилирования можно представить следующей общей схемой:
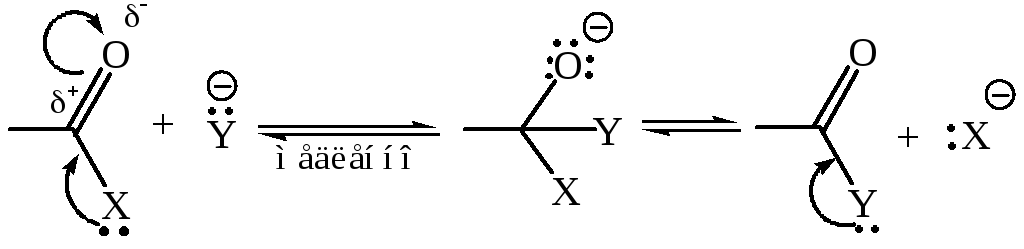
Таким образом, реакции ацилирования протекают в две стадии:
присоединение к карбонильному атому углерода нуклеофила за счет собственной пары электронов, сопровождающееся гетеролизом π-связи, эта стадия протекает по AN механизму и является лимитирующей;
отщепление уходящей группы, протекающее очень легко, так как в результате происходит восстановление сопряженной системы.
По своему результату реакции ацилирования могут быть отнесены к реакциям SN2. От обычных SN2 реакций у алкилгалогенидов и спиртов, протекающих у насыщенного реакционного центра, они отличаются тем, что являются двухстадийными и протекают более легко. Большая скорость реакций ацилирования в сравнении со скоростью SN реакций у насыщенного атома углерода объясняется следующим образом:
реакционный центр в ацильной группе более положителен;
меньше стерические препятствия при атаке нуклеофила вследствие плоского строения реакционного центра в исходном субстрате и наличия в промежуточном аддукте у реакционного центра только четырех заместителей.
Скорость SN реакций может уменьшаться при увеличении размера нуклеофила. Поскольку лимитирующей стадией реакции ацилирования является AN стадия, то реакционную способность ацилирующего средства определяет величина δ+ на карбонильном углероде. Следовательно, чем выше электроноакцепторное действие заместителя X, тем больше величина δ+ на реакционном центре и тем выше скорость ацилирования. В силу этого ацилирующие средства можно расположить в порядке уменьшения их ацилирующей способности следующим образом:
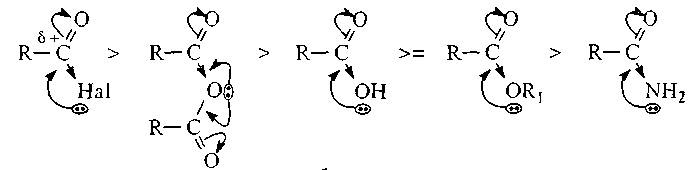
Соли карбоновых кислот ацилирующей способностью не обладают, так как в карбоксилатанионе на карбонильном углероде вследствие делокализации электронов слишком низок δ+ и атом углерода теряет способность подвергаться атаке нуклеофила.
Как видно из механизма реакции, от промежуточного аддукта может отщепляться не только группа X–, но и группа Y+, т. е. может идти и обратная реакция. Поэтому многие реакции ацилирования – равновесные процессы. Положение равновесия зависит от соотношения скоростей прямой и обратной реакций, и в результате превращения всегда будет образовываться менее реакционноспособное вещество. Поэтому активность ацилирующего средства влияет не только на скорость реакции ацилирования, но и на положение равновесия. В случае использования сильных ацилирующих средств (хлорангидридов и ангидридов) равновесие сильно сдвинуто вправо и реакции можно считать необратимыми. Если же различие в реакционной способности субстрата и продукта реакции невелико, то резкого смещения равновесия реакции не наблюдается, т. е. реакция обратима. Так, сильные ацилирующие агенты хлорангидриды и ангидриды легко реагируют со спиртами и аммиаком с образованием сложных эфиров и амидов. Сложные эфиры реагируют с аммиаком с образованием амидов. Однако обратные реакции – образование сложных эфиров из амидов, – хотя и возможны, но их довольно трудно осуществить.
В ряде случаев ацилирование проводят в условиях либо кислотного, либо основного катализа. Поскольку реакция начинается с нуклеофильного присоединения к карбонильной группе, роль катализатора при ацилировании аналогична роли катализатора в AN реакциях альдегидов и кетонов.
