- •4. Общие закономерности строения и химического поведения оксосоединений
- •4.1 Оксосоединения
- •3. Технические способы получения формальдегида
- •3.1 Каталитическое окисление метанола:
- •3.2 Каталитическое окисление метана:
- •11. Специфические методы для ароматического ряда
- •1. Реакции нуклеофильного присоединения
- •1.1 Присоединение магнийалкилов:
- •2.1 Образование иминов и оксимов:
- •2.2 Образование гидразонов:
- •5. Реакции окисления альдегидов и кетонов
- •5.2.1 Окисление циклических кетонов:
- •6. Реакции окисления-восстановления (диспропорционирования)
- •8.4.1 Синтез коричного альдегида:
- •8.4.2 Синтез бензаль- и дибензальацетона:
- •4.2 Карбоновые кислоты и их производные
- •4.2.1 Монокарбоновые кислоты
- •1. Реакции карбоновых кислот с нуклеофильными реагентами
- •4. Реакции α-водородного атома
- •4.2.2 Производные карбоновых кислот
- •1. Взаимодействие с хлоридом фосфора (V):
- •2. Взаимодействие с тионилхлоридом:
- •1. Гидролиз:
- •1. Ацилирование аммиака:
- •1.1 Щелочной гидролиз:
- •1.2 Кислотный гидролиз:
- •3. Реакция аммонолиза:
- •4.2.3 Дикарбоновые кислоты
- •4.2.4 Непредельные карбоновые кислоты
- •4.2.4.1 Одноосновные кислоты этиленового ряда
- •2. Гидролиз акрилонитрила:
- •1. Из ацетона и синильной кислоты:
- •4.2.4.2 Непредельные дикарбоновые кислоты
- •4.2.5 Жиры
- •Особенности физических свойств гомо-функциональных производных углеводородов
- •Экологические проблемы производства и применения гомофункциональных производных углеводородов
4.2 Карбоновые кислоты и их производные
Карбоновые кислоты – это производные углеводородов, содержащие в молекуле карбоксильную функциональную группу (–СООН). Это наиболее «окисленная» функциональная группа, что легко проследить, рассматривая ряд: алканы, спирты, альдегиды, карбоновые кислоты – в котором последовательно возрастает доля кислорода в составе молекул.
Классификация карбоновых кислот. Карбоновые кислоты подразделяются в зависимости:
от числа карбоксильных групп;
природы углеводородного заместителя (насыщенные, ненасыщенные или ароматические).
Углеводородный заместитель не оказывает сильного влияния на карбоксильную группу, поэтому число карбоксильных групп в молекуле является главным классификационным признаком. Различают:
монокарбоновые или одноосновные кислоты;
ди-(двухосновные) и поликарбоновые (полиосновные) кислоты.
Номенклатура карбоновых кислот:
тривиальная;
радикально-функциональная;
рациональная;
систематическая.
Тривиальная номенклатура. Многие карбоновые кислоты сохраняют часто связанные с природным источником их выделения – муравьиная (от лат. formica – муравей), уксусная (от лат. acetum – уксус), масляная (от лат. buturum – масло), янтарная и др.
Радикально-функциональная номенклатура. Для ряда кислот используется карбоновая номенклатура, в которой кислоты рассматривают как продукты замещения водородных атомов углеводорода на карбоксильную группу.
Рациональная номенклатура. Основные положения номенклатуры изложены в части 1, главе 4. Например, в основе названий алифатических монокарбоновых кислот лежит название второго члена гомологического ряда – уксусная кислота, исключение составляет муравьиная кислота.
Систематическая номенклатура. Названия карбоновых кислот образуют из названия углеводорода, соответствующего главной цепи, окончания «овая кислота» и указанием количества карбоксильных групп. Нумерацию начинают от атома углерода карбоксильной группы. Основные принципы номенклатуры карбоновых кислот изложены в части 1, глава 4.
4.2.1 Монокарбоновые кислоты
Монокарбоновые кислоты – это производные углеводородов, содержащие в молекуле одну функциональную карбоксильную группу – СООН. Монокарбоновые кислоты называют также одноосновными, поскольку их молекула может связывать один эквивалент основания.
Классификация. Монокарбоновые кислоты обычно подразделяют в зависимости от природы углеводородного остатка:
насыщенные;
ненасыщенные;
ароматические.
Номенклатура монокарбоновых кислот. Спецификой номенклатуры карбоновых кислот является широкое применение в обиходе:
тривиальных названий;
рациональной номенклатуры;
радикально-функциональной номенклатуры;
систематической номенклатуры.
Примеры названий монокарбоновых кислот приведены в таблице 23.
При отрыве от карбоксильной группы гидроксила возникает ацильный радикал (от лат. acidum – кислота).
Названия радикалов производят от корня латинского названия кислоты и суффикса -ил. Например, формил, ацетил, пропионил, бутерил.
Отнятием от карбоксильной группы водородного атома получают ацилоксигруппу.
Остаток –СН2СООН называют карбоксиметильной (оксикарбонилметильной) группой.
Таблица 23 – Примеры названий монокарбоновых кислот
|
Формула |
Номенклатура | ||
|
тривиальная |
рациональная |
ИЮПАК | |
|
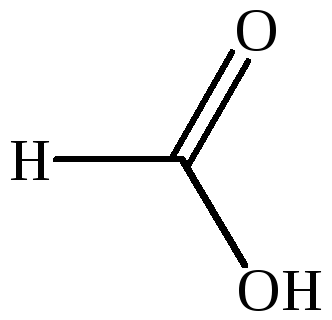
HCOOH |
муравьиная |
– |
метановая |
|
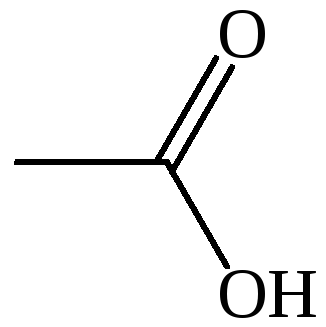
CH3COOH |
уксусная |
уксусная |
этановая |
|
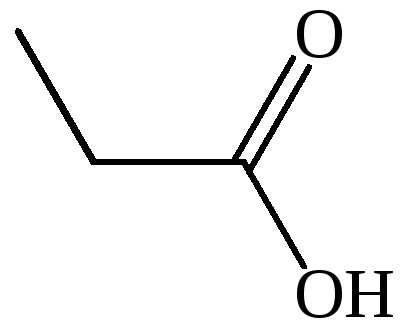
CH3CH2COOH |
пропионовая |
метилуксусная |
пропановая |
|
CH3CH2CH2COOH |
масляная |
этилуксусная |
бутановая |
|
(CH3)2CHCOOH |
изомасляная |
диметилуксусная |
2-метилпропановая |
|
CH3(CH2)3COOH |
валериановая |
пропилуксусная |
пентановая |
|
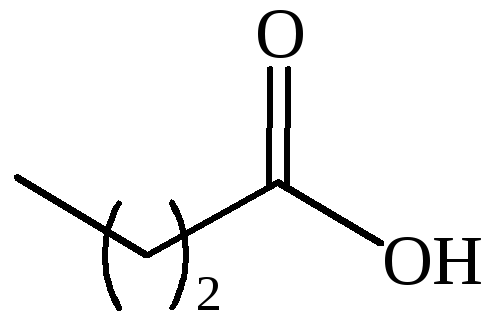
(CH3)2CHCH2COOH |
изовалериановая |
изопропилуксусная |
3-метилбутановая |
|
(CH3)3CCOOH |
пиваловая |
триметилуксусная |
2,2-диметилпропановая |
|
CH3(CH2)4COOH |
капроновая |
бутилуксусная |
гексановая |
|
CH3(CH2)5COOH |
энантовая |
амилуксусная |
гептановая |
|
CH3(CH2)6COOH |
каприловая |
– |
октановая |
|
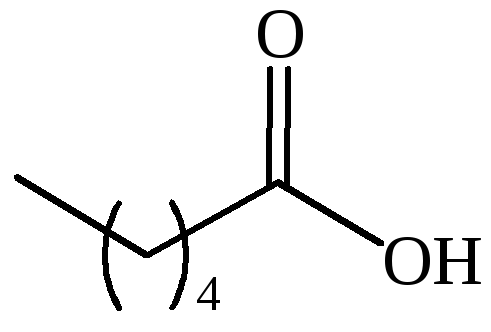
CH3(CH2)7COOH |
пеларгоновая |
– |
нонановая |
|
Продолжение таблицы 23 | |||
|
CH3(CH2)8COOH |
каприновая |
– |
декановая |
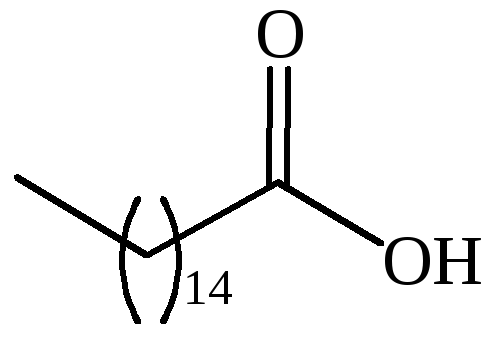
|
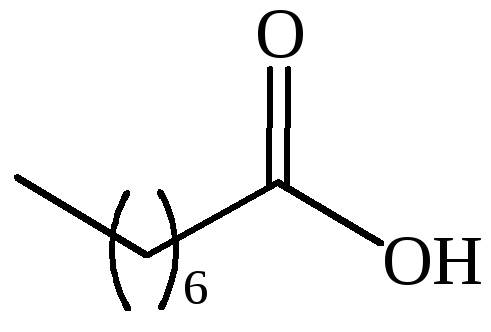
CH3(CH2)14COOH |
пальмитиновая |
– |
гексадекановая |
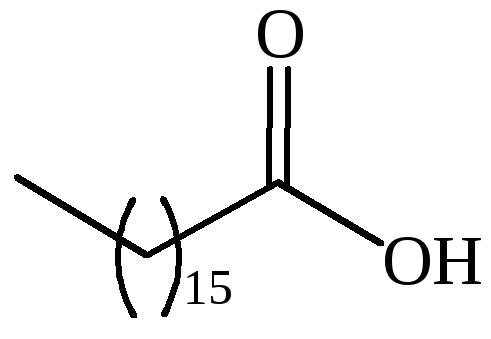
|
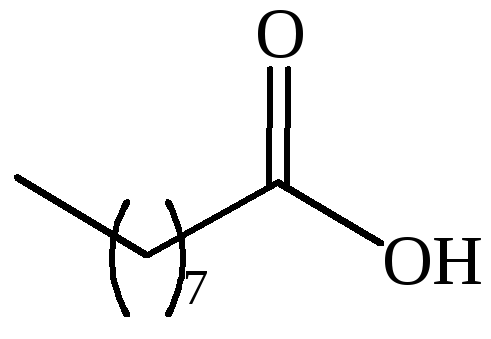
CH3(CH2)15COOH |
маргариновая |
– |
гептадекановая |
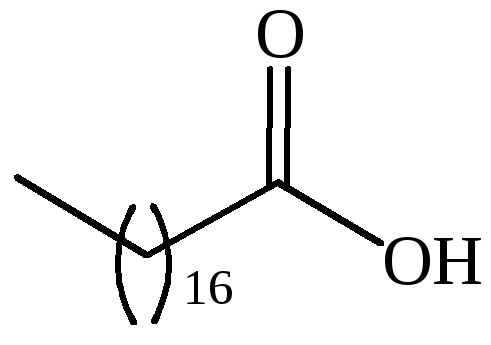
|
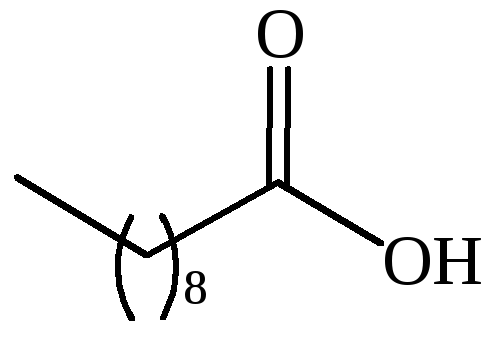
CH3(CH2)16COOH |
стеариновая |
– |
октодекановая |
Изомерия
Структурная:
скелетная;
метамерия
Пространственная:
оптическая.
Методы синтеза. Монокарбоновые кислоты получают окислением органических соединений, гидролизом галогенпроизводных, путем превращения металлорганических соединений. Промышленно важным методом является реакция карбонилирования спиртов, эфиров, галогенуглеводородов. Известны также многие специфические методы получения карбоновых кислот.
Реакции окисления (часть 1, главы 8.1, 8.2, 8.3,8.5.1, 8.5.2; часть 2, главы 3.1, 6.1).
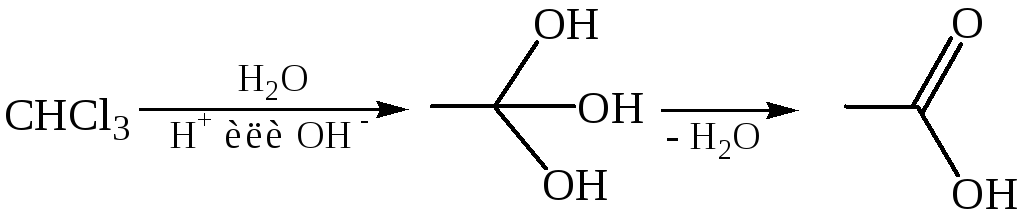
Реакции гидролиза. Карбоновые кислоты обычно получают гидролизом соединений, содержащих трихлорметильную группу и цианогруппу (нитрилы), иногда гидролизом сложных эфиров и амидов:
Гидролиз сложных эфиров (в частности, природных жиров):
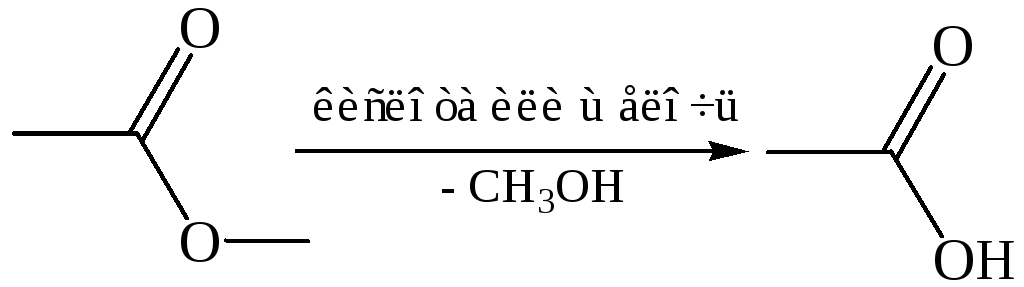
Гидролиз нитрилов. Нитрилы являются производными карбоновых кислот, так как превращаются в них при кислотном или щелочном гидролизе. Эта связь с рядом карбоновых кислот отражается и в названиях нитрилов, которые производятся от названий соответствующих кислот (ацетонитрил, пропионитрил и т. д.):

Гидролиз соединений, содержащих трихлорметильную группу:
|
|
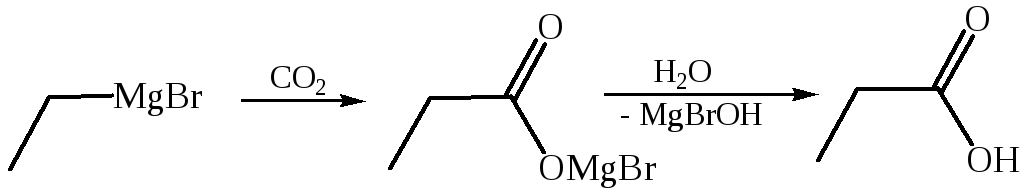
3. Металлорганический синтез. Карбоновые кислоты образуются при действии на смешанные магнийорганические соединения оксидом углерода (IV):
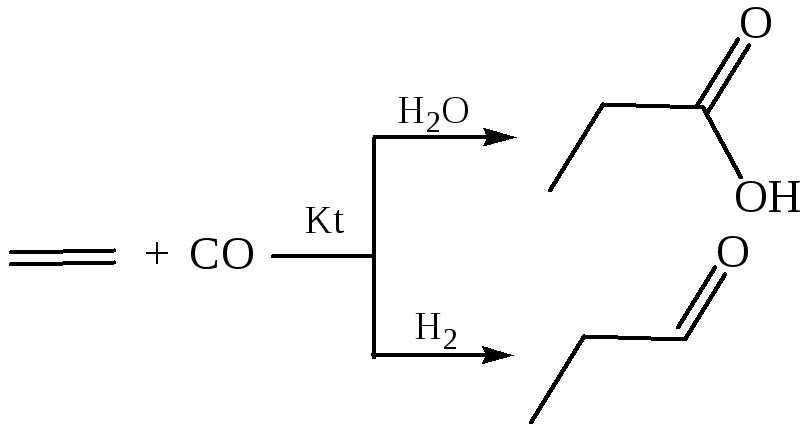
4. Реакции карбонилирования. Оксид углерода (II) в присутствии специальных катализаторов при повышенной температуре под давлением реагирует со спиртами, галогенуглеводородами, простыми и сложными эфирами с образованием карбоновых кислот:
|
|
где X = OH, OR,OOCR1, галоген
Алкены в этих условиях также дают карбоновые кислоты. При карбонилировании алкенов в присутствии водорода получаются альдегиды:
|
|
Реакции карбонилирования являются промышленными способами получения некоторых кислот.
Синтез кислот с увеличением углеродного скелета (реакция Арндта-Эйстера) (часть 2, глава 2). При использовании диазометана можно удлинить цепь углеродных атомов карбоновой кислоты на один углеродный атом:

Получение муравьиной кислоты
6.1
|
|
6.2
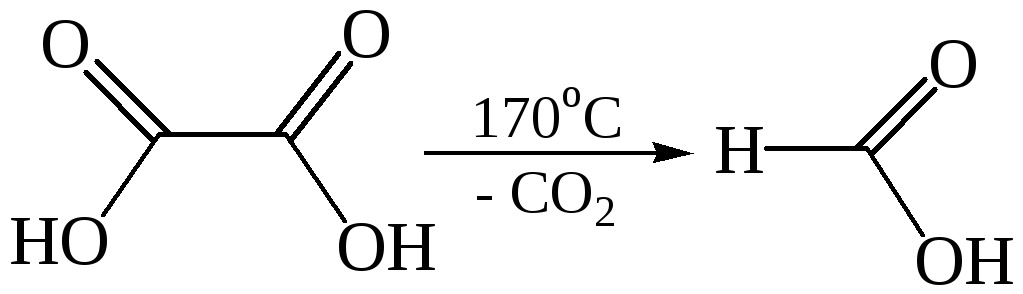
Физические свойства. Структура, температура кипения, межмолекулярные водородные связи. Низшие монокарбоновые кислоты (С1 – С4) представляют собой бесцветные жидкости, высшие алифатические и ароматические кислоты – твердые вещества. Первые гомологи – муравьиная, уксусная и пропионовая кислоты – обладают резким раздражающим запахом, при попадании на слизистые оболочки вызывают ожоги; с водой смешиваются в любых соотношениях.
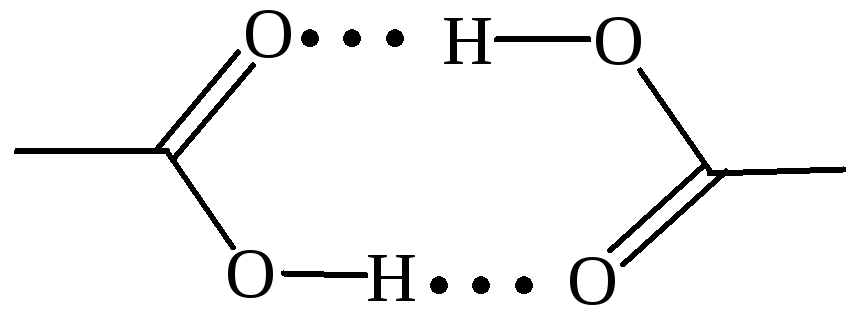
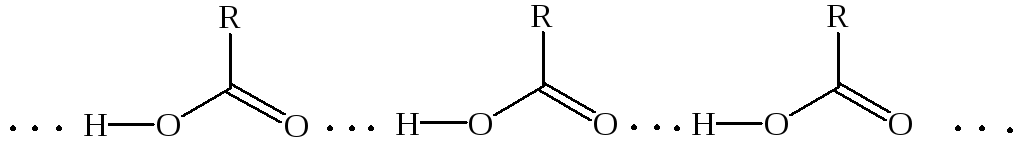
Молекулы карбоновых кислот полярны и, подобно молекулам спиртов, могут образовывать водородные связи друг с другом и с молекулами других типов. Карбоновые кислоты имеют весьма высокие температуры кипения, что свидетельствует о значительной межмолекулярной ассоциации вследствие образования межмолекулярных водородных связей, причем образуются как циклические димеры, так и линейные олигомеры:
|
|
|
Таблица 24 – Физические свойства монокарбоновых кислот
|
№ |
Название кислоты |
Формула |
Тпл, °С |
Ткип, °С |
|
1 |
Муравьиная |
|
8,4 |
100,7 |
|
2 |
Уксусная |
|
16,7 |
118,1 |
|
3 |
Пропионовая |
|
–22 |
141,1 |
|
4 |
Масляная |
|
–6,5 |
163,5 |
|
4 |
изо-Масляная |
|
–47 |
154,4 |
|
Продолжение таблицы 24 | ||||
|
5 |
Валериановая |
|
–34,5 |
187 |
|
6 |
Капроновая |
|
–9,5 |
205 |
|
7 |
Энантовая |
|
–10 |
223,5 |
|
8 |
Каприловая |
|
16 |
237,5 |
|
9 |
Пеларгоновая |
|
21,3 |
254 |
|
10 |
Каприновая |
|
31,2 |
270 |
|
11 |
Пальмитиновая |
|
63 |
269 |
|
12 |
Маргариновая |
|
61,2 |
– |
|
13 |
Стеариновая |
|
70 |
287 |
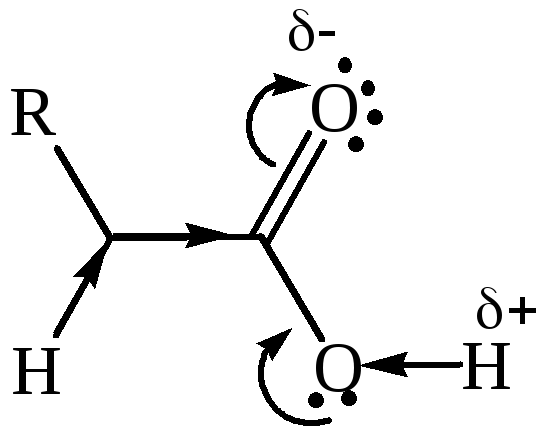
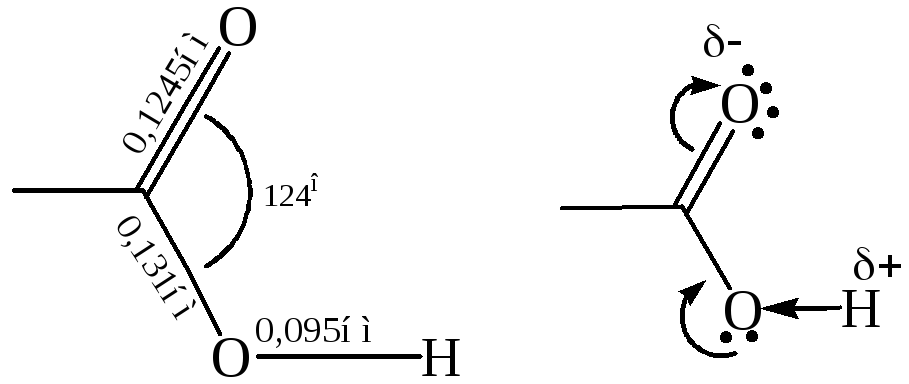
Электронное строение карбоксильной группы. Электронно-графическое изучение карбоновых кислот показало, что в их молекуле связь С=О длиннее, чем в кетонах, а связь С–О короче, чем в спиртах.
|
|
Это свидетельствует о взаимодействии электронных систем атома кислорода и С=О группы:
|
|
НЭП кислородного атома гидроксильной группы взаимодействует с π-электронами карбонильной группы – π,р-сопряжение, создающее условие для делокализации связей (+М). Это увеличивает полярность связи О–Н, но в то же время уменьшает положительный заряд по сравнению с карбонильными соединениями на углеродном атоме. Одновременно действует индуктивный эффект (–I) кислородных атомов. Следовательно, в карбоксильной группе имеются сильно поляризованные атомы Н и С, которые являются электрофильными центрами, и НЭП двух кислородных атомов, которые являются нуклеофильными центрами. Предполагают, что кислородный атом карбонильной группы имеет более нуклеофильный характер.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы:
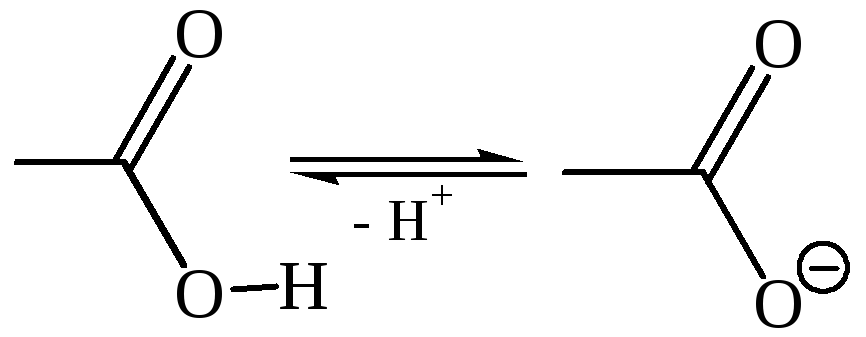
Кислоты, приведенные в таблице 24, значительно отличаются по своей силе. Муравьиная кислота и почти все α-замещенные уксусные кислоты сильнее, чем уксусная кислота. Так, трифторуксусная кислота сравнима по своей силе с соляной кислотой. Очевидно, что природа групп, находящихся поблизости от углеродного атома карбоксила, оказывает чрезвычайно большое влияние на силу кислоты.
Причиной легкой диссоциации карбоновых кислот является резонансная стабилизация карбоксилат-аниона. Если частица может быть представлена в виде нескольких резонансных форм, можно утверждать о ее относительно высокой стабильности, а чем более устойчивы продукты, тем легче протекает химическая реакция.
Электронное строение карбоксилатаниона. Согласно теории резонанса, карбоксилат-ион представляет собой гибрид двух структур, обладающих одинаковой стабильностью и, следовательно, одинаковым вкладом в результирующую структуру. Атом углерода связан с каждым из атомов кислорода одной «полуторной» связью. Отрицательный заряд равномерно распределен между двумя атомами кислорода:
-
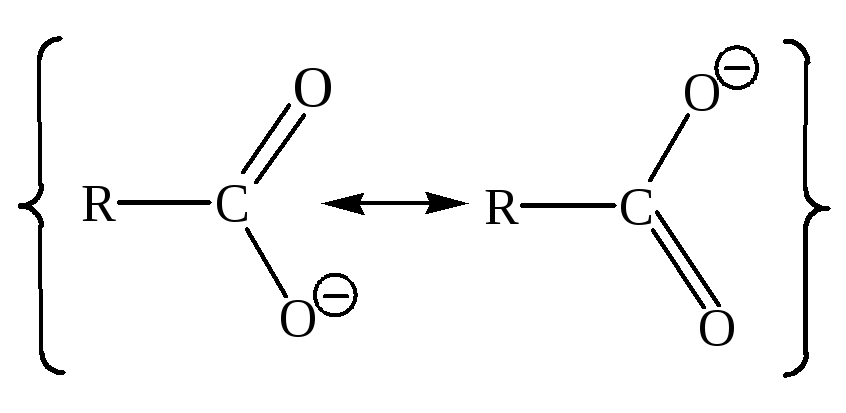
≡

Анион представляет собой резонансный гибрид,что подтверждается данными по длинам связей:
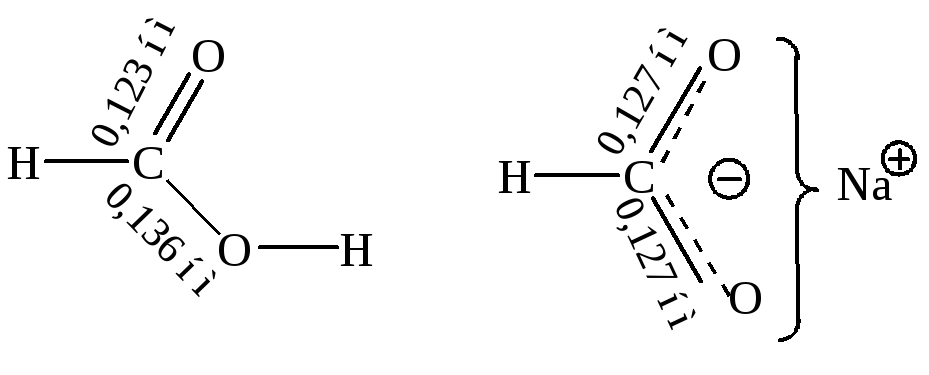
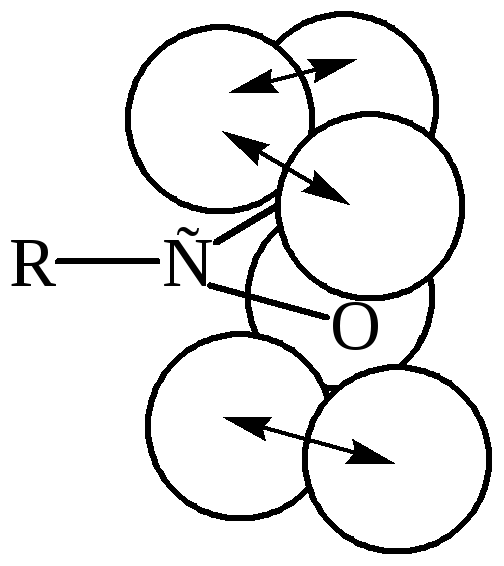
Электроныв резонансном гибриде связаны не с одним или двумя ядрами, а с тремя ядрами одновременно (один углерод и два кислорода),поэтому они прочнее удерживаются, связи становятся сильнее и анион–устойчивее. Именно такое участие электронов в образовании более чем одной связи, или, иными словами, делокализация («размазывание») электронного облака, и подразумевается в структуре, представляющей анион как резонансный гибрид двух структур:
Химические свойства. Общая характеристика реакционной способности. В карбоксильной группе благодаря +М эффекту происходит перераспределение электронной плотности – на кислородном атоме ОН–группы она понижается по сравнению со спиртами, а на углеродном атоме – повышается по сравнению с обычными оксосоединениями. Это приводит к изменению реакционной способности и гидроксила, и карбонильной группы:
уменьшение электронной плотности на кислородном атоме гидроксильной группы снижает нуклеофильность кислот. Кроме того, это умень- шение приводит к дополнительному смещению электронов связи О–Н и соответственно – к увеличению полярности этой связи. Поэтому водород менее прочно связан с атомом кислорода и отщепляется легче, чем у спиртов, т. е. повышается кислотность ОН-группы и резко уменьшается основность гидроксильного кислорода;
увеличение электронной плотности на углеродном атоме делает его менее доступным для нуклеофильной атаки. Поэтому С=О группа в карбоксиле практически потеряла способность вступать в реакции с нуклеофильными реагентами (могут реализоваться только некоторые АN реакции).
Таким образом, карбоксильная группа не является простой суммой свойств карбонила и гидроксила, а представляет собой новую функциональную группу с особыми, присущими ей свойствами.
Для карбоновых кислот характерны следующие типы реакций:
реакции, связанные с кислотными свойствами, сопровождающиеся разрывом связи О–Н;
реакции нуклеофильного замещения ОН-группы;
реакции по углеводородному остатку, приводящие к образованию замещенных карбоновых кислот.
Следует также отметить, что карбоновые кислоты термически стабильны, трудно окисляются и трудно восстанавливаются.
Кислотные свойства. Карбоновые кислоты могут проявлять О–Н кислотность, причем значительно большую, нежели спирты и фенолы. Повышенная кислотность карбоновых кислот может быть объяснена следующим образом:
связь О–Н в кислотах обладает большей полярностью благодаря +М эффекту в карбоксильной группе. Подобного рода эффект наблюдается и у фенолов. Однако смещение р-электронов в карбоксильной группе сильнее, чем в фенолах, поскольку на углеродном атоме карбонильной группы имеется дефицит электронов;
связь О–Н в кислотах имеет меньшую энергию диссоциации, поскольку при ее разрыве образуется карбоксилат-анион (ацилат-анион), стабилизированный благодаря полной делокализации отрицательного заряда. О полном выравнивании электронной плотности свидетельствует равноценность обеих связей С–О в карбоксилат-ионе.
Карбоновые кислоты значительно более сильные кислоты, чем спирты, фенолы и угольная кислота, однако уступают сильным минеральным кислотам. На силу карбоновых кислот оказывает значительное влияние природа радикала, связанного с карбоксильной группой. ЭА заместитель увеличивает полярность связи О–Н, стабилизирует образующийся карбоксилат-анион и тем самым усиливает кислотный характер молекулы. ЭД за- местители, наоборот, снижают полярность связи О–Н, дестабилизируют карбоксилат-анион, что приводит к уменьшению кислотных свойств.